桃叶鸦葱黄酮对脑缺血再灌注大鼠的保护作用△
许丽娟,韵磊,杨辉
(1.张家口市第四医院 药剂科,河北 张家口 075000;2.中国人民解放军第251医院,河北 张家口 075000;3.河北北方学院 药学系,河北 张家口 075000)
桃叶鸦葱是菊科舌状花亚科鸦葱属植物桃叶鸦葱ScorzoneraSinensisLipsch的干燥全草,广泛分布于我国北方各省,为我国重要的药食两用植物,资源丰富,但目前对其开发利用几乎为空白。在前期的研究中,我们发现桃叶鸦葱提取物具有多种生物活性[1-3]。对其化学成分的研究发现,桃叶鸦葱中含有黄酮、多糖及鞣质等多种成分[4-6]。Paraschos等[7]从鸦葱属植物中分离出化合物6,8-dihydroxy-3-(4-methoxyphenyl)isochroman-1-one(1),8-O-β-D-glucopyranosylscorzocreticin(2)及8-O-[α-L-rhamnopyranosyl(1→6)-β-D-glucopyranosyl](3),结构见图1。

图1 鸦葱属植物中化学成分结构
高敬宇[8]也从鸦葱属植物中获得5,7,3′,4′-tetrahydroxy-flavone 8-C-β-D-glucopyranoside、5,7,3′,4′-tetrahydroxy-flavone 6-C-β-D-glucopyranoside、5,7,4′-trihydroxy-flavone 6-C-β-D-xylofuranosyl-(1→2)-β-D-glucopyranoside 3种黄酮苷。由于黄酮结构中具有多个酚羟基,所以黄酮类化合物应该有较强的抗氧化活性。
近些年来,脑缺血再灌注损伤对人类的威胁越来越严重,学者们对其发病机制及治疗方法进行了较多的研究。目前认为,脂质过氧化是脑缺血再灌注损伤众多致病因子中重要的损伤机制之一[9]。而寻找安全有效的具有抗氧化活性的药物是对抗脑缺血再灌注损伤的重要方法之一。
基于以上现状,我们设想桃叶鸦葱黄酮可能对脑缺血再灌注具有一定保护作用。本实验参照文献方法对桃叶鸦葱总黄酮进行提取[4],以尼莫地平为阳性对照药品,观察桃叶鸦葱总黄酮对脑缺血再灌注损伤的影响,并初步探讨其作用机制。
1 材料
1.1 动物
清洁级雄性Sprague-Dawley大鼠(SD大鼠),8~10周龄,体质量(290±10)g,河北北方学院动物室提供,置于河北北方学院药学系实验室饲养房内饲养1周后用于实验。室温(20±2)℃,湿度(50±5)%。每日清洁1次垫料,期间自由进食普通鼠饲料,饮用自来水。
1.2 仪器
XTS-4A手术显微镜(镇江中天光学仪器有限责任公司),脑切片模具(300~600 g大鼠,北京西浓科技有限公司),Heraeus SEPATECH Biofuge 15R低温生物离心机(美国赛默飞公司),万分之一电子天平(北京赛多利斯科学仪器有限公司),MENLAB-U/4C501H生物信号采集处理系统(南京美易科技有限公司),Nikon Eclipse 80i光学显微镜(日本尼康),MODEL 680 型酶标仪(美国BIO-RAP 公司),AX-II X射线摄影暗盒(广东奥华医疗器械厂)。
1.3 药品与试剂
桃叶鸦葱采自河北张家口市崇礼区,由河北北方学院中医学院李永明教授鉴定为桃叶鸦葱Scorzo-nerasinensisLipsch全草;尼莫地平片(30 mg/片,黑龙江省地纳制药有限公司,批号:170702)制成混悬液;Anti-AQP4(H-80)(美国SANTA CRUZ 公司,货号:sc-20812);苏木素(北京康为世纪生物科技有限公司,货号:CW0127);二氨基联苯胺(北京中杉金桥生物技术有限公司,货号:ZLI-9018);伊红染液(北京中杉金桥生物技术有限公司,货号:ZLI-9613);多聚甲醛(安徽欣乐生物技术有限公司);其他试剂均为国产分析纯;实验用水为三重蒸馏水。
2 方法
2.1 供试液的制备
取桃叶鸦葱全草适量,于60 ℃恒温干燥90 min,采用文献方法提取总黄酮(TFSSL)[4],总黄酮的含量为0.92%,加适量0.9%氯化钠溶液,制备成质量浓度为4 mg·mL-1的混悬液。
2.2 实验分组与给药
取清洁级雄性健康SD大鼠72只,随机分为6组,每组12只,即假手术组,模型组,桃叶鸦葱总黄酮高、中、低剂量(400、200、100 mg·kg-1)组,尼莫地平(nimodipine,10.8 mg·kg-1)阳性对照组。造模后,各组每天上午9时灌胃给药1次,连续给药 20 d,模型对照组和假手术组灌胃给等体积0.9%氯化钠溶液。
2.3 大鼠脑缺血再灌注模型的制备
用改良 Longa栓线法制备大脑中动脉闭塞(MCAO)模型[10-12]。假手术组除插入线栓外,其他操作与模型制备相同。模型成功的判断标准:清醒后动物出现前肢弯曲,肩内旋,以对侧上肢为重的瘫痪,并伴有同侧颈交感神经麻痹综合征阳性。不成功者剔除。造模2 h后,将拴线抽出颈内动脉,实现再灌注。
2.4 指标测定
2.4.1神经功能损伤评分 各组于末次给药后24 h,以Zea Longa 5 级评分法为标准对其进行神经功能损伤评分[10]。
2.4.2桃叶鸦葱总黄酮对脑缺血-再灌注大鼠脑含水量的影响 于末次给药后24 h,每组随机取4只大鼠,处死后,快速断头取脑,滤纸吸去表面水分,取缺血侧半边大脑,称质量,然后于110 ℃干燥至恒质量,按公式(1)计算脑含水量[13]。

(1)
2.4.3免疫组织化学实验
2.4.3.1取材及组织处理 于末次给药后24 h,每组取剩余8只大鼠,腹腔内注射10%水合氯醛(0.35 g·kg-1)麻醉,依照文献方法取脑[14],取脑组织视交叉前后2 mm厚的中段脑组织,于4%多聚甲醛(4 ℃)中,固定一周,乙醇梯度脱水,二甲苯透明、浸蜡、常规石蜡包埋,连续冠状切片,每片厚度为5 μm,烤干后备用。
2.4.3.2苏木素-伊红(HE)法检测脑组织病理形态 每组随机选取4张切片,参照文献方法[15],切片经二甲苯(Ⅰ、Ⅱ)脱蜡15 min,经二甲苯+无水乙醇(1∶1)1 min,无水乙醇(Ⅰ、Ⅱ)、95%乙醇(Ⅰ、Ⅱ)和90%乙醇各5 min,经80%、70%、50%乙醇和蒸馏水各2 min,苏木精染色3 min,经1%盐酸乙醇分色2 min,于自来水蓝化5 min,蒸馏水稍洗,经50%,70%、80%、90%乙醇各2 min,通过伊红染液10 s,经95%乙醇(Ⅰ、Ⅱ、Ⅲ)、无水乙醇(Ⅰ、Ⅱ)各2 min,二甲苯+无水乙醇(1∶1)1 min,最后经二甲苯(Ⅰ、Ⅱ)透明处理10 min,用中性树胶封片。光学显微镜下观察脑组织病理形态学改变,并在高倍镜(400×)下采取盲法对海马CA1 区(海马腹侧面,通过海马沟与齿状回相接界处)[16]的锥体细胞进行计数,在一张切片上取两个连续的视野计数,以二者的平均值代表该切片的锥体细胞计数,最后取4张切片的平均值作为该组别的锥体细胞计数[17]。
2.4.3.3检测AQP4 每组随机选取3张切片,参照王海征等[18]的实验方法采用二步法免疫组化法进行染色。用0.1 mol·L-1的EDTA缓冲液(pH 9.0)进行微波抗原修复20 min,每片滴加一抗50 μL,4 ℃孵育40 h,37 ℃孵育1 h,PBS冲洗。每片滴加二抗Ⅰ50 μL,37 ℃孵育0.5 h,PBS冲洗,然后每片滴加二抗Ⅱ50 μL,37 ℃孵育1 h,PBS冲洗,最后DAB显色10 min,蒸馏水洗涤终止,苏木素染细胞核5 min,蒸馏水洗涤终止,显色后脱水,透明,封片。利用光学显微镜联合数字显微照相机,分别采集各组大鼠缺血侧海马区5个视野的图像,通过NIS-Elements Basic Research图像分析软件计算出各视野下阳性表达AQP4的积分光密度,用以反映AQP4的免疫染色强度。
2.5 统计分析
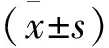
3 结果
3.1 神经功能损伤评分
首先去除昏迷不醒者,具体的评分标准:0分代表神经症状不明显;1分代表缺血对侧前肢伸展不全;2分代表向缺血对侧旋转;3分代表行走时肢体向缺血对侧倾斜;4分代表完全无法独立行走。结果见表1。假手术组大鼠未出现神经功能缺损症状,而其他组大鼠均出现了右侧前肢伸展不全、行走不稳、向右侧倾斜,严重者无法独立行走等轻重程度不一的神经功能障碍表现。与假手术组比较,模型组大鼠神经功能损伤评分显著升高(P<0.01),即缺血再灌注能导致大鼠出现显著的神经功能损伤。与模型组比较,尼莫地平组及桃叶鸦葱总黄酮高、中剂量组大鼠神经功能损伤评分均显著降低,即尼莫地平及桃叶鸦葱总黄酮高、中剂量均能减轻大鼠神经功能损伤(P<0.05)。
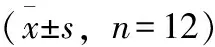
表1 桃叶鸦葱总黄酮对脑缺血-再灌注大鼠神经症状评分的影响
注:与假手术组比较,##P<0.01;与模型组比较,△P<0.05;下同。
3.2 桃叶鸦葱总黄酮对脑缺血-再灌注大鼠脑含水量的影响
表2结果显示,与假手术比较,模型组大鼠脑含水量显著升高(P<0.05);与模型组相比,桃叶鸦葱总黄酮高、中剂量组和尼莫地平组大鼠脑含水量显著降低(P<0.05),低剂量组大鼠脑含水量较模型组低,但差异无统计学意义(P>0.05)。说明连续给药20 d后,桃叶鸦葱总黄酮高、中剂量组能有效抑制脑含水量的增加。
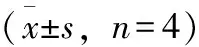
表2 桃叶鸦葱总黄酮对缺血再灌注大鼠脑含水量的影响
3.3 免疫组化实验
3.3.1 HE法检测脑组织病理形态 图1的HE染色结果显示,假手术组大鼠脑组织神经元排列紧凑整齐,胞核染色清晰;血管内皮细胞间相连紧密,形态完整,管周组织未见异常改变;海马CA1区锥体细胞排列规整,胞核居于胞体中央,且可见1~2个清晰核仁。模型组大鼠缺血侧海马区组织结构严重破坏,大量神经元细胞变性坏死,原有的整齐排列被破坏,细胞核形态模糊,胞体皱缩,细胞间质疏松,胶质细胞增生明显;海马CA1区锥体细胞体积变小,锥体细胞数较假手术组明显降低(P<0.01)。与模型组相比,桃叶鸦葱总黄酮中、高剂量组、尼莫地平组大鼠变性坏死组织范围缩小、程度减轻,海马CA1区锥体细胞排列规则,神经元脱失不明显,桃叶鸦葱总黄酮中、高剂量组及尼莫地平组大鼠锥体细胞数较模型组明显增加(P<0.05),结果见表3。
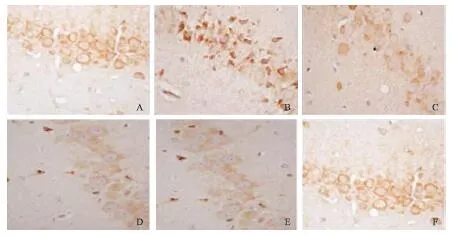
注:A.假手术组(400×);B.模型组(400×);C.桃叶鸦葱总黄酮低剂量组(400×);D.桃叶鸦葱总黄酮中剂量组;E.桃叶鸦葱总黄酮高剂量组(400×);F.尼莫地平组(400×)。图1 桃叶鸦葱总黄酮对脑缺血-再灌注大鼠海马CA1 区病理损伤的影响(HE 染色)

表3 桃叶鸦葱总黄酮对脑缺血-再灌注大鼠海马CA1椎体细胞数的影响
3.3.2 AQP4检测 表4、图2结果显示,AQP4 阳性表达主要集中在大鼠脑膜等处的胶质界膜上及毛细血管壁周围的星形胶质细胞的胞膜上和胞浆中,呈现出黄色细颗粒。脑缺血再灌注24 h,模型组大鼠海马区 AQP4 表达明显高于假手术组(P<0.01);桃叶鸦葱总黄酮中、高剂量组及尼莫地平组大鼠 AQP4 表达均明显低于模型组(P<0.05)。

表4 桃叶鸦葱总黄酮对脑缺血-再灌注大鼠海马区AQP4表达的影响
4 讨论
近年来,黄酮类化合物的生物活性已经成为人们研究的热点问题之一,越来越多的研究证实,不同植物体内提取的黄酮类化合物均通过不同的机制表现出极强的脑缺血保护作用。
葛根素是由豆科植物中提取的异黄酮碳苷类成分,目前已有注射剂上市,研究表明,葛根素通过对海马CA1区神经元保护作用[19],抑制Janus激酶2(JAK2)及信号转导子和转录激活子3(JAK2/STAT3)信号通路的异常激活[20]、抗炎[21]等多种机制对脑缺血再灌注损伤产生神经保护作用。黄芩苷和黄芩素主要是从黄芩根部提取的黄酮类化合物,可能通过抑制脑缺血后兴奋性氨基酸含量的增加而发挥其脑保护作用[22]。柚皮素属于二氢黄酮类化合物,柚皮苷的苷元,在柑橘类等水果中含量较多,通过抗氧化改变脑缺血后脑组织中核苷酸结合寡聚域样受体2(NOD2)、受体相互作用蛋白2(RIP2)、核转录因子kappa B(NF-κB)、金属蛋白酶9(MMP-9)及紧密连接蛋白-5抗体(claudin-5)等蛋白的表达[23-24],产生神经保护的作用。
脑水肿是脑缺血再灌注的一个严重的继发性损伤,可以引起颅内压力短时间内急剧升高,严重者可危及生命[25],当脑组织在病理情况下发生缺血缺氧时,大量兴奋性氨基酸积累于细胞外,导致大量钙离子内流,从而生成大量自由基,导致细胞凋亡或坏死,进一步引发血脑屏障破坏,血管通透性增加,导致血管源性脑水肿[26]。

注:A.假手术组(400×);B.模型组(400×);C.桃叶鸦葱总黄酮低剂量组(400×);D.桃叶鸦葱总黄酮中剂量组;E.桃叶鸦葱总黄酮高剂量组(400×);F.尼莫地平组(400×)。图2 桃叶鸦葱总黄酮对脑缺血-再灌注大鼠海马区AQP4表达的影响(免疫组化染色)
AQP4是中枢神经系统中最为重要的水通道蛋白,它在脑内的分布非常广泛,位于海马区的AQP4主要功能为调控细胞间隙的大小,以及调节神经元的兴奋性[27-29]。Aoki等[30]对AQP4表达的研究发现,在人类缺血性脑卒中发生后,AQP4在脑组织中表达水平显著升高,且在缺血中心的梗死灶周边表达最强。本实验结果表明,桃叶鸦葱总黄酮对大鼠脑缺血再灌注所致脑水肿的抑制作用与其对AQP4表达的抑制作用有关,抑制脑水肿的发生发展应该是桃叶鸦葱总黄酮对脑缺血再灌注的保护的机制之一。
本实验结果表明,桃叶鸦葱总黄酮可引起脑缺血再灌注大鼠海马区AQP4的表达下调,抑制脑含水量的增加,降低脑缺血再灌注大鼠的神经症状评分,发挥神经保护作用。
[1] 杨辉,李秀荣.桃叶鸦葱抗抑郁作用的实验研究[J].中成药,2011,33(9):1588-1589.
[2] 孙雪,杨辉.桃叶鸦葱对小鼠抗应激能力的影响[J].现代中药研究与实践,2014,28(2):31-32.
[3] 曾春萍.桃叶鸦葱抗炎镇痛作用的实验研究[J].天津中医药,2010,27(6):515-517.
[4] 杨辉,王治宝.桃叶鸦葱根中总黄酮的提取工艺[J].食品研究与开发,2015,36(5):35-37.
[5] 杨辉,李秀荣.不同产地桃叶鸦葱多糖的含量测定[J].河南工业大学学报(自然科学版),2010,31(5):59-61.
[6] 杨辉,王治宝.桃叶鸦葱鞣质的提取及体外抗氧化作用[J].中国实验方剂学杂志,2012,18(18):244-246.
[7] Paraschos S,Magiatis P,Kalpoutzakis E,et al.Three new dihydroisocoumarins from the Greek endemic species Scorzonera cretica[J].Nat Prod,2001,64:1585-1587.
[8] 高敬宇.鸦葱总黄酮纯化方法及HPLC指纹图谱的研究[D].长春:吉林大学,2015.
[9] 李蕾,许栋明,王文,等.莫诺苷抑制大鼠脑缺血再灌注模型皮层脂质过氧化作用的研究[J].中国康复理论与实践,2009,15(11):1015-1016.
[10] Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[11] Liang G J,Shi B,Luo W N,et al.The protective effect of caffeic acid on global cerebral ischemia-reperfusion injury in rats[J].Behavioral and Brain Functions,2015,11(1):1-10.
[12] Guo C,Tong L,Xi M M,et al.Neuroprotective effect of calycosin on cerebral ischemia and reperfusion injury in rats[J].J Ethnopharmacol,2012,144:768-774.
[13] 叶建新,林航,穆军山,等.高压氧治疗对血管性痴呆大鼠学习记忆能力及海马锥体细胞的影响[J].中国康复理论与实践,2007,13(11):1032-1033.
[14] 康康,冀书娟,梅海云.通络救脑注射液对大鼠脑缺血/再灌注神经保护作用的研究[J].中国实用神经疾病杂志,2016,19(5):57-59.
[15] 韩天龙,王敏,红敏,等.Masson三色染色与HE染色在豚鼠牙齿组织石蜡切片中的比较研究及应用[J].中国畜牧兽医,2011,38(3):55-57.
[16] 孙晓彩,李力,张敏,等.Wistar大鼠海马CA1区、CA3区和齿状回区的解剖分割[J].中国应用生理学杂志,2012,28(2):189-192.
[17] Gibson G E,Blass J P,Beal M F,et al.the alpha ketoglutarate dehydrogenase complex:a mediator between mitochondria and oxidative stress in neurodegeneration[J].Mol Neurobiol,2005,31(1/3):43-63.
[18] 王海征,赵晖,张弛,等.风药、补虚药对脑缺血大鼠侧脑室GFAP、AQP-4 表达的影响[J].北京中医药大学学报,2013,36(10):676-679.
[19] 尹雪莉,桂丽,李珍.葛根素预处理对局灶性脑缺血再灌注大鼠海马CA1区神经元损伤的影响及其机制[J].安徽医科大学学报,2015,50(6):723-726.
[20] 陈媛,黄晓松,吴海金,等.葛根素对大鼠脑缺血再灌注损伤后JAK2/STAT3信号通路的影响[J].湖南中医杂志,2017,33(4):144-147,165.
[21] 窦思奇,江培.葛根素对脑缺血再灌注损伤的抗炎作用[J].黑龙江科技信息,2014(36):74.
[22] 吕有文,张鹏,侯霞,等.黄芩素甙对脑缺血后大鼠海马组织兴奋性氨基酸含量的影响[J].实用临床医学,2009,10(7):1-3.
[23] 王凯华.基于线粒体功能失调与Nrf2介导的抗氧化应激探索柚皮素对脑缺血再灌注损伤的神经保护作用[D].广州:南方医科大学,2017.
[24] 白雪.柚皮素对永久性脑缺血大鼠发挥神经保护作用的机制:下调NOD2,RIP2,NF-κB,MMP-9的表达,上调Claudin-5的表达[C]//中国中西医结合学会神经科专业委员会.第十一次中国中西医结合神经科学术会议论文汇编.北京:中国中西医结合学会神经科专业委员会,2015:2.
[25] Lee J H,Cui H S,Shin S K,et al.Effect of propofol post-treatment on blood-brain barrier integrity and cerebral edema after transient cerebral ischemia in rats[J].Neurochemical Research,2013,38(11):2276-2286.
[26] 黄如训,苏镇培.脑卒中[M].北京:人民卫生出版社,2002:117-128.
[27] 刘健锋,丁艳平,王建林,等.脑水通道蛋白的分布、功能及调控机制[J].中国组织工程研究,2014,18(2):314-321.
[28] 李胜,屈春凤,李润水,等.水牛水通道蛋白8基因克隆及表达分析[J].中国畜牧兽医,2014,41(3):44-48.
[29] 屈春凤,李胜,李卉,等.水牛水通道蛋白9基因克隆及其表达分析[J].中国畜牧兽医.2015,42(7):1621-1629.
[30] Aoki K,Uchihara T,Tsuchiya K,et al.Enchanced expression of aquaporin4 in human brain with infarction[J].Acta Neuro Pathologica,2003,106(2):121-124.

