棘胸蛙白内障病原的分离、鉴定及药物敏感性分析
吴明皇,林 玲,孙承文,王英英,石存斌*(.平阳县渔业技术推广站,浙江 温州 35400; .中国水产科学院珠江水产研究所,广东 广州 50385)
棘胸蛙(Quasipaaspinosa),俗称石蛙、石鸡,具有较高的营养价值。上世纪80年代开始人工驯养,随着人工繁殖技术的日渐成熟[1-3],养殖规模不断扩大,再加上养殖密度的提高、养殖管理和疾病防治措施等方面存在不足,导致棘胸蛙的病害也相继增多,如烂皮病、嗜水气单胞菌病、歪头病、白内障等[4-10],给养殖业造成了巨大的经济损失。2013年开始,温州市苍南地区棘胸蛙流行一种以“白内障”为主要特征的疾病,临床症状表现为病蛙眼睛白浊、头部歪斜、厌食。该病传染性强、死亡率高,使用多种药物效果都不明显,对养殖户带来极大的损失。根据国内外报道,引起蛙“白内障”的病原有:金黄色葡萄球菌、气单胞菌、醋酸钙不动杆菌、布氏柠檬酸杆菌、脑膜炎败血金黄杆菌(脑膜败血伊丽莎白菌)等[10-15],由于引起“白内障”的病原菌种类多样,为了解决这一问题,笔者对棘胸蛙“白内障”病原进行了分离鉴定,人工感染试验确定病原菌,并进行抗生素药敏试验,以期为该病的诊断和防治提供依据。
1 材料与方法
1.1 材料
患病棘胸蛙取自苍南县赤溪镇凤阳社区棘胸蛙养殖场,50~300 g大小不等,眼球白浊,部分头部歪斜,在水面上打转。健康棘胸蛙由苍南县藻溪镇石蛙养殖场提供,体重50~100 g,该养殖场没有发生过此类疾病。
营养琼脂、营养肉汤培养基等购自北京陆桥技术有限公司;革兰氏染色试剂盒购自上海铭博生物科技有限公司;DNA提取试剂盒购自爱思进(Axygen)生物科技有限公司;PCR有关试剂购自天根生化科技有限公司;ATB细菌鉴定条购自法国生物梅里埃公司;药敏纸片购自杭州天和微生物试剂有限公司。其他常规试剂由实验室自行配制。
1.2 细菌的分离
取“白内障”病状的棘胸蛙,按照常规无菌操作方法,用75%酒精进行体表消毒,用接种环从脑、肝脏中取组织接种于营养琼脂平板上,于28 ℃恒温培养24 h,挑取优势菌落划线分离,进行纯化培养。纯化后菌落用于人工感染和鉴定试验。
1.3 人工感染试验
将纯化后的分离菌接种于营养肉汤培养基中,28 ℃摇床培养18 h,离心收集菌体,用生理盐水稀释成3×108mL-1菌悬液,采用大腿注射法进行人工感染,每只蛙注射0.2 mL菌悬液,对照组注射0.2 mL生理盐水。感染后分别饲养在塑料水族箱中,进行日常管理,试验期间水温20~25 ℃,每日观察、记录发病和死亡情况,并进行病原再分离。
1.4 病原菌的鉴定
1.4.1 形态学观察
将菌株接种于普通营养琼脂平板,28 ℃恒温培养24 h,观察菌落形态,并对细菌进行革兰氏染色,油镜下观察菌体形态特征。
1.4.2 细菌生理生化鉴定
生理生化特性测定参照ID 32 E(法国生物梅里埃公司)生化鉴定条说明书进行。
1.4.3 细菌16S rRNA基因序列分析
用基因组提取试剂盒提取细菌的全基因组DNA,采用细菌16S rRNA基因通用引物进行PCR扩增,扩增上游引物8F:5’-AGA GTT TGA TCC TGG CTC AG-3’,下游引物1492R:5’-GGT TAC CTT GTT ACG ACT T-3’,引物由上海生工生物工程有限公司合成。PCR反应条件:94 ℃预变性5 min;94 ℃变性5 s,56 ℃退火40 s,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min,4 ℃保存。PCR产物纯化后,送至上海生工生物工程有限公司进行测序。根据测序结果,在NCBI中用BLAST进行同源性比较。
1.5 药物敏感性试验
采用药敏纸片琼脂平板扩散法。将病原菌划线接种于营养琼脂平板中,培养18 h后用生理盐水洗下菌苔,再用生理盐水稀释为0.5 倍麦氏浓度后,用棉拭子蘸取菌液均匀涂布培养基表面,然后用镊子将药敏纸片贴在琼脂平板表面,控制好纸片间的间距,28 ℃恒温培养12~16 h 后测量抑菌圈大小,并参照杭州天和微生物试剂有限公司的药敏试验判断标准来判定结果。
2 结果
2.1 患病棘胸蛙主要症状
病蛙最为明显的症状是两个眼球变白(类似白内障,图1),有些出现运动机能失调,在水面上打转。

图1 患病棘胸蛙眼部特征观察
2.2 人工感染
肌肉注射感染健康棘胸蛙7 d后,试验组10只蛙全部出现白内障症状并开始死亡,15 d后试验组死亡率100%(表1),与自然发病症状基本相同。对照组全部存活。从人工感染的棘胸蛙脑部和肝脏分离得到与PY-SW1506特征一致的菌株,说明分离菌株对棘胸蛙具有较强的致病力。
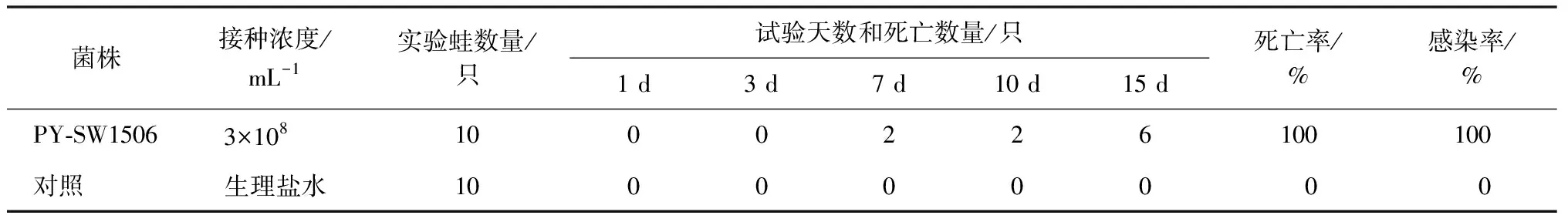
表1 人工感染试验结果
2.3 分离鉴定
2.3.1 病原形态特征
从肝脏和脑组织分离的两株菌,形态大小一致,革兰氏染色观察为阴性短杆菌(图2),在培养基上形成的菌落呈圆形,表面光滑湿润,边缘整齐,微凸,呈微黄色。
2.3.2 生理生化鉴定
根据表2病原菌的生理生化特征,经过全自动微生物分析系统鉴定为脑膜败血伊丽莎白菌(Elizabethkingiameningosepticum)。

图2 经革兰氏染色后的细菌形态(×1 000)
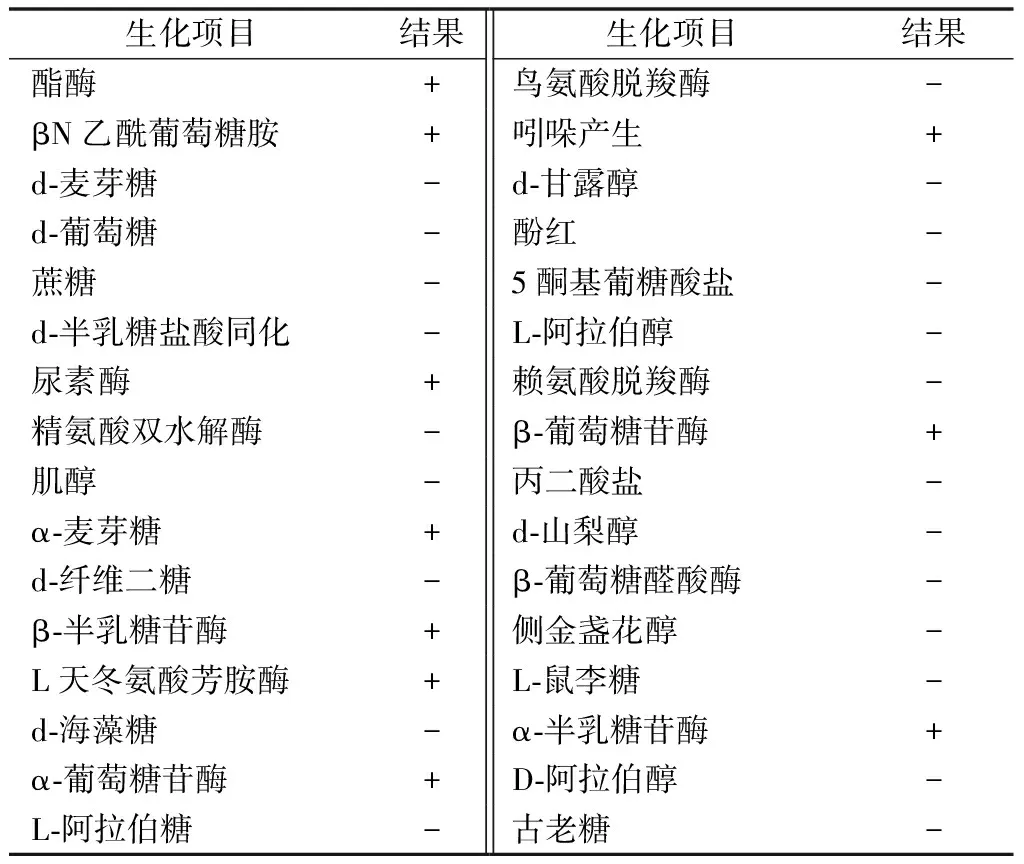
表2 分离病菌的生理生化鉴定结果
2.3.3 细菌16S rRNA基因序列
PCR扩增病原菌的16S rRNA基因片段大约为1 418 bp,对序列进行同源性分析发现,与GenBank上收录的脑膜败血伊丽莎白菌(GenBank:HQ154560.1)和脑膜炎败血金黄杆菌(Chryseobacteriummeningosepticum)(GenBank:AY468482.1)菌株有99%同源性,因此鉴定该菌株为脑膜败血伊丽莎白菌。
2.4 药物敏感性
测定了致病菌对26种药物的敏感性(表3), 结果显示对恩诺沙星、氧氟沙星、左氧氟沙星、萘啶酸、万古霉素、多西环素、利福平等7种药物高度敏感,对链霉素、头孢噻肟、头孢曲松、头孢西叮等4种药物中度敏感,对氨苄西林、青霉素、头孢唑林等15种药物表现为耐药性。
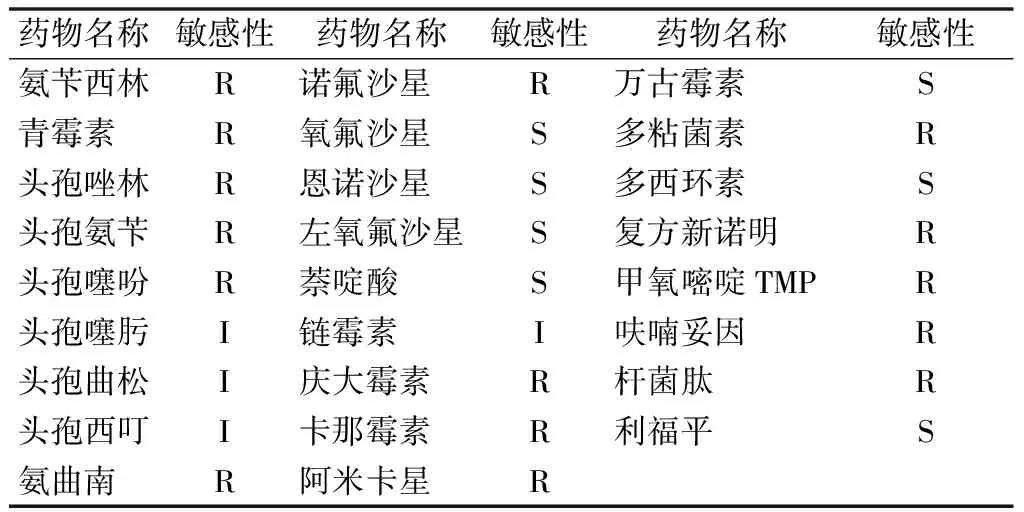
表3 致病菌对26种药物的敏感性
注:S表示敏感;I表示中度敏感;R表示耐药。
3 讨论
本文对患“白内障”的棘胸蛙进行细菌分离,将分离得到的细菌对健康棘胸蛙进行了攻毒感染试验,并通过生理生化和16S rRNA基因序列分析确定了棘胸蛙“白内障”的病原是脑膜败血伊丽莎白菌。
脑膜败血伊丽莎白菌,曾称脑膜炎败血金黄杆菌、脑膜炎败血黄杆菌,属于黄杆菌纲,黄杆菌目,黄杆菌科,伊丽莎白菌属,广泛存在于自然环境中,该菌能引起新生儿暴发性脑膜炎、败血症等[16-17],在水产养殖中,对蛙、鳖、黄鳝等多种水生动物具有较强的致病性[18-20],它能通过血脑屏障直接侵入大脑,张奇亚等[21]对患旋游症美国青蛙进行病理组织切片观察,认为脑膜炎败血金黄杆菌引起脑组织受损,脑功能障碍,视觉功能减弱或逐渐丧失,这也是为什么由脑膜败血伊丽莎白菌引起的“白内障”病蛙通常伴随着头部歪斜、狂游、身体失去平衡或浮于水面打转等症状的主要原因。
药敏试验表明,脑膜败血伊丽莎白菌具有较强的耐药性,试验中致病菌对26种药物的药敏试验结果表明,仅恩诺沙星、氧氟沙星、左氧氟沙星、萘啶酸、万古霉素、多西环素、利福平等7种抗菌药物对该菌有较好的抗菌作用。但是在生产上,我们分别使用了强力霉素和恩诺沙星来治疗,效果均不明显,可能的因素:1)由于这些药物难以通过血脑屏障深入到大脑和眼部;2)脑组织和视觉神经损伤的不可逆性,视觉不能完全康复,导致病蛙寻找不到食物,最终还是因为饥饿而死。这也可能是脑膜败血伊丽莎白菌危害极大并难以治疗的原因。
脑膜败血伊丽莎白菌是致病力强、耐药性强的病菌,养殖户应高度重视,在生产上更应以防为主,主要控制好养殖环境和增强体质,食用优质饵料和接种疫苗提高抗病力[22]。对蛙、水体、饵料及生产用具进行定期或不定期的消毒,一旦发现病蛙应及时清理,以免交叉感染。
参考文献:
[1] 陈其斌. 驯养繁殖野生棘胸蛙获成功 [J]. 中国水产,1986(4):21.
[2] 陈平辉,周希量,李小明,等. 野生棘胸蛙生态养殖新技术 [J]. 科学养鱼,2013(3):35-36.
[3] 周先文,彭英海,何斌,等. 棘胸蛙的生态养殖模式及效益分析 [J]. 河北渔业,2016(9):32-33.
[4] 王瑞君,熊筱娟. 棘胸蛙烂皮病奇异变形杆菌的分离、鉴定及对药物敏感性研究 [J]. 淡水渔业,2012,42(4):31-34.
[5] 马有智,何 琳,徐海圣. 石蛙致病性嗜水气单胞菌的分离、鉴定及药敏试验 [J]. 黑龙江畜牧兽医,2013(21):116-117.
[6] 宋婷婷,郑荣泉,张俊美,等. 一种棘胸蛙新类型疾病病原分析 [J]. 福建水产,2014,36(5):344-350.
[7] 李晓英,罗 洁,杜孝田,等. 棘腹蛙“水肿病”病原的分离鉴定 [J]. 动物医学进展,2016,37(8):116-119.
[8] 郑卫军,宋婷婷,郑善坚,等. 棘胸蛙出血病病原鉴定及药敏试验 [J]. 华东森林经理,2016,30(1):42-45.
[9] 李明,宋婷婷,郑荣泉,等. 棘胸蛙歪头病病原分离、鉴定与药敏试验 [J]. 安徽农业科学,2016,44(3):64-66.
[10] 廖冰洁,樊汶樵,周莉,等. 一例棘腹蛙“白内障”的病原分离鉴定 [J]. 湖北畜牧兽医,2014,35(8):8-11.
[11] 纪荣兴,邹文政,莫英军,等. 牛蛙“白内障”病病原的初步研究 [J]. 集美大学学报(自然科学版),2003,8(1):8-11.
[12] 陈晓凤,陈祈辉,夏梅珠,等. 牛蛙“白内障”病病原及防治的研究 [J]. 福建水产,1995(2):13-18.
[13] 程晓云,郑芊芷,宋婷婷,等. 棘胸蛙白内障病原鉴定及药敏试验 [J]. 浙江农业科学,2016,57 (7):1141-1143,1151.
[14] XIE Z Y, ZHOU Y C, WANG S F, et al. First isolation and identification ofElizabethkingiameningosepticafrom cultured tiger frog,Ranatigerinarugulosa[J]. Veterinary Microbiology, 2009, 138(1/2):140-144.
[15] 吴兴镇. 黑斑蛙白内障病原菌的分离鉴定及体外抑菌作用研究 [D]. 重庆:西南大学, 2016.
[16] 陈爱平,江育林,钱冬. 蛙脑膜炎败血金黄杆菌病 [J]. 中国水产,2012(5):51-52.
[17] 陈杏春. 脑膜炎败血伊丽莎白菌研究进展[J]. 检验医学与临床,2013,10(23):3213-3215.
[18] BERNARDET J F, VANCANNEYT M, MATTETAILLIEZ O, et al. Polyphasic study ofChryseobacteriumstrains isolated from diseased aquatic animals [J]. Systematic & Applied Microbiology, 2005, 28(7):640-660.
[19] 蔡完其,孙佩芳,朱泽闻,等. 中华鳖脑膜炎败血性黄杆菌病的研究 [J]. 水产科技情报,1997,24(4):156-161.
[20] 周煜华,何成伟. 黄鳝鱼脑膜炎脓毒性黄杆菌的分离与鉴定 [J]. 广西畜牧兽医,1998,14(3):5-7.
[21] 张奇亚,李正秋,吴玉琛,等. 美国青蛙“旋游症”病原菌的分离鉴定及其组织病理学观察 [J]. 中国兽医学报,1999,19(2):152-155.
[22] 周永灿,朱传华,陈国华,等. 虎纹蛙白内障病病原的分离鉴定及其免疫防治 [J]. 上海水产大学学报,2001,10(1):16-21.

