莲心碱对LPS诱导小鼠急性肺损伤的保护作用
陈朝阳,姚茹,王璐,王晨阳,郭民,宋国华,张锐虎
(山西医科大学实验动物中心;实验动物与人类疾病动物模型山西省重点实验室,太原 030001)
急性肺损伤(acute lung injury,ALI)是各种因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,造成以肺实质弥漫性炎症为特征的呼吸疾病[1]。研究报道,炎症介质和氧化应激介导的肺组织损伤是ALI发病的主要机制[2]。脂多糖(lipopolysaccharide, LPS),是革兰阴性细菌细胞壁的成分,也是细菌内毒素的主要成分,能够激活单核吞噬细胞系统,促使促炎性细胞因子如肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)的释放,激活中性粒细胞,产生髓过氧化物酶(myeloperoxidase,MPO)和炎症介质氧自由基,导致肺组织发生炎症反应和氧化应激[3-4]。活性氧自由基(reactive oxygen species,ROS)产生过多,可抑制氧自由基清除剂超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(glutathione,GSH)等酶的活性,损伤肺组织造成ALI的发生[5]。因此,寻求抑制氧化和炎症靶点的药物对ALI防治具有重要作用。
莲心碱(liensinine, LIE),是从中草药莲子心中提取的一种双苄基四氢异喹啉类生物碱[6]。余万桂等[7-8]研究了莲心碱对大鼠脑缺血再灌注的影响,发现莲心碱能够改善脑神经功能障碍,缩小脑梗死面积,增强抗氧化物酶SOD、GSH的活性,减少炎性因子TNF-α的表达,由此可推测莲心碱可能既具有抗氧化又具有抗炎症的作用。因此,本研究通过建立LPS诱导的急性肺损伤模型,探讨莲心碱对ALI的抗炎、抗氧化保护作用。
1 材料与方法
1.1 材料
1.1.1实验动物
6~8 周SPF雄性BALB/c小鼠72只,20~22 g,由山西医科大学实验动物中心提供【SCXK(晋)2015-001】,动物实验在该中心屏障动物实验室中进行【SYXK(晋)2015-001】。实验期间动物给予自由饮食。饲养环境的温度为20~24℃,相对湿度控制在40%~70%,明暗各12 h交替。本实验操作符合实验动物伦理学要求(伦理审批号:IACUC2017-007)。
1.1.2药物与试剂
莲心碱购自北京中科质检生物有限公司,批号:2586-96-1;LPS、Evans blue购自美国Sigma公司;瑞氏吉姆萨染色购自TNF-α、IL-6、IL-1βELISA试剂盒购自北京四正柏生物科技有限公司。ROS、SOD、GSH、MPO试剂盒购自南京建成有限公司。
1.1.3仪器
轮转切片机(RM2235,Leica公司,德国),倒置显微镜(BX51,Olympus公司,日本),流式细胞仪(FACS-Calibur,BD公司,美国),微孔分光光度计(Epoch,Biotek公司,美国),高速微量离心机(3-18k,Sigma公司,美国),电热恒温水浴锅(HH-2,北京科伟永兴仪器有限公司)。
1.2 方法
1.2.1构建小鼠急性肺损伤模型
将72只小鼠随机分为六组,正常对照组、模型组(LPS)、莲心碱(2、4、8 mg/kg)组、地塞米松(dexamethasone,DEX,5 mg/kg)组,每组12只。小鼠禁食12 h后,分别尾静脉注射生理盐水、莲心碱和地塞米松。给药1 h后,戊巴比妥钠麻醉小鼠,将LPS滴注入小鼠鼻孔中(10 μg LPS,用50 μL PBS溶解),正常组小鼠鼻孔内滴注50 μL PBS[9],12 h后牺牲小鼠。
1.2.2收集支气管肺泡灌洗液和相应指标检测
小鼠处死后,暴露气管并将导管插入气管,用1 mL注射器抽取0.5 mL PBS进行灌洗,灌洗3次收集支气管肺泡灌洗液(BALF)[10]。取一部分BALF采用BCA蛋白试剂盒检测蛋白含量,其余BALF迅速4℃、1400 r/min、10 min离心,取上清液置-20℃冻存,按照ELISA试剂盒说明书方法分别检测炎性因子TNF-α、IL-6、IL-1β的含量,离心后的沉淀用于细胞分类计数,采用瑞氏吉姆萨(Wright-Giemsa)染色法进行细胞涂片。
1.2.3肺毛细血管通透性检测
处死小鼠前15 min每组取6只,按2 mL/kg经尾静脉注射2%的伊文思蓝后处死小鼠,处死时立即抽取左心室血液,用针头刺入右心室,生理盐水冲洗肺血管至冲洗液澄清为止,取肺组织放入1 mL/100 mg的甲酰胺溶液中浸泡,50℃隔水式培养箱温育24 h,提取伊文思蓝渗出液在分光光度计620 nm下检测吸光度,通过标准曲线计算伊文思蓝含量[11]。
1.2.4病理组织的观察
取右肺上叶置4%的中性甲醛中固定24 h,梯度酒精脱水,石蜡包埋,切片4 μm,烤片,脱蜡,HE染色,脱水透明,封片。
1.2.5匀浆组织中MPO、MDA、SOD、GSH的检测
取右肺下叶,液氮研磨后,加入PBS制成匀浆组织,漩涡振荡并3 000 r/min离心10 min,取上清液按照试剂说明书分别进行MPO、MDA、SOD、GSH的检测。
1.2.6肺组织中ROS的检测
取左肺组织,用研磨棒边研磨边以PBS冲洗,收集细胞悬液于300 μm尼龙网过滤,PBS重悬后细胞计数不少于106细胞个/mL。每组样品加入10 μmol/L的荧光探针 DCFH-DA,37℃孵育30 min,1400 r/min离心10 min,用PBS洗涤2次后收集细胞沉淀物,加入200 μL binding buffer用流式细胞仪进行检测,结果以平均荧光强度值(每个细胞含有的荧光强度)表示。
1.3 统计分析
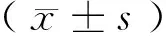
2 结果
2.1 各组小鼠急性肺损伤的病理学改变
HE染色结果显示,正常对照组肺组织无明显病理学改变;LPS组可见明显的炎性细胞浸润,支气管肺泡壁增厚和肺充血;莲心碱组可见炎性细胞和支气管肺泡壁厚度的减少,肺充血现象的减弱,随着莲心碱浓度的增加,抑制作用越明显;地塞米松组基本可改善肺组织损伤至正常对照组的病理改变(见图1)。

注:A.对照组;B.LPS组;C.莲心碱组(2 mg/kg);D.莲心碱组(4 mg/kg);E.莲心碱组(8 mg/kg);F.地塞米松组(5 mg/kg)。图1 各组小鼠急性肺损伤的病理学改变(HE, ×100)Note. A. Control group. B. LPS group. C. LIE group(2 mg/kg). D. LIE group(4 mg/kg).E.LIE group(8 mg/kg). F.DEX(5 mg/kg).Fig.1 Pathological changes of acute lung injury in the mice in each group (HE staining, ×100)
2.2 各组BALF中TNF-α、IL-6、IL-1β含量的比较
ELISA检测结果显示,LPS组BALF中TNF-α、IL-6、IL-1β的含量明显高于正常对照组,而莲心碱组和地塞米松组均低于LPS组,且莲心碱呈剂量依赖性抑制关系,差异有显著性(P< 0.05)(见表1)。
2.3 各组细胞计数和MPO活性的比较
Wright-Giemsa染色涂片结果显示,LPS组BALF中中性粒细胞数明显高于正常对照组,而莲心碱组和地塞米松组均低于LPS组,且莲心碱呈剂量依赖性抑制关系,差异有显著性(P< 0.05)。匀浆组织中MPO活性的检测结果,LPS组MPO的活性明显高于正常对照组,而莲心碱组和地塞米松组MPO的活性显著低于LPS组,且莲心碱呈剂量依赖性抑制关系,差异有显著性(P< 0.05)(见表2)。
2.4 各组BALF中的蛋白浓度和肺毛细血管通透性的比较
BCA试剂盒检测BALF中的蛋白浓度结果,LPS组的蛋白浓度明显高于正常对照组,而莲心碱组和地塞米松组均低于LPS组,且莲心碱呈剂量依赖性抑制关系,差异有显著性(P< 0.05)。Evans Blue染色结果显示,LPS组伊文思蓝含量显著高于正常对照组,而莲心碱组和地塞米松组的伊文思蓝含量均低于LPS组,且莲心碱呈剂量依赖性抑制关系,差异有显著性(P< 0.05)(见表3,图2)。

表1 各组BALF中TNF-α、IL-6、IL-1β含量的比较Tab.1 Comparison of the contents of TNF-α, IL-6, IL-1β in the BALF of each
注:与对照组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.#P< 0.05,##P< 0.01, compared with the control group;*P< 0.05,**P< 0.01, compared with the LPS group.
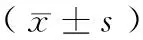
表2 各组BALF中的中性粒细胞数和MPO活性的比较Tab.2 Comparison of the number of neutrophils and the activity of MPO in BALF of each
注:与对照组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.#P< 0.05,##P< 0.01, compared with the control group;*P< 0.05,**P< 0.01, compared with the LPS group.
2.5 各组MDA含量、SOD活性、GSH含量和ROS平均荧光度值的比较
肺匀浆组织中MDA、SOD、GSH的检测结果显示,与正常对照组比较,LPS组匀浆上清中的SOD活力和GSH含量明显减少,MDA含量增多,差异有显著性(P< 0.05),而莲心碱组和地塞米松组可以增加SOD活力和GSH含量,减少MDA含量,且呈剂量依赖性抑制关系,与LPS组相比,差异有显著性(P< 0.05);流式细胞术检测结果显示,LPS组波峰明显比正常对照组右移,肺组织中ROS的平均荧光度值高于正常对照组,而莲心碱组和地塞米松组的波峰均向左移,平均荧光度值均低于LPS组,差异有显著性(P< 0.05)(见表4,图3)。
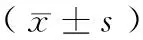
表3 各组BALF中的蛋白含量和肺组织中伊文思蓝渗出液的比较Tab.3 Comparison of the protein contents in BALF and the Evans blue labeled albumin extravasation in the lung
注:与对照组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.#P< 0.05,##P< 0.01, compared with the control group.*P< 0.05,**P< 0.01, compared with the LPS group.

注:A. 对照组;B. LPS组;C. 莲心碱组(2 mg/kg);D. 莲心碱组(4 mg/kg);E. 莲心碱组(8 mg/kg); F. 地塞米松组 (5 mg/kg)。图2 肺组织伊文思蓝染色Note. A. Control group. B. LPS group. C. LIE group (2 mg/kg). D. LIE group (4 mg/kg).E. LIE group (8 mg/kg). F. DEX group (5 mg/kg).Fig.2 Evans blue-labeled albumin extravasation in the lung tissues

组别 GroupsMDA含量(nmol/mgprot)MDA content(nmol/mgprot)SOD活性(U/mgprot)SOD activity (U/mgprot)GSH 含量(μmol/gprot)GSH content (μmol/gprot)ROS平均荧光强度值ROS mean fluorescenceintensity(MFI)对照组Control group1.05±0.01123.00±1.00503.66±0.0187.72±1.00LPS组 LPS group 3.98±0.01##71.00±1.10##177.33±2.51##234.63±20.00##莲心碱组 LIE group (2 mg/kg)1.65±0.01**82.20±1.36**353.66±3.51**178.79±17.00**莲心碱组 LIE group (4 mg/kg)1.49±0.01**87.30±0.60**388.00±2.64**120.11±8.50**莲心碱组 LIE group (8 mg/kg)1.42±0.01**88.20±1.05**405.00±4.00**110.15±8.00**地塞米松组DEX group1.35±0.01**110.13±1.20**411.00±6.55**105.25±5.00**
注:与对照组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.#P< 0.05,##P< 0.01, compared with the control group.*P< 0.05,**P< 0.01, compared with the LPS group.

注:A.对照组;B.LPS组;C.莲心碱组(2 mg/kg);D.莲心碱组(4 mg/kg);E.莲心碱组(8 mg/kg);F.地塞米松组(5 mg/kg)。图3 流式细胞术检测的各组肺组织中ROS的平均荧光强度Note. A. Control group. B. LPS group. C. LIE group (2 mg/kg). D. LIE group (4 mg/kg).E. LIE group (8 mg/kg). F. DEX group (5 mg/kg).Fig.3 The mean fluorescence intensity of ROS in the lung tissues of each group detected by flow cytometry
3 讨论
研究报道,急性肺部炎症时会出现中性粒细胞浸润、炎症细胞因子增加和蛋白质的渗出[12]。过量的活化的中性粒细胞会产生促炎细胞因子如TNF-α、IL-6、IL-1β,同时中性粒细胞的浸润导致肺微血管通透性增高,血浆蛋白质渗入肺间质,造成肺水肿[4]。本研究成功构建了LPS鼻腔滴入诱导的急性肺损伤小鼠炎症模型,HE染色结果显示,莲心碱和地塞米松均可改善LPS诱导的炎性细胞浸润、支气管肺泡壁增厚和肺充血等病理改变。肺组织中MPO的活性是中性粒细胞浸润的重要指标,中性粒细胞浸润情况结果显示,莲心碱和地塞米松均可降低中性粒细胞数和MPO的活性。ELISA检测结果显示,莲心碱和地塞米松均可降低BALF中促炎细胞因子TNF-α、IL-6、IL-1β的含量。伊文思蓝可与白蛋白结合,用来测定肺微血管通透性,从而反应蛋白质的渗出情况,本结果显示,莲心碱和地塞米松均可降低蛋白的渗出,降低肺微血管通透性,抑制肺水肿的形成。以上实验数据表明,莲心碱能有效减轻LPS诱导的ALI的炎症反应。
研究报道,氧化应激和氧自由基的过多产生在ALI的发生和发展中起重要作用[13]。LPS可诱导肺组织中大量中性粒细胞的积聚,致促炎细胞因子的释放和ROS产生的增多,引起氧化应激,过量的ROS可引起细胞和亚细胞器膜的脂质过氧化,促使脂质过氧化产物MDA的增多,对细胞结构和功能造成严重损害,损伤肺组织致ALI,而自由基清除剂SOD、GSH可以消除氧自由基和MDA[14]。研究报道,莲心碱对高脂血症大鼠可提高显著的GSH含量和SOD活性,表明莲心碱的抗氧化活性[15]。本实验结果显示,LPS可诱导肺组织中大量ROS的产生且能够显著降低肺组织中SOD活性和GSH含量,这与ALI患者的相应指标变化一致[16];而给予莲心碱和地塞米松,ROS的平均荧光强度值降低,SOD活性和GSH含量均升高。以上实验数据表明,莲心碱能有效减轻LPS诱导的ALI的氧化应激损伤。
本研究证实了莲心碱可以通过减轻肺水肿和血管渗漏,改善肺组织的病理变化和氧化应激损伤,减少中性粒细胞的浸润和BALF中炎性细胞因子的释放,对急性肺损伤起保护作用,具体的抗炎抗氧化作用机制需进一步深入研究。

