土木香内酯对C6脑胶质瘤细胞迁移侵袭及凋亡的影响
王迅,王李桃,张波
(1. 大连市第三人民医院神经外科, 辽宁省 大连 116033; 2. 大连医科大学附属第二临床学院神经外科,辽宁省 大连 116027)
胶质瘤是最常见的神经系统肿瘤,约占原发性脑肿瘤的60%。目前临床上仍采用手术结合放化疗的方法,但效果欠佳,预后差,死亡率高[1]。而且近年来,胶质瘤患者对常规化疗药多耐性的问题日趋显著。若能探寻到多种作用途径的药物,必将使广大胶质瘤患者从中获益。
中药抗肿瘤历史悠久,因其毒副作用小,且具有多途径多靶点抗肿瘤作用的可能,因此长期致力于中药抗胶质瘤的筛选具有重要的战略意义。土木香内酯(Alantolactone,AL)是从土木香的根中分离出的半萜内酯类化合物,具有较好的抗炎、驱虫、抗菌、抗肿瘤等方面的作用[2]。AL在抗肝癌、结肠癌及白血病等研究中已有报道[3-5],而且Khan等[6]研究发现AL能透过血脑屏障,这使其在治疗中枢性系统疾病中的应用成为可能。本文旨在探讨AL对大鼠C6胶质细胞瘤的抑制作用及可能的作用机制。
1 材料与方法
1.1 材料
1.1.1细胞株与试剂
大鼠C6脑胶质细胞株(购于ATCC 美国);土木香内酯(纯度 > 98%,购于上海同田生物技术 中国);DMEM培养基、胎牛血清(购于Hyclone 美国);N-cadherin、E-cadherin、cleaved PARP、cleaved caspase-3、cleaved caspase-9、Cyto c、GAPDH等单克隆抗体(购于Cell Signaling Technology 美国);AnnexinV-FITC细胞凋亡检测试剂盒(购于南京凯基生物科技 中国);线粒体膜电位检测试剂盒(JC-1)(购于上海碧云天生物技术 中国)。
1.1.2主要仪器与设备
多功能酶标仪(Perkin Elmer美国);C6流式细胞仪、蛋白/核酸凝胶成像仪(BD美国);CKX41型倒置相差显微镜(Olympus日本);正置/倒置荧光显微镜(Leica德国);Western Blot 仪器(北京六一 中国)。
1.2 方法
1.2.1细胞培养
C6 细胞培养于含 10% FBS的 DMEM培养基中,于 5% CO2、95%湿度、37℃恒温孵育箱中培养传代。
1.2.2药液储备及使用浓度
配制土木香内酯(AL)母液浓度为 100 mmol/L 溶解于二甲基亚砜 (DMSO),-20℃保存备用。使用时采用含1% FBS的DMEM培养基稀释至终浓度为5、10 μmol/L。
1.2.3细胞活力检测(MTT 法)
取对数期生长的C6细胞(密度为5×103个/mL),接种于96孔细胞培养板中,每孔加入100 μL细胞悬液,每组设6个复孔;待细胞生长至 70%以上汇合度时,依次施予不同浓度的AL,共 6个浓度梯度(0、1、5、10、20、40 μmol/L),给药后分别孵育观测至12、24 h及48 h终止,各加入 5 mg/mL的MTT 15 μL,孵育4 h后弃掉孔内液体,每孔加入DMSO 150 μL,摇匀后,采用波长为490 nm的酶标仪测定每孔 OD值。利用OD值计算出细胞增殖率 (酶标仪所示 OD值减去空白组OD值)。以细胞活性为纵坐标,以药物浓度为横坐标,绘制细胞活力的折线图。
1.2.4Transwell小室实验
将C6细胞种植于表面有基质胶的Transwell小室上室中,下室用600 μL含有10% FBS的培养基填充。上、下室均含有不同浓度(0、5、10 μmol/L)的AL处理,经孵育24 h后,用棉签擦拭上层膜表面的非侵入性细胞。下层侵入细胞用甲醇固定,并用0.1%结晶紫染色溶液染色。显微镜下拍照,选取每个膜的五个独立区域中计数细胞。
1.2.5体外迁移实验
将 C6细胞接种于 6 孔板,待细胞长满后,用 200 μL移液枪枪头在各孔板上做垂直直线划痕,然后弃掉培养基,PBS清洗后,分别施予含0、5、10 μmol/L浓度AL的新培养基(含1% FBS)。在倒置显微镜下拍照(×100),先拍下药物处理 0 h时划痕位置照片,并使用记号笔记录拍摄照片的位置。再培养24 h后,再根据之前记录的位置拍摄划痕后变化的照片。
1.2.6细胞凋亡检测
将C6细胞种植于6孔板中,采用不同浓度AL (0、5、10 μmol/L处理 24 h后;收集各组细胞, PBS 洗涤 2次,加入 500 μL 的 binding buffer 悬浮细胞;加入5 μL annexin V-FITC 混匀后;加入5 μL propidium iodide混匀后;在室温避光下反应15 min;于流式细胞仪上进行荧光检测。
1.2.7线粒体膜电位检测(采用JC-1荧光探针试剂盒)
将C6细胞种植于6孔板中,采用不同浓度AL (0、 5、10 μmol/L)处理 24 h后;吸除培养液,加入1 mL JC-1染色工作液,充分混匀。细胞培养箱中37℃孵育20 min,吸除上清,用JC-1染色缓冲液洗涤2次,加入2 mL细胞培养液,荧光显微镜下观察拍照。
1.2.8Western blot检测
收集经0、5、10 μmol/L浓度组AL处理24 h后的细胞,提取总蛋白及去线粒体的胞质蛋白,采用BCA法测定蛋白浓度,经凝胶电泳分离,采用半干法将蛋白转至PVDF膜上,5%脱脂奶粉封闭,分别孵育一抗、二抗后洗膜显影。
1.3 统计学方法
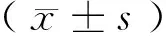
2 结果
2.1 AL抑制C6胶质瘤细胞的增殖
经MTT法检测发现(如图1),AL能显著抑制C6细胞的生长活力,且呈剂量及时间依赖性。计算AL作用后12、24 h及48 h的IC50值分别为14.27、10.01、8.35 μmol/L。

注:不同浓度AL(0、1、5、10、20、40 μmol/L)分别作用于C6细胞12、24、48 h。图1 AL抑制C6胶质瘤细胞活力的作用曲线Note. Different concentrations of AL (0, 1, 5, 10, 20, 40 μmol/L) were applied to C6 cells for 12, 24 h and 48 h.Fig.1 Inhibitory effect of AL on the activity of glioma C6 cells
2.2 AL通过调节钙粘素(cadherins)蛋白抑制C6胶质瘤细胞迁移侵袭
AL能显著抑制C6细胞的穿透侵袭能力(P< 0. 05),且呈剂量依赖性(图2A)。AL能显著抑制C6细胞的划痕愈合能力(P< 0. 05),且呈剂量依赖性(图2B)。Western blot检测与胶质瘤侵袭转移密切相关的两种蛋白N-cadherin和E-cadherin,AL在降低N-cadherin蛋白表达的同时升高E-cadherin蛋白的表达,且呈剂量依赖性(图2C)。
2.3 AL通过调节细胞色素 C/ Caspase 信号通路诱导C6胶质瘤细胞凋亡
AL能明显上调C6细胞的凋亡数(P< 0. 05),且呈剂量依赖性。线粒体损伤线粒体膜电位下降是细胞凋亡的早期标志。JC-1是一种检测线粒体膜电位的理想荧光探针。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,产生绿色荧光(图3A)。AL能明显促使JC-1多聚体(红光)向单体(绿光)的转变。线粒体损伤后细胞色素C从线粒体向胞质释放,启动caspase级联通路诱导凋亡发生(图3B)。经western blot检测发现,施予AL后,去除线粒体的胞质中细胞色素C蛋白表达显著上升(P< 0. 05)。如图3C,对caspase级联通路中的关键蛋白cleaved PARP/caspase-3/caspase-9的检测发现,AL均能上调以上三种蛋白的表达量,且呈剂量依赖性(图3C)。
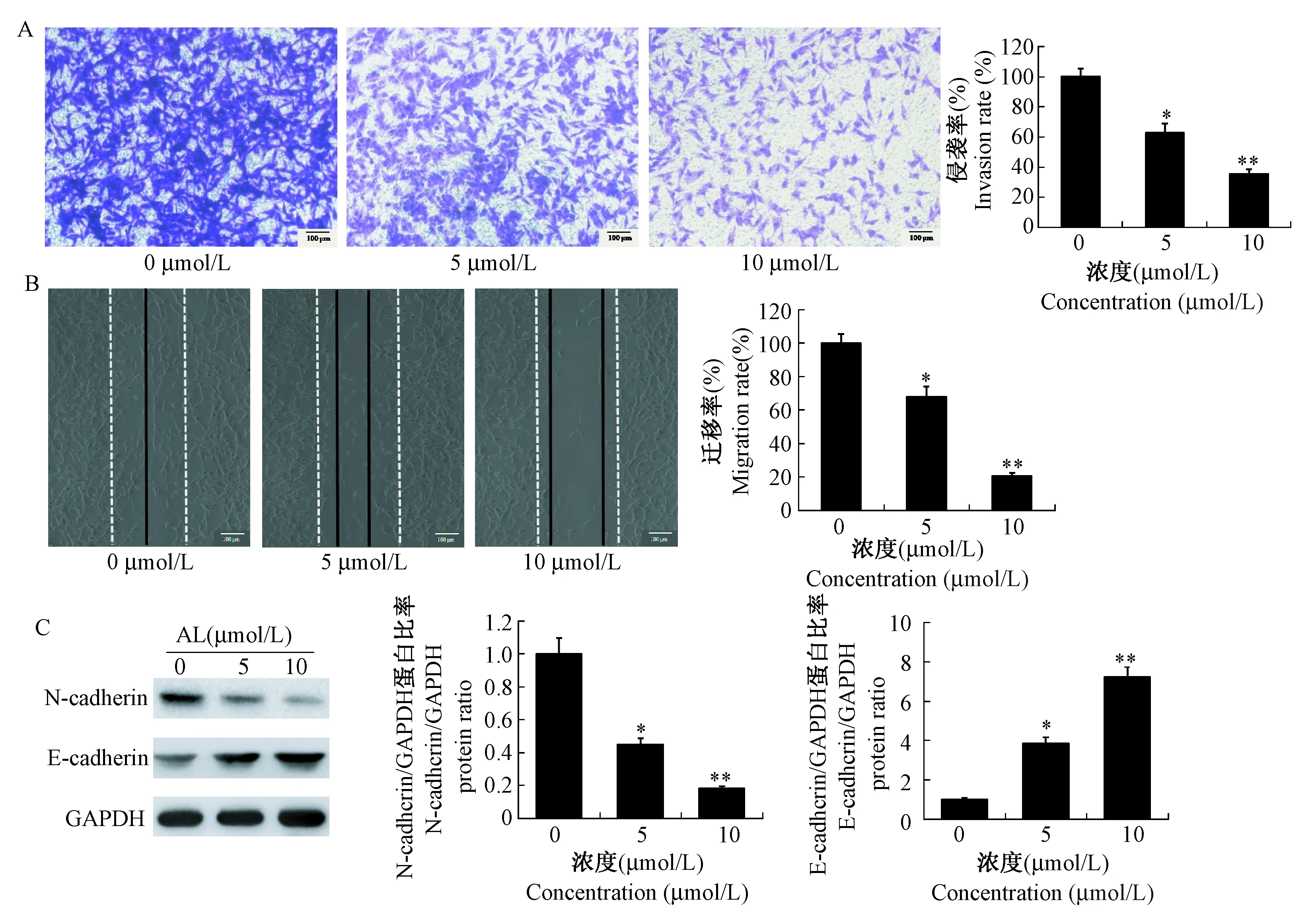
注:(A)Transwell小室实验观察AL对C6细胞侵袭的影响(*P<0.05;**P<0.01);(B)划痕实验观察AL对C6细胞迁移的影响(*P< 0.05;**P< 0.01;×100);(C)AL对N-cadherin及E-cadherin蛋白表达的影响(*P< 0.05;**P< 0.01)。图2 AL抑制C6细胞迁移和侵袭Note. (A) Effect of AL on C6 cell invasion in Transwell chamber experiment (*P< 0.05;**P< 0.01). (B) Effect of L on C6 cell migration in scratch test (*P< 0.05;**P< 0.01;×100). (C) Effect of AL on N-cadherin and E -cadherin protein expression (*P< 0.05;**P< 0.01).Fig.2 AL inhibits the migration and invasion of C6 cells

注:(A)流式细胞仪检测AL对C6细胞凋亡情况的影响(*P< 0.05;**P< 0.01);(B)荧光显微镜观察AL对C6细胞膜电位变化的影响(×200);(C)AL对Caspase级联信号关键蛋白表达的影响(*P< 0.05;**P< 0.01)。图3 AL诱导C6细胞的凋亡发生Note. (A) The effect of AL on apoptosis in C6 cells detected by flow cytometry (*P< 0.05;**P< 0.01. (B) The effect of AL on the changes of membrane potential of C6 cells by fluorescence microscopy, ×200. (C) The effect of AL on the expression of caspase cascade signaling.*P< 0.05;**P< 0.01.Fig.3 AL induces the apoptosis in C6 cells
3 讨论
胶质瘤因高侵袭性、抗凋亡、化疗药多耐性等特性,严重危害病人的生命健康,在临床上治疗效果欠佳的背景下,探求新的治疗策略及多途径治疗机制的药物已日益受到广大学者的关注。中药在抗肿瘤作用中历来占有重要地位,天然化合物在肿瘤药物研发中发挥着重要的作用,尤其是植物化合物与化学合成药物相比,具有取材方便、价格低廉、毒副作用小的优势,尤其在抗耐药性和减毒增效方面更具显著优势,已受到国内外学者的广泛认可,成为研发新型抗癌药的重要来源。
土木香内酯(AL)是从土木香的干燥根中提取出来的活性物质,广泛分布于欧洲、北美洲以及中国新疆等地区,其采集及制备简便,价格低廉,在中、欧药典中均有记载。AL是土木香的精油成分,具有抗炎、抗菌、抗肿瘤及保肝降糖等多种药理活性。AL对其他系统肿瘤的抑制作用已经陆续有相关报道,而对中枢神经系统肿瘤作用的研究罕有报道。故本实验选用 C6脑胶质瘤细胞株作为研究对象,对AL在中枢神经系统恶性肿瘤抑制作用的活性进行阐述。
本实验首先通过细胞活力检测证实了AL能显著抑制C6细胞的增殖生长。随之通过划痕实验及Transwell小室实验发现AL能抑制C6细胞的迁移侵袭。而脑胶质瘤细胞粘附性的改变是肿瘤侵袭与转移的重要始动环节。钙粘素(cadherins) 是一类结构和功能相似的钙依赖性单链跨膜糖蛋白。各类钙粘素蛋白分子中, 以神经-钙粘素(N-cadherin) 和上皮-钙粘素(E- cadherin) 与肿瘤的侵袭和转移关系最为密切[7]。研究发现N-cadherin 的过度表达和E- cadherin的表达下调在胶质瘤的侵袭性生长及恶性进展中发挥着重要作用[7-8]。我们的实验发现AL能显著抑制N-cadherin蛋白的表达,而显著上调E-cadherin蛋白的表达。因此我们推测AL可能通过调节cadherin蛋白的表达抑制C6细胞的迁移侵袭。
凋亡是一种细胞程序化死亡,肿瘤细胞的无限生长是细胞凋亡受抑制的结果[9]。本实验通过AV-PI双染方法证实AL能显著诱导C6细胞的凋亡发生。而凋亡的发生主要分为内源性及外源性两种途径,其中内源性途径也称为线粒体-细胞色素C(Cyto c)途径[10-12]。本实验通过JC-1荧光探针发现AL能促使线粒体膜电位从高位向低位的转变,可能致线粒体通透性发生改变;随即通过蛋白印迹的方法发现去线粒体的胞质中Cyto c蛋白显著增加,从而证实Cyto c从线粒体向胞质的释放;进一步通过蛋白印迹的方法检测到天冬半胱氨酸蛋白水解酶(caspase)级联通路中的关键蛋白(Cleaved PARP/caspase-3/caspase-9)均有显著升高,最终证实了AL通过激活caspase级联反应诱导凋亡发生。
综上所述,经本实验发现AL能通过抑制迁移侵袭及诱导凋亡发生来发挥抗胶质细胞瘤的作用,从而为AL在抗中枢神经系统肿瘤方面的应用提供了一定的实验依据。

