小麦小花细胞核蛋白质双向电泳体系的优化
宋归华,张迎新,2,侯泽豪,孙坤坤,方正武,马东方,张改生,王书平
(1.长江大学农学院/湖北省涝渍灾害与湿地农业重点实验室,湖北荆州 434025;2. 中国科学院遗传与发育生物学研究所, 北京 100101;3. 西北农林科技大学农学院/小麦育种教育部工程研究中心,陕西杨凌 712100)
在真核细胞当中,细胞核是一个重要的亚细胞器,更是遗传信息的主要储存场所,包含着绝大多数DNA,是细胞遗传与代谢的活动中心[1]。而细胞核蛋白质在基因表达调控、信号传导、染色质重塑、转录调节等方面具有决定性的作用[2]。全细胞蛋白质中约10%~20%的蛋白质位于细胞核当中,在复杂的代谢网络和生理过程中扮演着重要的角色,暗示着细胞核具有的功能多样性与这些蛋白质密切相关[3-4]。此外,高等植物中,除韧皮部成熟的筛管等极少数细胞外,其他细胞都具有细胞核[5]。因此,研究细胞核的蛋白质组成及其动态变化,对于深入解析植物生长发育与逆境胁迫应答过程中基因表达调控的分子机制具有至关重要的意义。
蛋白质组学对于广泛分析蛋白质表达、转录后翻译以及蛋白质之间的相互作用具有主导性作用。但由于高等真核细胞的复杂性,对其全细胞蛋白质组进行分析,受到诸多因素的限制,例如蛋白质丰度、大小、疏水性及其他电泳特性等。而将全细胞蛋白质组依据细胞的大分子结构(包括亚细胞隔室、亚细胞器、大分子结构、多蛋白复合物等)分解成一系列亚细胞蛋白质组[6],这不仅降低了全细胞分析的复杂性,而且为我们提供了蛋白质定位及通路划分方面的重要信息[7],目前已经在小麦线粒体[8-9]、叶绿体[10]、质膜[11]等亚细胞器中得到了广泛的应用。近年来,随着植物蛋白质组学技术平台的日趋成熟、各类植物基因组测序工作的不断完成以及细胞核蛋白质数据库的逐渐完善,极大地促进了细胞核蛋白质组学在植物中的应用。目前,有关植物细胞核蛋白质组学的研究主要集中在双子叶植物的拟南芥(Arabidopsisthaliana)[12-14]、苹果(Maluspumila)[15]、鹰嘴豆(Cicerarietinum)[16-18]、大豆(Glycinemax)[19]、番茄(Solanumlycopersicum)[20]以及单子叶植物的水稻(Oryzasativa)[2, 21-23]、洋葱(Alliumcepa)[24]、维柯萨(Xerophytaviscosa)[25-27]、玉米(Zeamays)[28]等,而在其他植物上,尤其是小麦细胞核蛋白质组学方面的研究鲜见报道。众所周知,针对于亚细胞蛋白质组学,如何获得高纯度、完整性好的细胞核是进行其蛋白质组学研究的前提之一。迄今为止,已经报道并建立了拟南芥[12-13]、水稻[2, 21-22]、维柯萨[25-27]等细胞核蛋白质双向电泳体系,涉及悬浮细胞[13, 21-22]、叶片[12, 15, 25-27]、幼苗[2, 16-18]、根尖分生组织[2]等不同的组织器官。由于植物间细胞核在细胞大小、蛋白质含量、次生代谢物、亚细胞组分相关联程度等方面存在显著的差异,因此探索不同植物细胞核及其蛋白质的最佳提取方法,建立和优化蛋白质2-DE技术对提高特异组织细胞核的分辨率仍是亟待解决的问题[9]。
本研究以小麦三核期小花为材料,对细胞核蛋白质组学中细胞核的分离与纯化、蛋白质提取方法、SDS-PAGE胶浓度、上样量等方面进行了优化,探索出一套适合于小麦小花细胞核分离及纯度鉴定的方法,建立了分辨率高和重复性好的细胞核蛋白质2-DE的分析体系,以期对今后开展小麦细胞核蛋白质组学研究提供理论和技术支撑,也为其他同科、属植物的细胞核2-DE蛋白质研究提供参考。
1 材料和方法
1.1 供试材料与处理
供试材料为正常发育小麦品种西农1376,在散粉前,通过株型、穗型结合镜检来判断花药小孢子发育时期,4 ℃剥取三核期小花(去芒和颖片)。
1.2 细胞核的分离与纯化
称取小麦小花(去芒和颖片)60 g,于含有0.3% PVP的液氮中快速研磨成粉末。将研磨好的粉末置于600 mL预冷的蔗糖缓冲液(0.5 mol·L-1蔗糖, 80 mmol·L-1KCl, 10 mmol·L-1EDTA, 1 mmol·L-1亚精胺, 1 mmol·L-1精胺, 10 mmol·L-1Tris-HCl, pH 9.5)中,冰浴20 min;轻柔混匀后加入0.15% β-Me和0.5% Triton X-100,4 ℃下裂解20 min,每隔2 min轻柔搅拌一次,每次20 s。均匀后,用2层纱布和1层Miracloth过滤,滤液于4 ℃下1 800 r·min-1离心20 min。弃上清,沉淀用软毛笔悬浮于150 mL蔗糖缓冲液中;2层Mirocloth过滤,4 ℃、57 r·min-1离心2 min。取上清,4 ℃、1 800 r·min-1离心15 min;沉淀经悬浮后,4 ℃、1 800 r·min-1离心10 min。弃上清,最后得到的沉淀即为细胞核。
1.3 细胞核蛋白质的制备、定量及SDS-PAGE检测
依据陈 征等[9]和宋齐鲁等[11]的方法,略有改动,提取蛋白质样品。在细胞核样品中加入预冷的TCA-丙酮溶液(10% TCA,0.07% β-ME,1 mmol·L-1PMSF),在-20 ℃下过夜沉淀蛋白质。4 ℃下25 000 r·min-1离心30 min,弃上清,沉淀用预冷的丙酮溶液(0.07% β-ME, 1 mmol·L-1PMSF)洗涤,-20 ℃下静置1 h后,4 ℃下25 000 r·min-1离心30 min,重复离心、洗涤至沉淀物为纯白色。加入预冷的80%丙酮,重悬沉淀,-20 ℃下静置1 h;4 ℃下25 000 r·min-1离心30 min,沉淀冷冻成干粉。
将细胞核蛋白质干粉溶解于裂解缓冲液[9 mol·L-1尿素,4% CHAPS,65 mmol·L-1DTT,0.5% IPG(pH 4~7)缓冲液,0.001%溴酚蓝]中,分别于液氮与32 ℃水浴中交替冻融3次,22 ℃下25 000 r·min-1离心15 min,上清液为蛋白质样品,Bradford法[29]测定样品液蛋白质含量。
1.4 细胞核纯度检测
分别在细胞器和蛋白质水平上对分离到的细胞核进行纯度检测。细胞核的显微观察采用DAPI荧光染色法[30]。分离过程中各个组分叶绿素含量的测定参考Dean和Miskiewicz的方法[31]进行,包括匀浆液、首次沉淀、最终的上清液及细胞核沉淀。在1 mL悬浮样品中分别加入8 mL丙酮和1 mL ddH2O,室温下避光萃取过夜,1 000 r·min-1离心5 min,立即在652 nm波长下测定吸光值。
细胞核蛋白质经12%的PAGE-SDS电泳分离后进行PVDF转膜,以TBST(含5% BSA)溶液封闭后,依次经一抗(Anti-histone core antibody;Abcam公司,ab7832)和二抗(Abcam公司)孵育后,最后用碱性磷酸酶底物显色试剂盒显色。
1.5 固相pH梯度双向电泳
参照宋齐鲁等[11]的方法进行。取适量蛋白质样品与水化液共350 μL充分混匀后,加入聚焦槽内。将17 cm(pH 4~7) IPG胶条胶面朝下置于样品溶液上,被动吸收1 h后,加3 mL矿物油覆盖胶条,置于IPG-phor等电聚焦仪进行等电聚焦,设置极限电流为50 μA。等电聚焦结束后,依次用含2% DTT和2.5%碘乙酰胺的平衡缓冲液(6.0 mol·L-1尿素,2%SDS,0.375 mol·L-1Tris-HCl pH 8.8,20%甘油)分别平衡15 min。然后将IPG胶条转移到SDS-PAGE凝胶上,用低熔点琼脂糖封胶液密封排除气泡,电流20 mA。其中,上样量参考陈 征等[9]和王书平等[10]的方法进行,分别为200 μg、230 μg和250 μg;胶浓度设定为11%、12%和13%[11]。待溴酚蓝前沿距玻璃板下缘0.5 cm时停止电泳,凝胶染色按改良后的硝酸银染方法操作,见表1。

表1 蛋白质硝酸银染步骤Table 1 Sliver staining protocol for proteins
1.6 凝胶图像分析
银染后的2-DE凝胶用光密度扫描仪UMAX PowerLook 2100XL扫描。在PDQuest 2DE 8.0.1分析软件的辅助下,对图像进行背景扣除、强度校正、标准化、斑点检测、获取斑点位置坐标等分析。
1.7 统计分析
利用Microsoft Excel 2010进行数据整理和表格绘制,采用OriginPro 2017软件进行统计分析及绘图。
2 结果与分析
2.1 小麦小花细胞核的分离纯度
利用高渗蔗糖缓冲液分离出了小麦小花细胞核,并通过反复的差速离心技术去除了其他细胞器的污染,富集到了高浓度的细胞核。通过对叶绿素含量的测定和比较,叶绿素在其他分离组分中含量较高,为99.8%,而在富集纯化后的细胞核中仅为1.8%(图1A)。进一步研究发现,细胞核经DAPI染色后,呈现出较为均匀、清晰的细胞轮廓,细胞核完整性较高。经统计分析,完整细胞核的分离效率达到95%以上(图1B)。为了进一步对细胞核蛋白质的富集情况进行分析,采用梯度SDS-PAGE进行蛋白质的分离(图1C)及用细胞核组蛋白特异性抗体进行蛋白质免疫印迹检测(图1D)。结果表明,所制备的细胞核蛋白质条带分布均匀、清晰,组蛋白H1、H3、H2B显示全面完整。综合以上结果,分离获得的细胞核污染少,纯度较高,所制备的细胞核蛋白质组次生代谢物质含量较低,且较为完整。
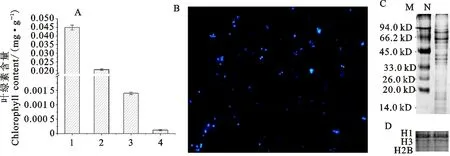
A:不同分离纯化阶段叶绿素含量测定;1:粗提液;2:沉淀;3:上清液;4:细胞核;B:细胞核DAPI染色;C:细胞核蛋白质SDS-PAGE(12%);M:Marker;N:细胞核蛋白质;D:组蛋白免疫印迹分析。
A:Determination of chlorophyll content at different stages of purification; 1:Crude homogenate; 2:Pellet; 3:Supernatant; 4:Nuclear fraction; B:The purified nuclear fraction was stained with DAPI; C:SDS-PAGE(12%) Silver-stained image of extracted nuclear proteins;M:Marker; N:Nuclear fraction;D:Western blot analysis of extracted nuclear proteins with anti-histone core.
图1细胞核的分离提取及纯度鉴定
Fig.1Isolationandpuritydeterminationofthenuclearfraction
2.2 不同SDS-PAGE凝胶浓度对2-DE图谱的影响
SDS-PAGE凝胶浓度决定了细胞核蛋白质组的分离效果,并有效确保高、低分子量蛋白质点在2-DE图谱上的均匀分布。从图2来看,当凝胶浓度为11%时,高分子量蛋白质点(>26 kD)得到了相对较好的分离,但低分子量蛋白质点(<20 kD)由于超出了凝胶的分离范围,部分蛋白质点未能在图谱上检测到,此时检测到细胞核蛋白质组数量为241个(图2A)。改用13%的凝胶后,蛋白质点在图谱上的分布情况恰恰相反,表现为高分子量蛋白质点高度凝聚,部分蛋白质点不能有效识别,进而降低了分辨率(图2C),共检测到223个蛋白质点。而经12%凝胶进行分离后,整个细胞核蛋白质组得到了较好的分离效果(图2B),蛋白质点分布均匀且清晰圆润,共检测获得264个蛋白质点。这表明采用凝胶浓度为12%更能对细胞核蛋白质组进行有效地分离。
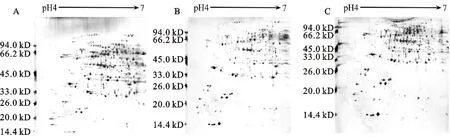
A:11% SDS-PAGE;B:12% SDS-PAGE;C:13% SDS-PAGE. 图2 不同SDS-PAGE凝胶浓度的2-DE图谱比较分析Fig.2 Comparison of 2-DE maps of different SDS-PAGE gel concentration
2.3 不同上样量对2-DE图谱的影响
蛋白质的上样量大小直接决定了2-DE图谱上蛋白质点的数量。结果表明,上样量为200 μg时,2-DE图谱上低丰度蛋白质较弱或无显示,蛋白点数量较少,共检测到212个蛋白质点(图3A)。随着上样量的增加,蛋白点的数量呈上升趋势。当上样量增至250 μg时,高丰度蛋白质明显聚集,碱性端出现过饱和重叠现象,2-DE图谱上纵横条纹明显,背景加深,点与点之间难以分离,不利于后期检测和分析,此时,共检测到241个蛋白质点(图3C)。上样量为230 μg时,低丰度蛋白质点增加,无横条纹干扰,图谱清晰,蛋白质点独立清晰,共检测到264个蛋白质点(图3B)。
2.4 小麦小花细胞核蛋白质组在2-DE图谱上的分布特征
等电点分析结果表明,在pI 4.0~4.5区域内表达蛋白质点最少,为16±1个,pI 6.0~6.5区域内表达蛋白质点最多,为71±5个,其他等电点区域表达蛋白质点分别为43±4个(pI 4.5~5.0)、50±3个(pI 5.0~5.5)、55±4个(pI 5.5~6.0)、29±2个(pI 6.5-7.0)(图4A)。在分子量方面,14.4 kD以下区域内表达的蛋白质点最少,为3±1个,45.0~66.2 kD区域内表达的蛋白质点最多,为85±4个,其他分子量区域内表达的蛋白质点分别为20±2个(14.4~20.0 kD)、16±2个(20.0~26.0 kD)、10±1个(26.0~33.0 kD)、42±3个(33.0~45.0 kD)、38±2个(66.2~94.0 kD)、50±3个(>94.0 kD)(图4B)。
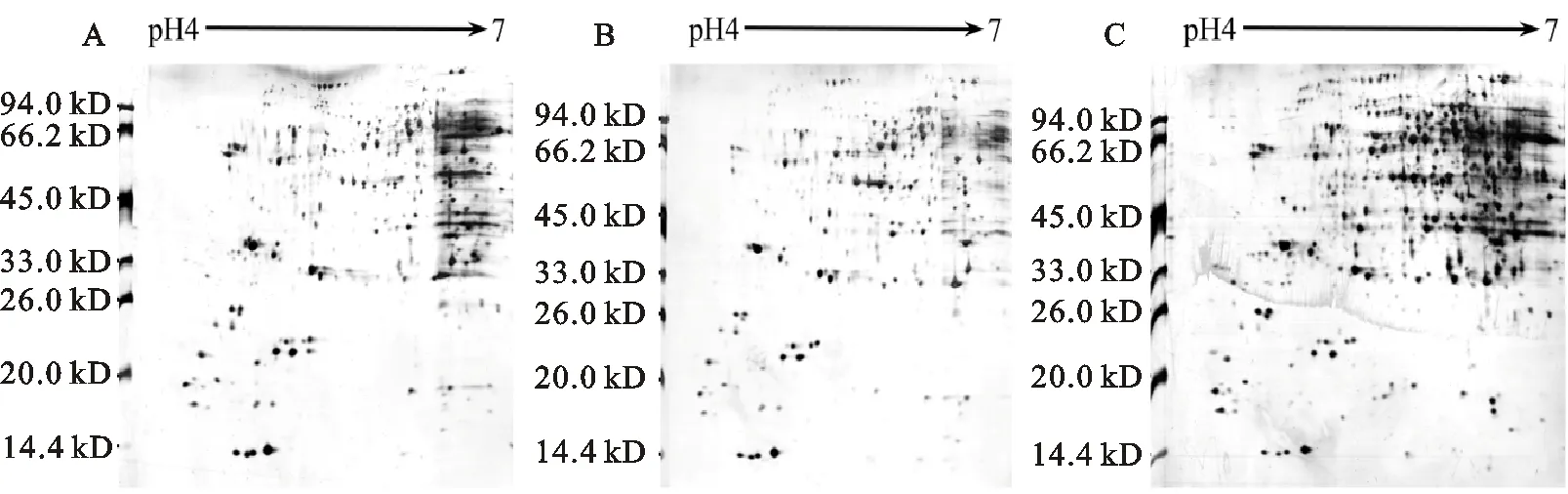
A:上样量为200 μg的2-DE图谱;B:上样量为230 μg的2-DE图谱;C:上样量为250 μg的2-DE图谱。
A:2-DE maps obtained with loading proteins samples of 200 μg; B:2-DE maps obtained with loading proteins samples of 230 μg;C:2-DE maps obtained with loading proteins samples of 250 μg.
图3不同上样量的2-DE图谱比较
Fig.3Comparisonof2-DEmapsofdifferentloadingquantity
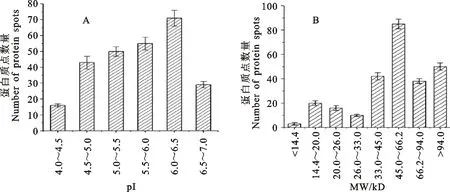
A:蛋白质的等电点分布特征;B:蛋白质的分子量分布特征。
A:Distribution of protein spots according to isoelectric point(pI);B:Distribution of protein spots according to and molecular weight(MW).
图4细胞核蛋白质点的分布特征
Fig.4Distributionofnuclearproteinsspots
3 讨 论
植物与动物和微生物相比,具有细胞壁、叶绿体、次生代谢物多等特点,因此植物的细胞核提取也就相对较为困难。亚细胞蛋白质组学的上游研究技术是亚细胞结构的提取和纯化即细胞的分级分离,一般叶绿体沉降系数为3×105 s,密度为1.21 g·cm-3;线粒体沉降系数为1~1.7×104s,密度为1.18~1.19 g/cm3;而细胞核沉降系数为7×106s左右,密度为1.3 g·cm-3[10]。因此,各细胞组分依据浮力密度的不同可逐级有效分离。目前的植物细胞核蛋白质组学研究主要是从植物叶片、幼苗或悬浮培养细胞中提取细胞核,再利用匀浆机破碎或细胞壁水解酶除去细胞壁,然后通过改变细胞内外渗透压破碎原生质体,并利用不同的离心方式以富集细胞核[1]。本研究中,通过在小麦小花研磨过程中加入0.3% PVP,不仅有效去除了多糖多酚等次生代谢物的污染,同时也减少了细胞核蛋白质的修饰。而在蔗糖溶液中加入适当浓度的Triton X-100(0.5%),能够在短时间内裂解细胞膜,避免了对核膜的损伤。在细胞核分离过程中,本研究采用的差速离心法简单快捷,已经在其他作物上得到了应用[2,16-20, 24, 28]。就小麦三核期小花而言,其含有更多的多糖、淀粉粒及部分未破裂的花粉粒等物质。依据这一特性,本研究在离心过程中适当的进行了优化,在增加过滤次数(2次)的同时也相应增加了离心洗涤次数,通过不同的离心速率最大程度地去除了质膜、叶绿体、线粒体、细胞质等的污染。
亚细胞纯度鉴定是确保后续研究顺利实施的前提。本研究分别采用三种方法来进行细胞核纯度检测,首先测定细胞核制备液中叶绿素含量,以确定叶绿体在细胞核中的污染程度;其次通过对获取的细胞核进行DAPI染色,经显微镜观察以直观的判断亚细胞结构的形态学特征,观察是否有其他组分的存在及研究对象的完整性;最后制备细胞核蛋白质,以组蛋白为细胞核标记蛋白质,通过免疫印迹技术来检测细胞核蛋白质的纯度。经比较分析,本研究所提取的细胞核纯度较高,所制备的细胞核蛋白质组次生代谢物质含量较少,较完整。这为双向电泳的顺利开展奠定了材料基础。
植物细胞核是储藏遗传信息的主要场所,其蛋白质组的动态变化直接影响基因的表达调控,进而调节植物生长发育与环境应答过程[4-5]。因此,建立和健全细胞核蛋白质组学研究的方法和体系将为解析植物发育与逆境应答的分子机制提供重要信息。而为了获得更多的蛋白质信息,要求在进行植物蛋白质样品制备时,尽量提高样品蛋白质的溶解性并减少蛋白质的损失和降解,尽可能保留较多的蛋白质种类。样品质量的好坏直接决定双向电泳的分辨率、重复性和蛋白质质谱的结果[9]。在前期的研究过程中,已经采用TCA-丙酮法对小麦小花叶绿体、线粒体以及叶片质膜的蛋白质进行提取,构建并优化了相应的蛋白质双向电泳体系。本研究在这些研究结果的基础上,继续采用成熟的TCA-丙酮法来制备细胞核蛋白质,同时结合细胞核中核酸含量高、疏水性核膜蛋白质难以溶解等特点,对该制备方法进行了进一步优化。利用超声波对细胞核裂解液进行间隔冰浴破碎,使大量核酸分子形成小片段,降低蛋白质样品的粘度,有助于细胞核蛋白质的溶解。离心时加大转速,有效去除蛋白样品中的盐分,减少2-DE图谱中横竖条纹干扰的现象。此外,聚焦过程中,通过在聚焦槽阳极端架设盐桥,不仅可以避免因盐离子过高造成的烧胶条现象,同时还可以减少2-DE图谱上的横条纹。
凝胶浓度和上样量直接影响双向电泳的分辨率和重复性[9,11]。因此,在蛋白质组学研究中,针对目标蛋白质的不同,应对分离胶的浓度进行适当调整。本研究中11% SDS-PAGE的凝胶孔隙较大,凝胶阻力小,蛋白质运动速度较快,2-DE图谱上部产生空白;13% SDS-PAGE的凝胶孔隙相对较小,凝胶阻力变大,高分子量的蛋白质在中上部凝聚,不利于蛋白质有效的分离;12% SDS-PAGE凝胶浓度对小麦细胞核蛋白质的分离效果最佳,条带清晰,无拖尾、条纹等现象发生。上样量的大小是直接影响2-DE图谱质量和可靠性的重要因素之一,过低的上样量不利于低丰度蛋白质点的检测,过高时则高丰度蛋白质点易于掩盖其他蛋白质点,且横条纹和拖尾较严重。本研究通过对不同上样量的比较分析,确定在230 μg时,能获得很好的2-DE图谱效果,2-DE胶背景干净,大大地提高了细胞核蛋白质的分离效率和分辨率。
参考文献:
[1] ERHARDT M,ADAMSKA I,FRANCO O L.Plant nuclear proteomics-inside the cell maestro [J].FEBSJournal,2010,277(16):3295.
[2] CHOUDHARY MK,BASU D,DATTA A,etal.Dehydration-responsive nuclear proteome of rice(OryzasativaL.) illustrates protein network,novel regulators of cellular adaptation,and evolutionary perspective [J].Molecular&CellularProteomics,2009,8(7):1579.
[3] KUMAR A,AGARWAL S,HEYMAN J A,etal.Subcellular localization of the yeast proteome [J].Genes&Development,2002,16(6):707.
[4] NARULA K,DATTA A,CHAKRABORTY N,etal.Comparative analyses of nuclear proteome:extending its function [J].FrontiersinPlantScience,2013,4:100.
[5] 王思宁,赵 琪,戴绍军.植物细胞核蛋白质组学研究进展[J].现代农业科技,2013(5):225.
WANG S N,ZHAO Q,DAI S J.Research advances on plant cell nucleus proteomics [J].ModernAgriculturalScience&Technology,2013(5):225.
[6] JUNG E,HELLER M,SANCHEZ J C,etal.Proteomics meets cell biology:The establishment of subcellular proteomes [J].Electrophoresis,2000,21(16):3369.
[7] WOJCIK C,DEMARTINO G N.Intracellular localization of proteasomes [J].InternationalJournalofBiochemistry&CellBiology,2003,35(5):579.
[8] WANG S P,ZHANG G S,ZHANG Y X,etal.Comparative studies of mitochondrial proteomics reveal an intimate protein network of male sterility in wheat(TriticumaestivumL.) [J].JournalofExperimentalBotany,2015,66(20):6191.
[9] 陈 征,王书平,张改生,等.小麦小花高纯度线粒体的分离及其蛋白质双向电泳体系建立[J].中国生物化学与分子生物学报,2013,29(10):983.
CHEN Z,WANG S P,ZHANG G S,etal.Isolation of high purity mitochondria from wheat floret for two-dimensional electrophoresis [J].ChineseJournalofBiochemistry&MolecularBiology,2013,29(10):983.
[10] 王书平,张改生,叶景秀,等.杀雄剂SQ-1诱导小麦生理型雄性不育小花完整叶绿体差异蛋白质的鉴定[J].中国生物化学与分子生物学报,2010,26(9):854.
WANG S P,ZHANG G S,YE G X,etal.Differential proteomics analysis of floret intact chloroplasts proteins in wheat physiological male sterile line induced by CHA-SQ-1 [J].ChineseJournalofBiochemistry&MolecularBiology,2010,26(9):854.
[11] 宋齐鲁,王书平,张改生,等.小麦旗叶高纯度质膜的提取及蛋白质组学双向电泳体系的建立[J].中国生物化学与分子生物学报,2013,29(7):690.
SONG Q L,WANG S P,ZHANG G S,etal.Preparation of plasma membrane with purity from wheat flag leaves for 2-DE proteomics [J].ChineseJournalofBiochemistry&MolecularBiology,2013,29(7):690.
[12] BAE M S,CHO E J,CHOI E Y,etal.Analysis of the Arabidopsis nuclear proteome and its response to cold stress [J].PlantJournal,2003,36(5):652.
[13] CALIKOWSKI T T,MEULIA T,MEIER I.A proteomic study of theArabidopsisnuclear matrix [J].JournalofCellularBiochemistry,2003,90(2):361.
[14] JONES A M,MACLEAN D,STUDHOLME D J,etal.Phosphoproteomic analysis of nuclei-enriched fractions fromArabidopsisthaliana[J].JournalofProteomics,2009,72(3):439.
[15] SIKORSKAITE-GUDZIUNIENE S,HAIMI P,GELVONAUSKIENE D,etal.Nuclear proteome analysis of apple cultivar 'Antonovka' accessions in response to apple scab(Venturiainaequalis) [J].EuropeanJournalofPlantPathology,2017,148(4):771.
[16] PANDEY A,CHOUDHARY M K,BHUSHAN D,etal.The nuclear proteome of chickpea(CicerarietinumL.) reveals predicted and unexpected proteins [J].JournalofProteomeResearch,2006,5(12):3301.
[17] PANDEY A,CHAKRABORTY S,DATTA A,etal.Proteomics approach to identify dehydration responsive nuclear proteins from chickpea(CicerarietinumL.) [J].Molecular&CellularProteomics,2008,7(1):88.
[18] SUBBA P,KUMAR R,GAYALI S,etal.Characterisation of the nuclear proteome of a dehydration-sensitive cultivar of chickpea and comparative proteomic analysis with a tolerant cultivar [J].Proteomics,2013,13(12-13):1973.
[19] COOPER B,CAMPBELL K B,FENG J,etal.Nuclear proteomic changes linked to soybean rust resistance [J].MolecularBiosystems,2011,7(3):773.
[20] HOWDEN A J M,STAM R,MARTINEZ HEREDIA V,etal.Quantitative analysis of the tomato nuclear proteome duringPhytophthoracapsiciinfection unveils regulators of immunity [J].NewPhytologist,2017,215(1):309.
[21] KHAN M M,KOMATSU S.Rice proteomics:recent developments and analysis of nuclear proteins [J].Phytochemistry,2004,65(12):1671.
[22] MUJAHID H,TAN F,ZHANG J,etal.Nuclear proteome response to cell wall removal in rice(Oryzasativa) [J].ProteomeScience,2013,11(1):26.
[23] AKI T,YANAGISAWA S.Application of rice nuclear proteome analysis to the identification of evolutionarily conserved and glucose-responsive nuclear proteins [J].JournalofProteomeResearch,2009,8(8):3912.
[24] GONZLEZ-CAMACHO F,MEDINA F J.Identification of specific plant nucleolar phosphoproteins in a functional proteomic analysis [J].Proteomics,2004,4(2):407.
[25] ABDALLA K O,THOMSON J A,RAFUDEEN M S.Protocols for nuclei isolation and nuclear protein extraction from the resurrection plantXerophytaviscosafor proteomic studies [J].AnalyticalBiochemistry,2009,384(2):365.
[26] ABDALLA K O,BAKER B,RAFUDEEN M S,etal.Proteomic analysis of nuclear proteins during dehydration of the resurrection plantXerophytaviscosa[J].PlantGrowthRegulation,2010,62(3):279.
[27] ABDALLA K O,RAFUDEEN M S.Analysis of the nuclear proteome of the resurrection plantXerophytauiscosain response to dehydration stress using iTRAQ with 2DLC and tandem mass spectrometry [J].JournalofProteomics,2012,75(8):2361.
[28] FERREIRA B S,BRANCO A T,DE OLIVEIRA M A,etal.Methodological improvements on extraction of nuclear proteins and its preliminary analysis during the maize(ZeamaysL.) endosperm development [J].Protein&PeptideLetters,2006,13(10):981.
[29] ZUO S S,LUNDAHL P.A micro-bradford membrane protein assay [J].AnalyticalBiochemistry,2000,284(1):162.
[30] WANG S P,ZHANG G S,SONG Q L,etal.Abnormal development of tapetum and microspores induced by chemical hybridization agent SQ-1 in wheat [J].PLoSOne,2015,10(3):e0119557.
[31] DEAN R L,MISKIEWICZ E.Rates of electron transport in the thylakoid membranes of isolated,illuminated chloroplasts are enhanced in the presence of ammonium chloride [J].Biochemistry&MolecularBiologyEducation,2010,31(6):410.

