猪轮状病毒VP融合蛋白的构建及其免疫原性研究
姚 帅,徐进平
(武汉大学生命科学学院,病毒学国家重点实验室,湖北武汉 430072)
猪轮状病毒(Porcine Rotavirus,PRV)是一种能引起仔猪厌食、呕吐、腹泻、脱水和酸碱平衡紊乱为特征性症状的疾病的RNA病毒[1-3]。PRV外衣壳由结构蛋白VP4和VP7组成[4],其中VP7由基因片段(9或7、8,依不同毒株而异)编码,分子量为37 kD,由326个氨基酸组成,占病毒蛋白总量的30%,为病毒外膜的重要糖蛋白和主要中和抗原,并决定病毒的G血清型,且在相同血清型的不同毒株之间高度保守[5]。研究表明,重组蛋白和VP7的合成肽(275~295位氨基酸)可产生保护动物避免PRV感染的中和抗体[6-7]。VP4是由基因片段4编码,由776个氨基酸组成的分子量为88 kD的病毒多肽,占病毒蛋白总量的1.5%。VP4与病毒毒性有关,使病毒具有致病性[8]。VP8属于VP4截断片段,含有247个氨基酸,VP8包含了VP4的主要抗原位点,且负责VP4特异性中和反应。其同全长的VP4片段一样,能刺激机体产生中和抗体,从而激发免疫保护作用[9-11]。
目前,有很多关于以VP8、VP7蛋白为基础研制口服疫苗研究的报道,但在通过口服方式免疫动物时,由于各种消化酶作用以及本身大分子性质,往往达不到很好的免疫效果[12]。该研究将VP8与VP7基因共同表达,并借助一蛋白转导结构域:TAT转导肽序列[13-15],将其连接至VP8-VP7基因3′端,构建了融合蛋白VP8-VP7-TAT。通过检测融合蛋白VP8-VP7-TAT以不同给药方式免疫小鼠产生的免疫效果;同单一VP8-TAT、VP7-TAT相比融合蛋白VP8-VP7-TAT的免疫原性;融合蛋白VP8-VP7-TAT的穿肠功能;融合蛋白VP8-VP7-TAT免疫动物的安全性,为PRV口服疫苗的研究提供一种新的思路。
1 材料与方法
1.1材料
1.1.1菌株与质粒。大肠杆菌EscherichiacoliBL21(DE3)购自Novagen公司,质粒pGEX-6p-1为病毒学国家重点实验室保存。
1.1.2试剂。质粒小提取试剂盒和ELISA试剂盒购自康为世纪生物科技有限公司,GST-Resin纯化试剂盒购自七海生物,HRP标记的羊抗鼠IgG和HRP标记的羊抗鼠IgA购自武汉三鹰生物技术有限公司,抗GST血清为病毒学国家重点实验室保存。
1.1.3实验动物。SPF级别6~8周龄的雄性昆明小鼠购自湖北省疾控中心的实验动物研究中心。
1.2方法
1.2.1基因合成与鉴定。参照JL94株VP8基因序列(AY523636.1)与VP7基因序列(AER25320.1),在融合基因VP8-VP7的C端连接TAT转导肽序列,并将重组基因VP8-VP7-TAT克隆至表达载体pGEX- 6p-1中。用pGEX -6p-1通用引物(上游引物F:5′-GGGCTGGCAAGCCACG TTTGGTG-3′;下游引物R:5′-CCGGGAGCTGCATGTGTCAGAGG-3′)扩增VP8-VP7-TAT基因,经菌落PCR、基因测序鉴定重组质粒为pGEX-VP8-VP7-TAT。以重组质粒pGEX-VP8-VP7-TAT为模板,设计引物(VP8-up:CCGGAATTCATGGCTTCGCTCATTTATAGACV,VP8-down:CCGCTCGAGCTAACGACGACGCTGACGACGTTTCTTACGGCCATAAGCTCTTGTGT G/VP7-up:CCGGAATTCCCAACAACTGCACCACAAAC,VP7-down:CCGCTCGAGCTAACGACGACGCTGACGA),构建了重组质粒pGEX-VP8-TAT、pGEX-VP7-TAT。
1.2.2重组工程菌的制备。将实验室保存的大肠杆菌E.coliBL21(DE3)接种于LB液体培养基中,37 ℃振荡培养至OD600为0.6左右。取1.5 mL菌液离心,弃上清,加入200 μL预冷的0.1 mol/L氯化钙轻轻摇动重悬菌体沉淀,冰浴30 min。4 ℃、4 000 r/min离心10 min后弃上清,加入100 μL预冷的0.1 mol/L氯化钙重悬菌体,得到制备好的E.coliBL21(DE3)感受态细胞。取1 μL重组质粒转化E.coliBL21(DE3)感受态细胞,将转化产物均匀涂布于含氨苄青霉素的LB平板上,37 ℃培养过夜,经菌液PCR鉴定阳性重组子。即构建基因工程菌E.coliBL21(DE3)(pGEX-VP8-VP7-TAT)、E.coliBL21(DE3)(pGEX-VP8-TAT)及E.coliBL21(DE3)(pGEX-VP7-TAT)。
1.2.3融合蛋白的表达与纯化。挑取基因工程菌的单菌落接种于5 mL加有200 μg/mL 氨苄青霉素的LB液体培养基中,37 ℃过夜培养后,按1∶100的比例转接到20 mL选择性LB液体培养基中,37 ℃振荡培养至OD600约为0.6时,加入0.5 mmol/L的IPTG诱导剂,30 ℃、250 r/min振荡培养4 h。将菌液在4 ℃、10 000 r/min离心1 min,收集菌体沉淀,加入细胞裂解液重悬菌体,300 W超声破碎至菌液不再黏稠后,取少量样品加入适当上样缓冲液进行SDS-PAGE电泳分离和Western blot分析;12 000 r/min离心10 min,收集包涵体沉淀。经洗涤液洗涤及变、复性后,将溶有融合蛋白的溶液与GST纯化柱在4 ℃孵育过夜,4 ℃、3 000 r/min离心5 min。缓慢去除上清液,加入PBS清洗杂蛋白,4 ℃、3 000 r/min离心5 min。缓慢去除上清液后,加入pH 8.0 Elution buffer,室温轻摇10 min,4 ℃、3 000 r/min离心5 min,收集上清液,SDS-PAGE电泳分析蛋白纯化情况。
1.2.4实验动物分组、免疫和采样。将昆明小鼠随机分为8组,每组8只。融合蛋白VP8-VP7-TAT、VP8-TAT以及VP7-TAT分别经腹腔注射和灌胃的方式免疫小鼠,免疫剂量为100 μg/只,免疫3次,间隔14 d以相同剂量加强免疫1次,同时设置腹腔注射或灌胃PBS作为阴性对照组。在首次免疫后的第7、21、35天收集免疫小鼠血液和粪便样品:全血37 ℃静置1 h后,在4 ℃放置过夜,次日4 ℃、2 000 r/min离心20 min,分离血清;每0.1 g粪便用200 μL 0.01 mol/L的PBS充分混匀,4 ℃作用1.5 h,离心收集上层液体。
1.2.5抗体检测。分别将纯化的融合蛋白VP8-VP7-TAT、VP8-TAT和VP7-TAT以100 μL/孔包被酶标板,4 ℃放置过夜;次日弃去孔中液体,PBST反复洗涤5次,按200 μL/孔加入5%脱脂奶粉,37 ℃封闭2 h;弃去孔中液体,PBST洗涤5次,按100 μL/孔加入适当倍数稀释好的待检样品,37 ℃孵育2 h;弃去孔中液体,PBST洗涤5次,按100 μL/孔加入1∶5 000稀释的二抗(HRP标记羊抗鼠IgG抗体或HRP标记羊抗鼠IgA抗体),37 ℃孵育2 h;弃去孔中液体,PBST洗涤5次,每孔加入100 μL OPD底物溶液,避光显色5 min后加入反应终止液,测定样品的OD490。
1.2.6迟发型超敏反应。将融合蛋白VP8-VP7-TAT与氟氏完全佐剂1∶1反复吹打充分混匀后注射于小鼠的右后足垫皮下,注射量为10 μg/只,并在同一小鼠的左后足垫皮下注射同体积生理盐水作为对照。注射抗原后测量24、48、72 h以及7、14 d小鼠的左右足垫厚度,观察肿胀的发生和消长情况,其结果以++、+、-表示(++代表明显肿胀;+代表轻度肿胀;-代表无肿胀)。
1.2.7融合蛋白VP8-VP7-TAT的穿肠活性检测。取5 cm小鼠肠管,用PBS缓冲液冲洗小鼠肠管,肠管一端扎紧,吸取浓度为100 μg/mL的溶有融合蛋白VP8-VP7-TAT溶液至扎好的小鼠肠管,扎好肠管的另一端,投入到装有10 mL PBS缓冲液的试管中,并使PBS缓冲液完全浸没小鼠肠管,设置PBS阴性对照组,30 ℃下静置,间隔1 h取样,ELISA方法检测待检样品。
1.2.8小鼠安全性实验。通过监测小鼠体重的变化来进行关于融合蛋白VBP8-VP7-TAT的小鼠安全性实验。分别在0、14、28、42 d称量腹腔注射组、灌胃组、PBS对照组小鼠的平均体重,观察融合蛋白VP8-VP7-TAT对小鼠生理指标的影响。
2 结果与分析
2.1重组质粒的鉴定以重组质粒pGEX-VP8-VP7-TAT为模板,用引物扩增VP8-VP7-TAT序列,PCR鉴定重组质粒,结果显示目的条带与预期大小1 069 bp相符。经后续测序鉴定,重组质粒pGEX-VP8-VP7-TAT构建正确(图1)。
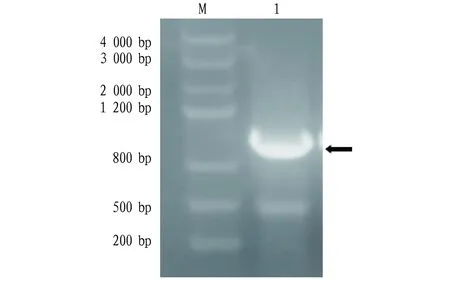
注:M.DNA Marker IV;1.重组质粒pGEX-VP8-VP7-TAT的PCR扩增产物Note:M.DNA Marker IV;1.Recombinant plasmid pGEX-VP8-VP7-TAT PCR amplification product图1 重组质粒的鉴定Fig.1 Identification of recombinant plasmid
2.2基因工程菌的诱导表达将基因工程菌E.coliBL21(DE3)(pGEX-VP8-VP7-TAT)振荡培养至OD600约为0.6时,以0.5 mmol/L IPTG、37 ℃诱导表达4 h。结果显示,诱导后基因工程菌E.coliBL21(DE3)(pGEX-VP8-VP7-TAT)表达的蛋白分子量约59.9 kD,与预期的融合蛋白大小相符。初步表明融合蛋白VP8-VP7-TAT在大肠杆菌中获得表达(图2)。
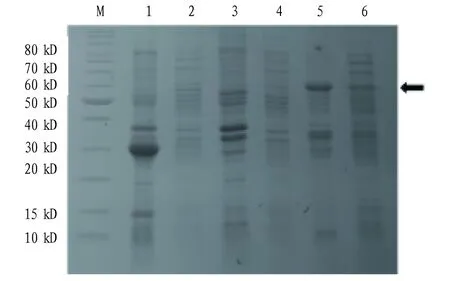
注:M.蛋白Marker;1.诱导后E.coli BL21(DE3)(pGEX-6p-1)破碎液沉淀;2.诱导后E.coli BL21(DE3)(pGEX-6p-1)破碎液上清;3.未诱导E.coli BL21(DE3)(pGEX-VP8-VP7-TAT)破碎液沉淀;4.未诱导E.coli BL21(DE3)(pGEX-VP8-VP7-TAT)破碎液上清;5.诱导后E.coli BL21(DE3)(pGEX-VP8-VP7-TAT)破碎液沉淀;6.诱导后E.coli BL21(DE3)(pGEX-VP8-VP7-TAT)破碎液上清Note:M.Protein Marker;1.Crushing liquid precipitation of induced E.coli BL21(DE3)(pGEX-6p-1);2.Crushing liquid supernatant of induced E.coli BL21(DE3)(pGEX-6p-1);3.Crushing liquid precipitation of non-induced E.coli BL21(DE3)(pGEX-VP8-VP7-TAT);4.Crushing liquid supernatant of non-induced E.coli BL21(DE3)(pGEX-VP8-VP7-TAT);5.Crushing liquid precipitation of induced E.coli BL21(DE3)(pGEX-VP8-VP7-TAT);6.Crushing liquid supernatant of induced E.coli BL21(DE3)(pGEX-VP8-VP7-TAT)图2 融合蛋白VP8-VP7-TAT的诱导表达分析Fig.2 Expression analysis of fusion protein VP8-VP7-TAT
2.3融合蛋白VP8-VP7-TAT的Westernblot分析将基因工程菌E.coliBL21(DE3)(pGEX-VP8-VP7-TAT)诱导后进行SDS-PAGE电泳。之后将蛋白转移到NC膜上,观察Western blot结果。结果显示,表达的与GST融合的蛋白能被抗GST的单克隆抗体识别,蛋白条带大小与预期59.9 kD符合,证实融合蛋白VP8-VP7-TAT在大肠杆菌中得以正确表达(图3)。
2.4融合蛋白的纯化收集诱导后E.coliBL21(DE3)(pGEX-VP8-VP7-TAT)、E.coliBL21(DE3)(pGEX-VP8-TAT)、E.coliBL21(DE3)(pGEX-VP7-TAT)破碎液沉淀,经尿素洗涤、过滤后,将其与GST纯化柱4 ℃过夜孵育后,用适量PBS洗去杂蛋白,最后用pH 8.0的还原性谷胱甘肽洗脱液洗脱目的蛋白,从而获得纯化蛋白(图4)。
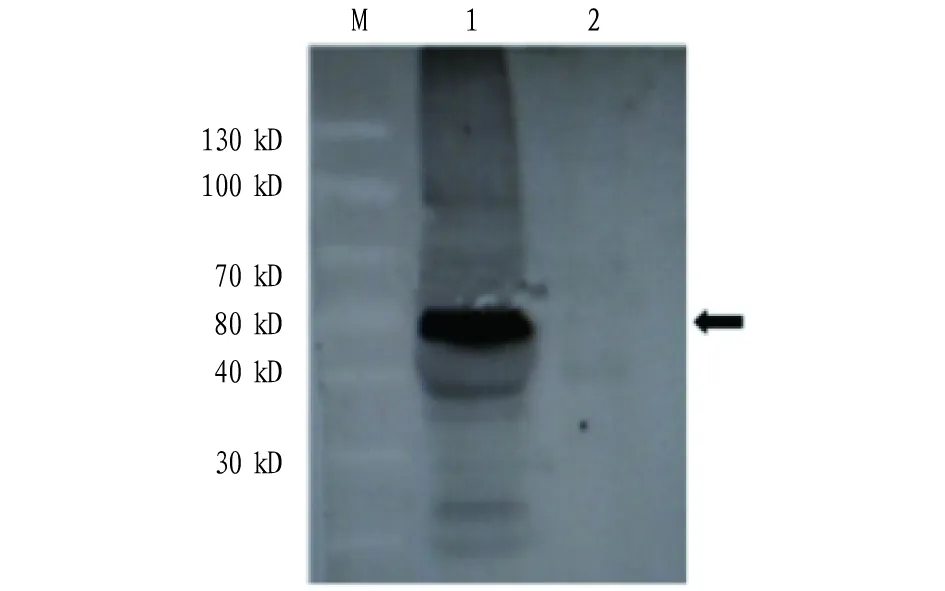
注:M.蛋白Marker;1.诱导后E.coli BL21(DE3)(pGEX-VP8-VP7-TAT)破碎液沉淀;2.诱导后E.coli BL21(DE3)(pGEX-VP8-VP7-TAT)破碎液上清Note:Protein Marker;1.Crushing liquid precipitation of induced E.coli BL21(DE3)(pGEX-VP8-VP7-TAT);2.Crushing liquid supernatant of induced E.coli BL21(DE3)(pGEX-VP8-VP7-TAT)图3 融合蛋白VP8-VP7-TAT的Western blot分析Fig.3 Western blot analysis of fusion protein VP8-VP7-TAT

注:M.蛋白Marker;1~3.纯化蛋白VP8-VP7-TAT;4~6.纯化蛋白VP8-TAT;7~9.纯化蛋白VP7-TATNote:M.Protein Marker;1-3.Purified protein VP8-VP7-TAT;4-6.Purified protein VP8-TAT;7-9.Purified protein VP7-TAT图4 融合蛋白的纯化Fig.4 Purification of fusion protein
2.5免疫小鼠的血清IgG抗体水平融合蛋白VP8-VP7-TAT,以及按照VP8-VP7-TAT制备方法制备的融合蛋白VP8-TAT、VP7-TAT,经腹腔注射和灌胃给药方式免疫昆明小鼠,免疫3次,间隔14 d。于免疫后7、21、35 d随机取3只实验小鼠断尾取血,分离血清。血清IgG抗体ELISA检测结果显示(图5):在免疫7 d后,腹腔注射组和灌胃组小鼠血清特异性IgG抗体OD490相比于阴性对照组均有显著升高,可见腹腔注射组和灌胃组小鼠在免疫后第7天就产生了特异性IgG抗体。在经过二免、三免后,腹腔注射组和灌胃组小鼠血清中抗体的OD490均持续升高,与阴性对照组相比差异显著,而阴性对照组的OD490变化不大。在整个实验过程中,腹腔注射组的血清特异性抗体IgG的OD490始终高于灌胃组,且融合蛋白VP8-VP7-TAT的OD490一直高于VP8-TAT、VP7-TAT,而阴性对照组一直变化不大且维持在低水平。
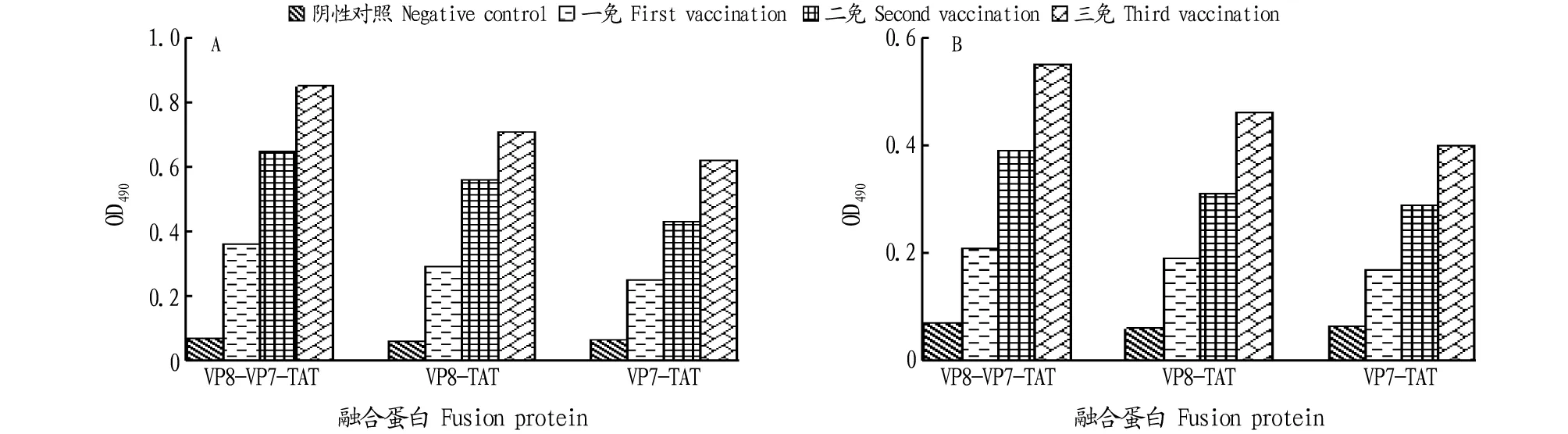
注:A.腹腔注射组小鼠血清IgG抗体的间接ELISA检测;B.灌胃组小鼠血清IgG抗体的间接ELISA检测Note:A.Indirect ELISA detection of serum IgG antibody in the intraperitoneal injection group;B.Indirect ELISA detection of serum IgG antibody in the gavage group图5 免疫小鼠血清IgG抗体的间接ELISA检测Fig.5 Indirect ELISA analysis of IgG antibody in murine serum
2.6免疫小鼠的黏膜IgA抗体水平融合蛋白VP8-VP7-TAT,以及按照VP8-VP7-TAT制备方法制备的融合蛋白VP8-TAT、VP7-TAT,经腹腔注射和灌胃给药方式免疫昆明小鼠,间隔7 d随机取3只实验小鼠的粪便样品,间接ELISA检测肠道黏膜IgA抗体。检测结果显示(图6):在免疫7 d后,灌胃组小鼠特异性抗体IgA的OD490相比于阴性对照组有了显著升高,而腹腔注射组小鼠特异性抗体IgA的OD490相比于阴性对照组升高不显著。在经过二免、三免后,灌胃组小鼠IgA抗体的OD490均持续升高,与阴性对照组相比差异显著,而腹腔注射组和阴性对照组的OD490变化不大。在整个实验过程中,灌胃组的特异性抗体IgA的OD490始终高于腹腔注射组,且融合蛋白VP8-VP7-TAT组特异性抗体IgA的OD490始终高于VP8-TAT组和VP7-TAT组,而阴性对照组的OD490则一直维持在低水平。

注:A.腹腔注射组小鼠黏膜IgA抗体的间接ELISA检测;B.灌胃组小鼠黏膜IgA抗体的间接ELISA检测Note:A.Indirect ELISA detection of mucosa IgA antibody in the intraperitoneal injection group;B.Indirect ELISA detection of mucosa IgA antibody in the gavage group图6 免疫小鼠黏膜IgA抗体的间接ELISA检测 Fig.6 Indirect ELISA analysis of IgA antibody in murine intestinal mucosa
2.7融合蛋白的安全性实验通过监测小鼠体重的变化来进行关于融合蛋白VBP8-VP7-TAT的小鼠安全性实验。分别在0、14、28、42 d称量腹腔注射组、灌胃组、PBS对照组小鼠的平均体重,观察融合蛋白VP8-VP7-TAT对小鼠生理指标的影响。结果显示:3组小鼠的体重没有显著差异,说明融合蛋白VP8-VP7-TAT不影响小鼠的生长指标,为安全可靠的免疫抗原(图7)。
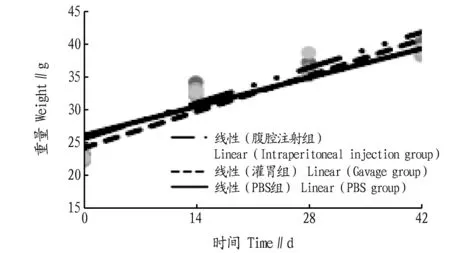
图7 免疫小鼠的体重变化Fig.7 The change of body weight in murine
2.8融合蛋白VP8-VP7-TAT的穿肠活性取小鼠肠管来研究融合蛋白VP8-VP7-TAT的穿肠功能,检测肠管外环境中融合蛋白VP8-VP7-TAT的吸光值。结果显示(图8):VP8-VP7-TAT样品组检测肠外溶液中融合蛋白VP8-VP7-TAT的OD490在4 h期间保持持续上升,在4 h时,融合蛋白VP8-VP7-TAT的OD490达到最大值,5 h开始下降。根据PBS阴性对照所测得的OD490计算得出的cut-off值为0.15,VP8-VP7-TAT样品组肠外溶液的OD490在2~5 h内均高于0.15,呈阳性结果。可见TAT蛋白转导肽能够携带与其融合表达的VP8-VP7蛋白穿过小鼠肠壁细胞进入到肠壁外溶液中,并且一段时间内,肠壁外溶液中融合蛋白VP8-VP7-TAT的浓度水平随着时间延长而升高。实验结果表明融合蛋白VP8-VP7-TAT具有穿肠活性。

图8 融合蛋白VP8-VP7-TAT的穿肠活性检测Fig.8 The intestinal activity of fusion protein VP8-VP7-TAT
2.9迟发型超敏反应实验动物对抗原的迟发型超敏反应可通过足垫肿胀实验来观察。结果表明(表1):同注射生理盐水的对照组相比,三免之后的小鼠足垫注射抗原24 h后出现明显的足垫肿胀,在48、72 h时达到高峰,7~14 d肿胀逐渐消退。而同一昆明小鼠的左后足垫注射生理盐水后未见足垫肿胀反应。
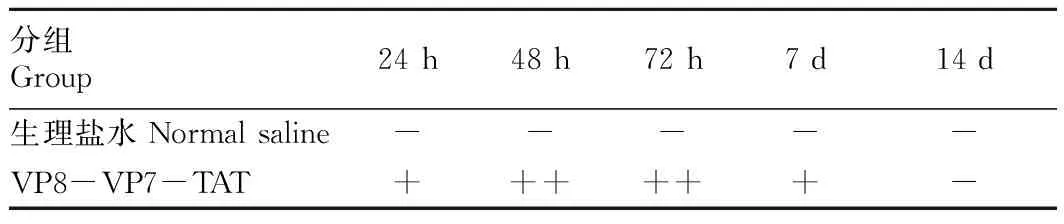
表1 免疫小鼠足垫肿胀程度
3 讨论
猪轮状病毒是引起仔猪病毒性腹泻的重要病原之一,给猪养殖业造成了巨大的经济损失。VP8和VP7基因作为PRV诱导免疫中和反应的核心序列,利用其翻译的蛋白制作亚单位疫苗具有良好的可行性。然而,PRV主要攻击宿主的肠道组织,肠道黏膜免疫所产生的分泌型IgA抗体才是抵抗该病毒的有效抗体,因此口服免疫作为一种简单可行的免疫接种途径,既能诱导产生分泌型IgA抗体,又具有可以应用于规模养猪的优势。
该研究基于VP8、VP7基因的诱导中和抗体作用及TAT转导肽的跨膜转导特性,首次将VP8、VP7与TAT转导肽进行融合,成功构建了重组质粒pGEX-VP8-VP7-TAT并表达与纯化了融合蛋白VP8-VP7-TAT。为了研究融合蛋白VP8-VP7-TAT经口服和注射小鼠后体内的免疫应答方式,以及同单一VP8-TAT、VP7-TAT相比免疫原性是否有所增强,该研究比较了2种不同给药方式以及同单一VP8-TAT、VP7-TAT相比诱导产生的抗体水平。结果显示,腹腔注射组能够诱导产生较高水平的血清IgG抗体,产生速度较快,但其黏膜IgA抗体一直处于较低水平;而灌胃组除了可以诱导小鼠产生中等水平的血清IgG抗体之外,其黏膜IgA抗体水平也是显著高于其他实验组;融合蛋白重构体VP8-VP7-TAT无论以腹腔注射还是以灌胃的方式免疫小鼠,其诱导产生的血清IgG抗体和黏膜IgA抗体水平均高于单一的VP8-TAT、VP7-TAT。以上结果说明融合蛋白VP8-VP7-TAT经口服或注射小鼠后,能够有效诱导小鼠机体产生体液免疫应答,并且融合蛋白VP8-VP7-TAT经口服可诱导小鼠机体产生较强的黏膜免疫应答,并且相比于传统的单一VP8或者VP7作为免疫原能刺激机体产生更强的免疫应答。此外,融合蛋白VP8-VP7-TAT的穿肠实验和小鼠安全性实验表明,融合蛋白VP8-VP7-TAT具有穿肠活性且不影响免疫动物的生长指标,为安全可靠的免疫抗原,为口服抗PRV基因工程疫苗的研制提供一定的参考价值。
[1] 张雷,卫广森.猪轮状病毒感染研究进展[J].现代畜牧兽医,2005(4):42-44.
[2] 庞其方,丘富禧,俞富荣,等.秋季婴幼儿急性胃肠炎病源——轮状病毒的研究[J].医学研究通讯,1979(7):26-27.
[3] ESTES M K,COHEN J.Rotavirus gene structure and function[J].Microbiol Rev,1989,53(4):410-449.
[4] 乔薪瑗.表达猪轮状病毒VP4基因和共表达VP4与LTB重组乳酸菌表达系统的构建及其免疫学评价[D].哈尔滨:东北农业大学,2008.
[5] RAO C D,GOWDA K,REDDY B S.Sequence analysis of VP4 and VP7 genes of nontypeable strains identifies a new pair of outer capsid proteins representing novel P and G genotypes in bovine rotaviruses [J].Virology,2000,276(1):104-113.
[6] CHEN Y D,WEN Y L,LIU X,et al.Full genomic analysis of human rotavirus strain TB-Chen isolated in China[J].Virology,2008,375(2):361-373.
[7] 杨艳梅,李霞,杨慧,等.A组轮状病毒多个结构蛋白抗原表位的串联表达及其免疫原性的检测[J].生物化学与生物物理进展,2011,38(1):60-66.
[8] GHOSH A,CHATTOPADHYAY S,CHAWLA-SARKAR M,et al.Insilicostudy of rotavirus VP7 surface accessible conserved regions for antiviral drug/vaccine design[J].PIoS One,2012,7(7):1-12.
[9] KOVACS-NOLAN J,MINE Y.Tandem copies of a human rotavirus VP8 epitope can induce specific neutralizing antibodies in BALB/c mice[J].Biochimica et biophysica acta,2006,1760(12):1884-1893.
[10] ESTES M K,KAPIKIAN A Z,KNIPE D M,et al.Fields virolog[M].Philadelphia,PA:Lippencott,Williams and Wilkins,2007.
[11] 毕艳铎,魏晓曼,冉旭华,等.猪轮状病毒重组VP8*蛋白的原核表达及免疫原性分析[J].黑龙江八一农垦大学学报,2015,27(6):28-32.
[12] 迟延彬.A群猪轮状病毒VP7蛋白单抗的制备及其抗原表位鉴定[D].哈尔滨:东北农业大学,2014.
[13] JIN L H,BAHN J H,EUM W S,et al.Transduction of human catalase mediated by an H1V-1 TAT protein basic domain and arginine-rich peptides into mammalian cells[J].Free Radic Biol Med,2001,31(11):1509-1519.
[14] 艾菁,王丽梅,夏威,等.Tat蛋白结构与功能的研究进展[J].细胞与分子免疫学杂志,2005,21(S1):133-135.
[15] 吴永红,张成岗.HIV-1 TAT蛋白转导肽的研究进展[J].中国生物工程杂志,2010,30(10):66-73.

