温度对茶发酵叶色泽及茶色素含量的影响
滑金杰,袁海波,姚月凤,江用文,王近近
(中国农业科学院茶叶研究所,国家茶产业工程技术研究中心,农业部茶树生物学与资源利用重点实验室,浙江省茶叶加工工程重点实验室,杭州 310008)
0 引 言
红茶,作为世界上消费量最大的茶类,具有其独特的汤色、滋味和香气等内质,外形和汤色是评判红茶质量优劣及市场价格体现的重要指标之一[1-2],也是判断红茶发酵适度的重要参数之一[3-6]。发酵是红茶品质形成的关键工序[7-8],鲜叶内多酚类物质与多酚氧化酶、过氧化物酶等发生酶促氧化聚合反应,叶色逐渐由绿向黄绿→黄→橙黄→红等依次转变,同时生成茶黄素、茶红素、茶褐素等(统称茶色素)品质成分和功能物质[9-11],TFs(theaflavins,即茶黄素)和TRs(thearubigins,即茶红素)亦是红茶关键的呈味、呈色物质[12-16]。温度是发酵工序的关键参数之一,直接影响叶内茶黄素和茶红素等红茶品质物质的形成。现有研究多集中于发酵温度对滋味物质、香气成分、红茶品质影响等方面[17-20],而有关发酵温度对发酵在制品汤色和外形变化影响的研究甚少。发酵适度的判断仍以制茶人员的主观评判为主,通过观叶色、闻叶香进行人为评判,客观性差。有学者利用电子鼻技术[21-24]、漫反射光谱和可见远红外光谱技术[25-26]、电荷耦合器件(charge-coupled device,CCD)色泽检测技术[27]等技术,客观判断发酵的进程和适度,研究表明DL(亮度色差值)、Da(红度色差值)、Db(黄度色差值)、DE(总色差值)等汤色指标与茶汤的感官评审得分呈极显著相关性[28-29]。但发酵过程中外形和汤色的色相指标的变化规律,发酵温度对其影响,以及外形色相与品质成分相关性等方面仍未进行研究。本文应用新型便携式光学测色仪,旨在通过探究不同发酵温度对发酵叶外形色泽和汤色L(亮度)、a(红度)、b(黄度)等色相指标变化规律,同时结合发酵温度对茶黄素、茶红素等品质成分变化的影响,探讨三者的相关性,建立评价红茶发酵适度的客观方法,同时获得适度发酵下的外形和汤色色相指标,为确定红茶发酵适度和改进传统工艺提供理论支持和技术指导。
1 材料与方法
1.1 试验材料与仪器
“福鼎大白茶”品种鲜叶原料,嫩度为一芽一叶至一芽二叶初展,杭州市茶叶试验场,采摘日期为2016年5月。
PRX-450D型人工气候箱(上海谷宁实业有限公司);6CR-45型揉捻机(浙江上洋机械有限公司);JY-6CHZ-7B型茶叶烘焙提香机(福建佳友机械有限公司);CM-5型台式分光测色仪,CM-600d型便携式分光测色仪(柯尼卡美能达(中国)投资有限公司);LGJ-50C型真空冷冻干燥机(北京四环科学仪器厂有限公司);Sartorius Quintix224-1CN型分析天平(赛多利斯科学仪器(北京)有限公司);岛津UV-3600型紫外-可见近红外分光光度计(日本岛津公司);DK-S26型电热恒温水浴锅(上海精宏实验设备有限公司);JW-B型分液漏斗振荡器(常州市顶新实验仪器有限公司)。
1.2 制茶流程
1.2.1 制茶流程及处理
1)萎凋。在人工气候箱内进行,设置温度28℃、光照强度6 000 lx、相对湿度70%,鲜叶总处理量为20.0kg,将鲜叶混匀、薄摊,摊放厚度5 cm,至鲜叶含水率达62%~64%进行揉捻。
2)揉捻。以空揉20 min→轻揉15 min→重揉10 min→轻揉15 min→重揉10 min→轻揉5 min进行,总计75 min,后进行解块。
3)发酵。在人工气候箱内进行,设置25、30、35、40℃等4个温度处理,设置相对湿度95%,发酵时间3.0 h。
4)干燥。在提香机内进行,120℃初烘15 min后,进行适当摊凉,而后85℃烘至足干(约30 min)。
1.2.2 取样方法
不同发酵温度处理每隔0.5 h进行取样,取样时将发酵叶混匀,取60 g样置于液氮冷冻固样,后经低温冷冻干燥获冻干样,置于-20℃冰柜待测,检测生化成分;同时取样进行外形色泽数据采集。
1.3 检测方法
1.3.1 茶在制品外形色泽属性检测
在发酵过程中取样的同时,使用便携式色差仪对样品的外形色泽进行三角测定,以获得可反映发酵叶和发酵程度的各色差属性。采用L*a*b色差系统进行测定,其中L值代表明度;a代表红色度,“+”代表红色程度,“-”代表绿色程度,b代表黄蓝色度,“+”代表黄色程度,“-”代表蓝色程度。DL、Da、Db均表示色差值,DE表示总色差值[30-31]。每次取样时用测色仪进行三角测定即时色差,5次重复。

式中LM为发酵样的L值,L0为揉捻样的L值;aM为发酵样的a值,a0为揉捻样的a值;bM为发酵样的b值,b0为揉捻样的b值。
1.3.2 茶在制品汤色色泽属性检测
取未研磨的在制品冻干样3 g放入审评杯中,加入150 mL沸水,冲泡5 min,后用茶漏和滤纸过滤,取茶汤作为待测母液。取母液茶汤置于比色皿,在CM-5型台式分光测色仪进行色差测定。每个样品重复测定3次。

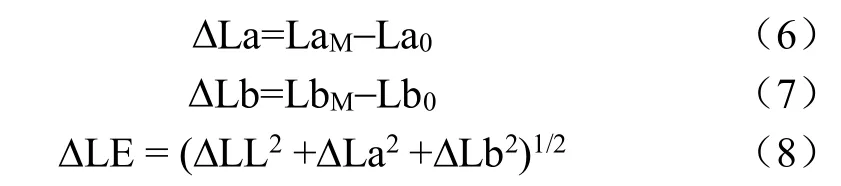
式中LLM为发酵样的汤色的L值,LL0为揉捻样汤色的L值;LaM为发酵样汤色的a值,La0为揉捻样汤色的a值;LbM为发酵样汤色的b值,Lb0为揉捻样汤色的b值;DLE为汤色总色差值。
1.3.3 茶在制品总汤色值测定
参照Obanda等[17]的方法,取上述待测母液5 mL,加入5 mL纯水,充分震荡混匀,以纯水为空白对照,在460 nm下进行吸光值测定。

LC为发酵样的总汤色值,DM是干物重质量分数。
1.3.4 茶黄素、茶红素、茶褐素等质量分数检测
参照Roberts等[32]的系统分析法,室温下取3.0 g未研磨茶样溶于125 mL沸纯水,100℃水浴锅中浸提10 min,抽滤、冷却待测。茶色素分离提取:取30 mL茶汤于60 mL分液漏斗中,加入30 mL乙酸乙酯,振荡5 min静置待分层后放出水层(下层)、倒出乙酸乙酯层(上层)。吸取上层2 mL加25 mL95%乙醇定容至25 mL,得到溶液A;吸取下层2 mL加2 mL饱和草酸溶液和6mL蒸馏水,加95%乙醇定容至25 mL,得到溶液B;吸取上层15 mL于30 mL分液漏斗中,加15 mL2.5%碳酸氢钠溶液,振荡30s静置分层后,弃去上层,吸取下层4 mL,加95%乙醇定容至25 mL,得到溶液C;取茶汤15 mL于30 mL分液漏斗中,加15 mL正丁醇,振荡3 min,静置分层后吸取水层2 mL加2 mL饱和草酸溶液和6 mL蒸馏水,加95%乙醇定容至25 mL,得到溶液D。将得到的4种溶液于380 nm处测定吸光值并记录为EA、EB、EC、ED。按照式(10)~(14)计算。
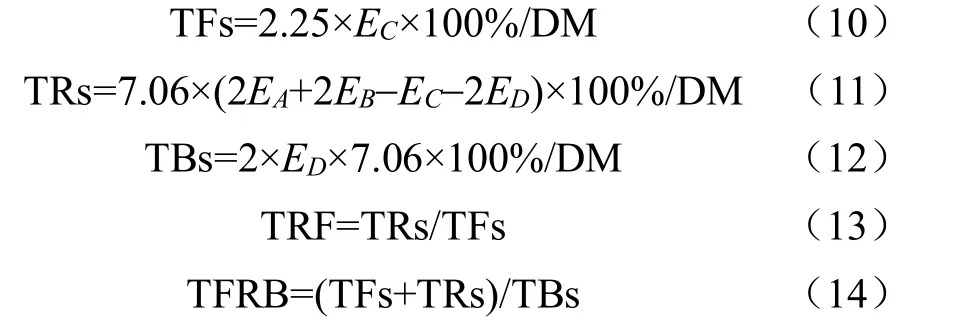
式中TFs为茶黄素质量分数,TRs为茶红素质量分数,TBs为茶褐素质量分数,EA为溶液A的吸光值,EB为溶液B的吸光值,EC为溶液C的吸光值,ED为溶液D的吸光值,DM是干物质量比例,TRF是茶红素与茶黄素的比值,TFRB为茶黄素和茶红素之和与茶褐素的比值。
1.4 数据处理
试验重复3次,每次试验结果以3个重复的平均值表示。采用SAS9.1软件进行数据分析,不同发酵处理间平均值的比较用单方面分类的方差分析,相关分析应用于品质生化成分、外形色相指标、汤色色相指标等三者的相关性分析。回归分析应用于生化成分与色相指标之间的模型建立,其中,TFs、TRs、TFRB等为因变量,LL、LC、La、Lb、L、a、b等为自变量。
2 结果与分析
2.1 发酵温度对茶在制品外形色泽属性变化规律和色差值的影响
发酵温度对发酵叶外形色泽指标L值、a值和b值变化规律影响的结果如表1所示。随着发酵时间的延长,不同发酵温度下发酵叶的亮度L值均呈降低的趋势,在90 min有所回升,且30℃以上的处理在发酵前60 min呈急速下降趋势,25℃处理呈较均匀的下降趋势,不同温度比较,整体以25℃处理下发酵叶的L值显著(P<0.05)高于其他处理,且L值随着温度的上升呈下降趋势,即低温发酵有利于发酵叶亮度、鲜活度的提升。红度a值随着发酵的进行呈先增加而后波动平稳的趋势,这与发酵叶由绿变黄的表观特征一致,a值的剧变期发生在发酵前60 min,这点与L值变化一致,不同温度比较以35℃处理下发酵叶红度显著最高,40℃下显著最低,即温度的适度增加有利于茶红素等显红性物质的生成,但温度过高则不佳。黄蓝度b值在发酵起始点即为最高,即揉捻叶的黄度最强,随着发酵的进行呈下降趋势,除25℃处理呈较平稳下降,其他3个处理呈现前60 min剧烈下降,而后缓慢下降的趋势,且随着发酵的进行,温度越高,b值降低的越快,并呈显著性差异,以25℃发酵温度处理发酵叶的黄度最高,即低温发酵有利于茶黄素等显黄性物质的累积,温度的增加会导致其转化降解,发酵叶的黄度值下降。
不同温度下发酵叶色泽相对值DL、Da、Db、DE的变化规律如图1所示。DL在整个发酵过程中呈现先降→回升→平稳的趋势,在发酵90 min有所回升(图1a),相对于揉捻叶,发酵叶的DL呈负值,即发酵会导致茶在制品亮度下降,适度发酵有利于亮度的回升,过度发酵会导致亮度持续下降,不同温度比较以低温下DL的降幅最低,更有利于茶在制品亮度的保持。Da在发酵期间均呈正值,即发酵下茶在制品红色属性呈上升趋势,Da呈现先增后平稳的趋势(图1b),在发酵90 min达到峰值,不同温度比较以35℃处理Da增幅最大,即此温度下茶在制品红度最高。Db在发酵过程中呈现负值,即伴随着在制品红度的上升,黄度下降(图1c),且发酵时间和温度对Db呈负影响,即发酵时间越长、温度越高,在制品黄色特性越低。DE是综合了DL、Da和Db的综合色差变化属性,在发酵过程呈现前60 min迅速增加,而后缓慢上升的趋势(图1d),且温度越高,DE越大,与DL和Db的变化规律相反,这与其计算公式对应。整体上,茶在制品外形色泽的剧变期发生在前90 min,后达到较为平稳的变化趋势,低温有利于亮度和黄度的保持,高温有利于红度的提升。
2.2 发酵温度对茶在制品汤色色相属性变化规律和色差值的影响
发酵温度和时间对茶在制品汤色的总汤色LC值、亮度LL值、红度La值和黄蓝度Lb值影响显著不同(表2)。

表1 发酵温度对发酵叶L值、a值和b值变化规律的影响Table 1 Effects of fermentation temperature on L value,a value and b value of fermented leaves

注:Mean代表同一参数同一温度下不同发酵时间的均值,大写字母表示同一时间不同温度的同一参数在0.05水平上的差异性。Note:“Mean”represents the mean value of different fermentation time at the same parameter.The capital letter indicates the difference of the same parameter at the same time and different temperature on the 0.05 level.
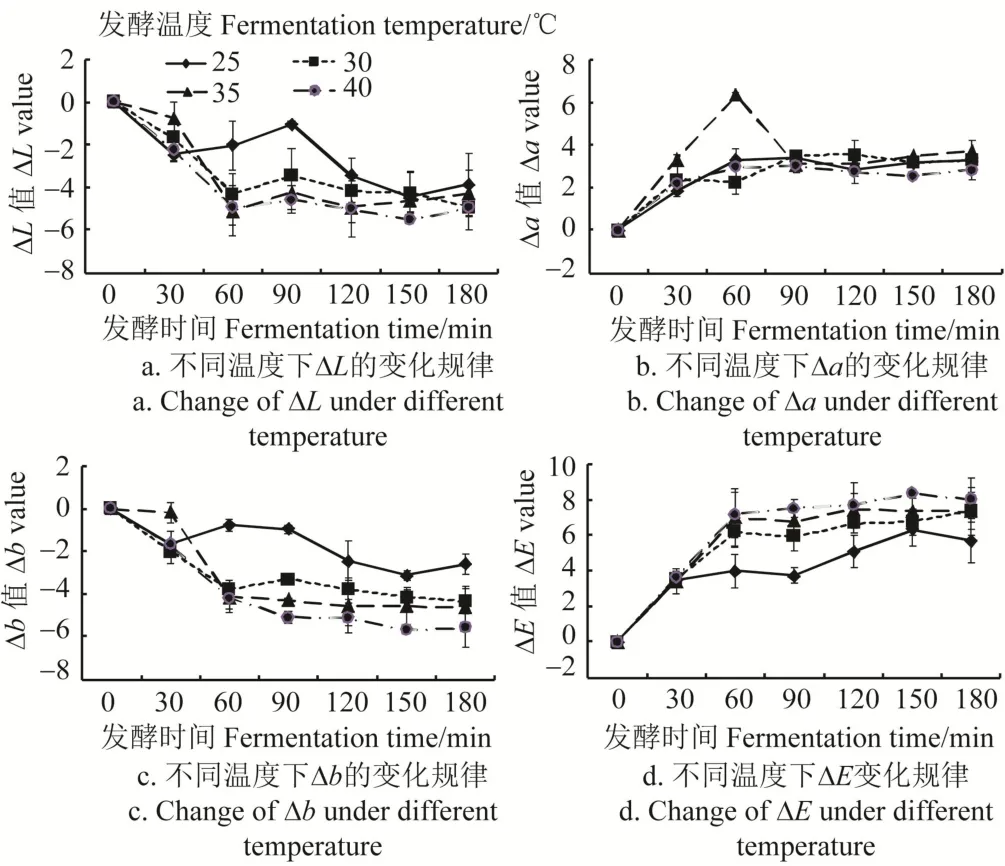
图1 发酵温度对发酵叶色泽相对值变化规律的影响Fig.1 Effects of fermentation temperature on color property of fermented leaves

表2 发酵温度对发酵叶汤色LC值、LL值、La值和Lb值变化规律的影响Table 2 Effects of fermentation temperature on LC value,LL value,La value and Lb value of fermented leaves liquor
整体上,发酵时间越长,汤色亮度LL值整体呈下降趋势,总汤色LC值、红度La值和黄度Lb值除25℃处理呈逐渐提升外,则随着发酵时间的延长呈现先升后降的趋势;相同发酵温度不同汤色指标峰值点出现的时候较一致,如30℃处理下LC值、La值和Lb值峰值均出现在90~120 min,即此3个参数具有协同效应;不同温度下LC值、La值和Lb值峰值点的高度和出现时间不同,以Lb值为例,30℃处理峰值点出现在120 min,35℃处理峰值点出现在90min,40℃处理峰值点出现在150min。不同发酵温度比较,以30℃ 处理下茶在制品汤色的LC值和黄度Lb值(P<0.05)显著高于其他3组处理,温度过高会导致此3个汤色属性值下降,即发酵温度适当的增加有利于总汤色、红黄度的提升;红度La值以低温(25或30℃)处理显著最优,亮度LL值以35℃处理相对最优,40℃处理显著最差(均以mean值比较)。与外形色泽指标比较(表1)可以看出,发酵温度对两者的影响不同,即外形色泽指标的变化不仅受水溶性物质的汤色指标影响,还受非水溶性指标的影响。
茶在制品的汤色指标DLL、DLa、DLb、DLE等在不同发酵温度和发酵时间的变化规律如图2所示。

图2 发酵温度对发酵叶汤色色泽相对值变化规律的影响Fig.2 Effects of fermentation temperature on color property of fermented leaves liquor
图中DLL在发酵过程中在负值的状态下呈整体下降趋势(图2a),变化幅度在6.0以内,在90 min有所回升,这点与外形DLL值的结果较一致(图1a),即发酵会导致叶汤色透亮度下降,不同温度比较以35℃显著较优。汤色DLa和DLb在发酵180 min内均呈现逐步上升而后有所下降的趋势(图2b和图2c),且值均为正值,汤色DLa值的变化幅度在8.0以内,而汤色DLb值的变化幅度较大,在5.0~20.0内,即发酵会促使汤色向黄、向红转变,但发酵过度会导致汤色变浑、变暗,即汤色DLa和DLb的下降,不同温度比较以20、30℃较优。汤色DLE的变化趋势与汤色DLa和DLb一致,整体呈先升后降的趋势(图2d),其中汤色DLb对DLE的贡献率最大,变化的剧烈期在发酵前60 min,即茶黄素和茶红素快速形成的时期,不同发酵温度比较,35℃有利于汤色亮度的保持,而20和30℃的低温则有利于汤色红度和黄度,以及整体色泽的提升。
2.3 发酵温度对茶在制品茶黄素、茶红素、茶褐素等转化生成的影响
发酵温度和时间对茶黄素、茶红素、茶褐素等含量及变化规律的影响如图3所示。
由图可以看出,不同温度对茶黄素(TFs)变化规律的影响不同(图3a),40℃下呈下降趋势,其他3个处理呈先升后降的趋势,且不同温度下TFs的峰值即峰值时间不同,25℃在发酵90 min达到峰值,30和35℃在发酵30 min达到峰值,且以30峰值(0.515%)显著(P<0.05)大于其他处理的峰值,25℃处理次之,即发酵温度和时间对茶黄素的形成存在显著交互作用,儿茶素在酶促氧化下转化形成茶黄素,温度的增加可加速茶黄素的生成,但同时催化茶黄素的转化,进而导致时间的增长导致茶黄素含量的下降,且温度过高(40℃)会导致茶黄素转化量大于形成量,进而形成发酵过程中茶黄素的含量下降,低温(25℃)更有利于茶黄素的持续形成。不同发酵温度下茶红素均呈先增加后下降的趋势,不同点在于峰值高度和峰值时间(图3b),其中25和40℃处理峰值点在发酵30 min,35℃处理峰值点在发酵60 min,30℃处理峰值点在发酵90~120 min,且以35℃峰值点显著最高(7.008%),但峰值点后TRs迅速下降,30℃峰值点高度次之,且保持峰值的时间较长,在发酵60~150 min,均在6.0%以上,25和40℃均在发酵前30 min有所增加,而后下降,其中40℃发酵处理降速更快,结合茶黄素变化(图3a),茶黄素的转化促进了茶红素的形成,且温度的增加会加速其转化过程,进而导致随着发酵时间的延长茶黄素含量的下降,茶红素含量的上升,但时间过长、温度过高则会导致茶红素进一步氧化聚合形成茶褐素等酚类高聚物,茶红素含量的下降,至发酵末期(150~180 min)达到均衡点,即茶红素的形成和进一步转化较一致。图3c可以看出,茶褐素整体呈现增加趋势,不同温度下具体规律不同,25和30℃处理下发酵前120 min呈匀速低量增加,120~150 min急速增加,后30 min平稳的趋势,这点与茶黄素和茶红素的变化规律相对应,低温下发酵TFs和TRs可持续形成,且长时间内可保持较高的含量(图3a和图3b),整体上显著高于35和40℃处理,进而导致低温发酵前期TBs含量的缓慢增加,而35和40℃处理TBs含量则呈现在发酵前90 min迅速增加,后期平缓的趋势,这与TFs和TRs在发酵前30 min(35℃下的TFs和40℃下的TRs)或60 min(35℃下的TRs)达到最高值后迅速下降的现象对应,其中以40℃发酵下茶褐素的形成量显著最大,最不利于发酵品质的形成。
总体上看,TFs、TRs、TBs间存在形成竞争关系,等量儿茶素底物条件下,低温(25℃)利于TFs和TRs的持续形成,且两者的进一步转化聚合量较低,TBs量较少,但TFs和TRs达到峰值的时间较长,且峰值高度较低,适当的提高发酵温度(30和35℃)利于TFs和TRs的快速高量形成,同时TBs量不会快速增加,然温度过高(40℃)则会导致TFs和TRs量迅速转化消耗,TBs量的快速形成。为此引出TFRB值(the ratio of the sum of theaflavins and thearubigins to theabrownins),即茶黄素和茶红素加和值与茶褐素比值,可以看出(图3d)在发酵过程TFRB值呈先升后降的趋势,不同温度比较以30℃处理显著最优,这点与外形a值(表1)和汤色LC值、La值和Lb值(表2)相一致且保持高值的能力最强,35℃次之,这与茶红素量(图3b)对应,40℃处理显著最低,在发酵60 min后值即小于0.8。

图3 发酵温度对发酵叶茶黄素、茶红素、茶褐素生成规律的影响Fig.3 Effects of fermentation temperature on theaflavins,thearubigins and theabrownins formation of fermented leaves
2.4 茶在制品色泽属性和色差值与茶色素生成转化的相关性分析
相关性分析用于分析茶色素与茶外形色相属性、茶汤色色泽属性的之间内在联系(表3),可以看出,TFs和TRs间呈显著正相关,TFs和TRs两者均与TFRB呈极显著正相关(P<0.01),即茶黄素和茶红素均对TFRB值具有等值贡献,TBs对TFRB呈极显著负相关(P<0.01)。TRF即TRs/TFs,是现有衡量红茶品质的重要指标,从表中可以看出TRF与TFs呈显著负相关,但与TRs无显著相关性,即TRF不能有效的代表TFs和TRs在叶内的贡献表征。

表3 发酵叶茶黄素、茶红素、茶褐素间的相关性分析Table 3 Correlation analysis between TFs,TRs and TBs of fermented leaves
由表4可以看出,茶样汤色色泽属性间LC、La、Lb三者间呈极显著正相关(P<0.01),且R2>0.90,即茶汤总汤色值、汤色红度与汤色黄度三者相互影响,对汤色品质具有协同作用,而LL则均与LC、La、Lb呈极显著负相关(P<0.01,R2>0.90),这与传统感官认知一致,水色越透亮,则透射率越高,反射率越低,吸光值越低,进而红黄度和总汤色越低,这点与表2获得的数据结果一致,即LC值的上升,伴随着LL值的下降、La和Lb值的增加。外形色泽属性则有所不同,a值与L值、b值呈极显著负相关(P>0.01),L值与b值呈极显著正相关(P<0.01,R2>0.90),外形L值为茶样条索的反光性体现,人工感官评审红茶时黄色出现,即金毫,对应茶样的亮度L值会随之提高,红度a值因黄度掩盖而值有所下降,这点与表1的研究结果相一致,L值和b值在发酵中的变化规律一致,与a值的规律相反。

表4 发酵样汤色色泽属性和外形色泽属性的相关性分析Table 4 Correlation analysis between fermented leaves color property and fermented leaves liquor color property
外形色泽属性与汤色色泽属性间呈极显著相关性,其中外形L值和b值与汤色LC、La、Lb值呈极显著负相关(P<0.01,R2>0.64),与汤色LL值呈极显著正相关(P<0.01,R2>0.71),外形a值与汤色色相属性相关性则相反,与汤色LC、La、Lb值呈极显著正相关,与汤色LL值呈极显著负相关,这与表1和表2获得的结果相吻合,随着发酵进行,茶在制品逐渐由黄变红,叶亮度L值和黄度b值下降、红度a值上升,红色物质的增加导致汤色的LC、La、Lb值则随之上升,汤内物质的增加导致透光度的下降,汤色的LL值亦下降,即外形色泽表征与汤色色泽表征存在显著相关性,可以通过外形色泽表征来获得对应的汤色特性,进而为获得优化的汤色品质提供快速判别的方法。
TFs、TRs、TBs等显色内质与茶样外形和汤色表征的相关关系如表5所示,可以看出,TFs与L值、b值、Lb值呈极显著正相关(P<0.01),其中与外形黄度b值相关性最强,R2达到0.724,与LC值、La值呈显著正相关,表明茶黄素含量直接影响茶样外形的亮度和黄度,同时对总汤色值、汤色黄度和红度均有重要的正相关影响,有利于汤色和外形优异品质的形成。TRs仅与a值和Lb值呈显著正相关(P<0.05),与L值和b值呈显著负相关(P<0.05),表明茶红素主要对茶样外形色相属性起关键影响,直接显著影响外形红度,对汤色内质的影响相对较小。TBs则与7个色泽属性均呈极显著相关性,其中与L值、b值、LL值呈极显著负相关,与a值、LC值、La值、Lb值呈极显著正相关,对应表1、表2和图3的色相表征和茶褐素的变化规律,可以看出与相关性结果较一致,即发酵的进行,外形红度a值逐渐增加,茶褐素含量的增加,汤色红黄度亦会增加,但汤色透亮度则会下降。TFRB值与7个色泽属性的相关性关系则与TBs相反,其中与LL值和b值相关性最强,呈极显著正相关,R2>0.60。
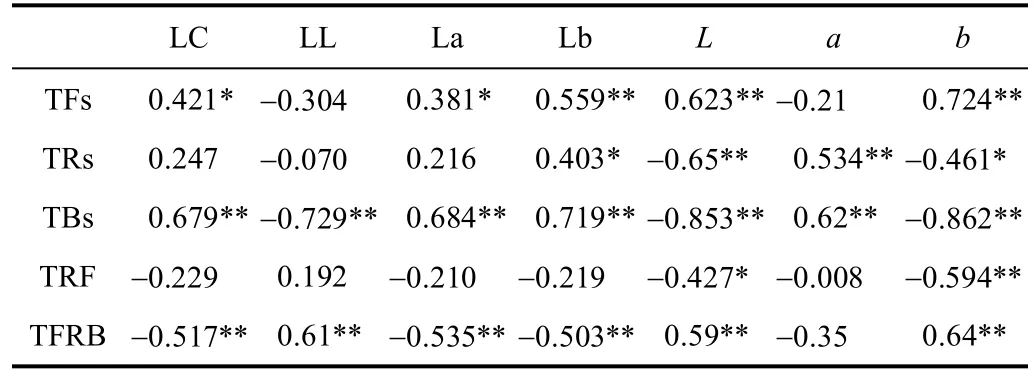
表5 发酵样色泽属性与茶色素生成转化的相关性分析Table 5 Correlation analysis between color property and colour aberration and tea pigment generation of fermented leaves
茶黄素和茶红素作为红茶关键的品质和功能成分,也是判断红茶发酵适度的重要指标,但现有检测TFs和TRs的方法较复杂、且重复性和精准性差,从相关性分析可以看出,外形色泽属性和汤色色相属性与TFs和TRs的相关性显著,为此进行以TFs和TRs为目标值的回归分析。结果表明,直接线性回归模型最适合该组样本数据,具体结果见表6。
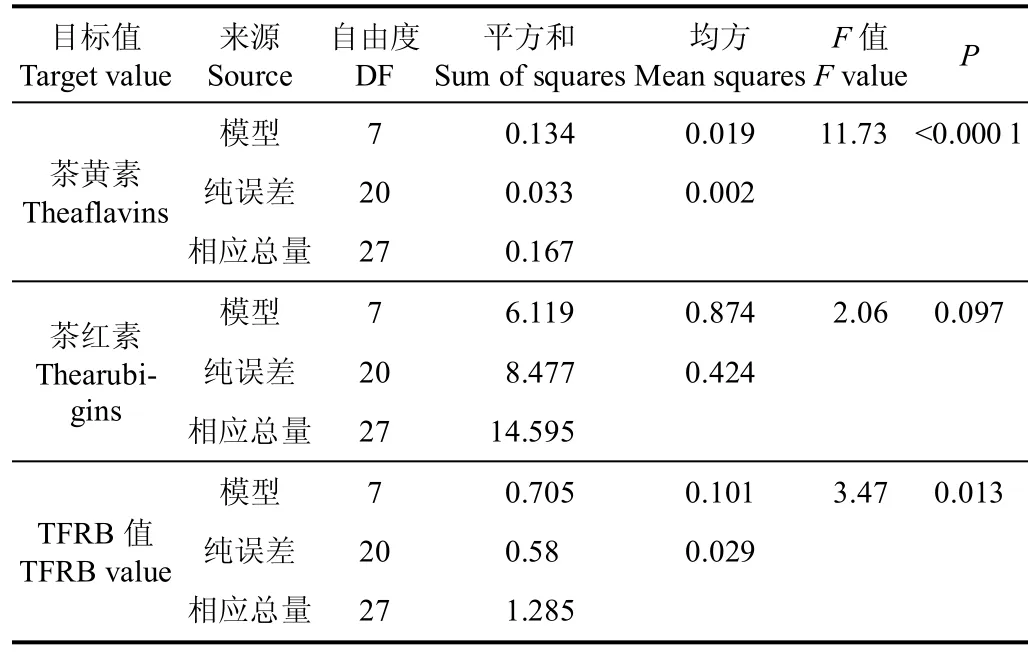
表6 以茶黄素、茶红素、TFRB值为目标值的回归分析Table 6 Regression analysis of theaflavins,thearubigins and TFRB value as target value
以TFs为目标值时,模型达到极显著(P<0.01),即该回归模型可行,多重决定系数R2达到0.804(表6),该系数预测模型中自变量对因变量的贡献比例,即外形和汤色色泽属性自变量解释了80.4%的TFs因变量的总变化,即用该模型预测TFs含量可行,由表7可以看出,汤色LL、汤色Lb和外形b值对TFs影响显著,且均呈显著正相关,即汤色和外形黄度b值的增加对应样品高含量的TFs值,随着发酵的进行,在制品逐渐变黄,对应黄度b值和汤色Lb值增加,TFs值亦随之增加,发酵进一步进行则在制品逐渐由黄变红,对应黄度b值下降、红度a值增加,TFs值随之下降。其他色泽属性无显著影响,其中以外形黄度b值对TFs影响最大,汤色亮度LL值影响次之,为此获得TFs的多元线性回归预测模型,见式(1)。

式中VLL为汤色亮度LL值,VLb为汤色黄度Lb值,Vb为外形黄度b值。
以TRs为目标值时,误差对因变量影响所占比例过大,导致模型未达到显著(P=0.097),7个色泽属性仅LL值对TRs呈显著影响(P<0.05),即以外形和汤色色泽属性为自变量建立用于预测茶红素含量的线性回归模型不可行。为此选择与7个色泽属性呈显著相关(表5),且同时可代表叶内TFs和TRs含量(表3)的TFRB值作为因变量,进行线性回归模型分析(表6),模型F值为3.47,达到显著,即用该线性模型预测TFRB值可行,后进行7个色泽属性自变量的多元线性向后回归分析(表7),其中仅外形b值达到极显著正相关,其他6个色泽属性未对因变量TFRB值产生显著影响,为此获得TFRB的线性回归预测模型,见式(2)。


表7 以茶黄素和TFRB值为目标值时各变量的显著性和参数估计Table 7 Significance and parameter estimation of variables while theaflavins and TFRB value as target value
对应表7可以看出,外形b值同时对TFs和TFRB产生显著影响,即外形b值是外形和汤色色泽属性中最为关键的色相属性,可作为判断发酵适度和评判品质成分茶黄素含量的重要指标。
3 结论
1)发酵时间的延长会导致外形色泽L值、b值的下降,a值的增加,汤色LC值、La值和Lb值的先升后降,LL值的下降;各色泽属性的剧变期均发生在前90 min。
2)不同温度比较,低温(20或30℃)有利于外形亮度L值、外形黄度b值、总汤色LC值、汤色黄度Lb值和汤色红度La的值的保持,高温(35℃)有利于外形红度a值和汤色透亮度LL值的增加。
3)随着发酵进行,品质成分TFs(茶黄素)和TRs(茶红素)均呈先增后降的趋势,然茶红素峰值点出现时间晚于茶黄素,且不同温度峰值点出现时间和峰值高度不同,整体上,以25℃发酵有利于TFs的形成和累积,而30℃发酵有利于TRs累积,40℃则高聚物TBs形成量最大。
4)相关性分析可以看出,茶黄素含量对外形和汤色色泽属性均呈显著正相关影响,有利于汤色和外形优异品质的形成。茶红素主要对茶样外形色相属性起关键影响,对汤色内质的影响相对较小。TFRB值较TFR值更可有效代表茶黄素和茶红素在叶内的贡献表征。
5)通过线性回归分析获得了以LL值、Lb值和b值为变量的茶黄素回归模型,R2达到0.804,结合TFRB值的回归模型可以看出外形黄度b值是色泽指标中最为关键的,可作为判断发酵适度和评判茶黄素含量的关键因子。
[1]Biswas A K,Sarkar A R,Biswas A K.Biological and chemical factors affecting the valuation of North East Indian plains teas.III.Statistical evaluation of the biochemical constituents and their effects on colour,brightness and strength of black teas[J].Journal of the Science of Food&Agriculture,1973,24(12):1457-1477.
[2]Mcdowell I,Feakes J,Gay C.Phenolic composition of black tea liquors as a means of predicting price and country of origin[J].Journal of the Science of Food&Agriculture,1991,55(4):627-641.
[3]Obanda M,Owuor P O,Mang'Oka R,et al.Changes in thearubigin fractions and theaflavin levels due to variations in processing conditions and their influence on black tea liquor brightness and total colour[J].Food Chemistry,2004,85(2):163-173.
[4]Laddi A,Prakash N R,Sharma S,et al.Significant physical attributes affecting quality of Indian black(CTC)tea[J].Journal of Food Engineering,2012,113(1):69-78.
[5]John K M M,Thiruvengadam M,Enkhtaivan G,et al.Variation in majorphenolic compoundsand quality potential of CTC black tea elicited by saccharomyces cercevisiae, and its correlation with antioxidant potential[J].Industrial Crops&Products,2014,55(6):289-294.
[6]Feng L,Jiang T,Wang Y,et al.Effects of tea polyphenol coating combined with ozone water washing on the storage quality of black sea bream (Sparus macrocephalus)[J].Food Chemistry,2012,135(4):2915-2921.
[7]Pou K R J.Fermentation:The key step in the processing of black tea[J].Journal of Biosystems Engineering,2016,41(2):85-92.
[8]Tan J,Dai W,Lu M,et al.Study of the dynamic changes in the non-volatile chemical constituents of black tea during fermentation processing by a non-targeted metabolomics approach[J].Food Research International,2016,79:106-113.
[9]Samuel K,John W,Thomas K,et al.Determination of residual catechins,polyphenolic contents and antioxidant activities ofdeveloped theaflavin-3,3’-digallate rich black teas[J].Food&Nutrition Sciences,2016,07(3):180-191.
[10]Bhuyan L P,Borah P,Sabhapondit S,et al.Spatial variability of theaflavins and thearubigins fractions and their impact on black tea quality[J].Journal of Food Science&Technology,2015,52(12):7984-7993.
[11]Lee L S,Kim Y C,Park J D,et al.Changes in major polyphenolic compounds oftea (Camelliasinensis)leavesduring the production ofblack tea[J].Food Science&Biotechnology,2016,25(6):1523-1527.
[12]Sabhapondit S,Bhattacharyya P,Bhuyan L P,et al.Optimisation ofwithered leaf moisture during the manufacture of black tea based upon theaflavins fractions[J].International Journal of Food Science&Technology,2014,49(1):205-209.
[13]Asil M H,Rabiei B,Ansari R H.Optimal fermentation time and temperature to improve biochemical composition and sensory characteristics of black tea[J].Australian Journal of Crop Science,2012,6(3):550-558.
[14]Liang Y,Lu J,Zhang L,et al.Estimation of black tea quality by analysis of chemical composition and colour difference of tea infusions[J].Food Chemistry,2003,80(2):283-290.
[15]Ghosh A,Tamuly P,Bhattacharyya N,et al.Estimation oftheaflavin contentin black tea using electronic tongue[J].Journal of Food Engineering,2012,110(1):71-79.
[16]Tao W,Zhou Z,Zhao B,etal. Simultaneous determination of eight catechins and four theaflavins in green,black and oolong tea using new HPLC-MS-MS method[J].JournalofPharmaceutical& Biomedical Analysis,2016,131:140-145.
[17]Obanda M,Owuor P O,Mang'Oka R.Changes in the chemical and sensory quality parameters of black tea due to variations of fermentation time and temperature[J].Food Chemistry,2001,75(4):395-404.
[18]Owuor P O,Obanda M.Comparative responses in plain black tea quality parameters of different tea clones to fermentation temperature and duration[J]. Food Chemistry,2001,72(3):319-327.
[19]Samanta T,CheeniV,Das S,etal.Assessing biochemical changes during standardization of fermentation time and temperature for manufacturing quality black tea[J].Journal of Food Science &Technology,2015,52(4):2387-2393.
[20]Cloughley J B.The effect of fermentation temperature on the quality parameters and price evaluation of Central African black teas[J].Journal of the Science of Food&Agriculture,1980,31(9):911-919.
[21]Bhattacharyya N, Pawan Kapoor D R. Aroma characterization of black tea using electronic nose[C]//.Proceedings of 2004 International Conference O -CHA(tea)Culture and Science,2004:117-120.
[22]Chen Q,Liu A,Zhao J,et al.Classification of tea category using a portable electronic nose based on an odor imaging sensor array[J].Journal of Pharmaceutical&Biomedical Analysis,2013,84(5):77-83.
[23]Sharma P,Ghosh A,Tudu B,et al.Monitoring the fermentation process of black tea using QCM sensor based electronic nose[J]. Sensors & Actuators B Chemical,2015,219:146-157.
[24]Bhattacharya N,Tudu B,Jana A,et al.Preemptive identification of optimum fermentation time for black tea using electronic nose[J]. Sensors & Actuators B Chemical,2008,131(1):110-116.
[25]Ouyang Q,Liu Y,Chen Q,et al.Intelligent evaluation of color sensory quality of black tea by visible-near infrared spectroscopy technology:A comparison of spectra and colordatainformation[J].Spectrochim ActaA Mol Biomol Spectrosc,2017,180:91-96.
[26]Panigrahi N,Bhol C S,Das B S.Rapid assessment of black tea quality using diffuse reflectance spectroscopy[J].Journal of Food Engineering,2016,190:101-108.
[27]Borah S,Bhuyan M.A computer based system for matching colours during the monitoring of tea fermentation[J].International Journal of Food Science and Technology,2005,40(6):675-682.
[28]杨娟,袁林颖,钟应富,等.工夫红茶色泽与品质相关性研究[J].西南农业学报,2014,27(6):2605-2610.Yang Juan,Yuan Linying,Zhong Yingfu,et al.Study on correlations between color and quality of congou made of different varieties of tea[J].Southwest China Journal of Agricultural Sciences,2014,27(6):2605-2610.(in Chinese with English abstract)
[29]成洲,廖茜,姚逸.几种工夫红茶的茶汤色泽与感官品质之间的相关性[J].天津农业科学,2014,20(3):71-75.Cheng Zhou,Liao Qian,Yao Yi.Correlation between tea soup colordifferenceand quality evaluation of the congou black teas[J].Tianjin Agricultural Sciences,2014,20(3):71-75.(in Chinese with English abstract)
[30]王秋萍,龚加顺,邹莎莎.普洱茶发酵阶段色泽的变化及其与品质的关系[J].农业工程学报,2010,26(增刊 1):394-399.Wang Qiuping,Gong Jiashun,Zou Shasha.Relationship between color change and quality of Pu-erh Tea during fermentation[J].Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE),2010,26(Supp.1):394-399.(in Chinese with English abstract)
[31]袁海波,滑金杰,邓余良,等.不同环境湿度条件下萎凋叶色差变化分析[J].茶叶科学,2015,35(6):551-558.Yuan Haibo,Hua Jinjie,Deng Yuliang,et al.Analysis on the changesof colorof withering leafin different environmental humidity conditions[J].Journal of Tea Science,2015,35(6):551-558.(in Chinese with English abstract)
[32]Roberts E A H,Smith R F.Spectrophotometric measurements of theaflavins and thearubigins in black tea liquors in assessments of quality in teas[J].Analyst,1961,86(10):94-98.

