脂肪来源的干细胞移植对大鼠脑缺血组织的治疗效果与机制初探
许秀秀,王杰华,陈淑增,李国前,杨小霞,洪诸权
(1.泉州医学高等专科学校,福建 泉州 362011;2.福建医科大学附属泉州第一医院神经内科,福建 泉州 362000)
脑缺血后的损伤机制复杂多样,大量研究表明干细胞移植对脑缺血损伤可能具有令人鼓舞的治疗效果。脂肪来源的干细胞 (Adipose-derived stem cell,ADSCs ) 不仅可以定向分化为神经组织细胞,而且还能分泌多种神经营养因子。且与其他干细胞相比,ADSCs具有低免疫原性、分离难度低、体外增殖速度快等突出优点。研究表明,ADSC移植对治疗脑梗死有一定修复作用但其作用机制仍不清楚。生长相关蛋白-43(Growth associated protein-43,GAP-43)是一种广泛存在于神经组织的特异性胞膜磷酸蛋白质。研究表明, GAP-43的表达能促进突触的形成、功能的维持及递质的释放,被认为是神经元轴突生长发育的分子标记物,提示神经组织的损伤、修复或者再生[1]。本实验将研究局部注射移植ADSC对大鼠大脑中动脉栓塞模型的治疗作用并探讨其可能机制。现报告如下。
1 资料与方法
1.1实验材料
1.1.1实验动物:选择雄性SD大鼠,其中体重80~100 g的10只,用于获取ADSC;体重250~280 g的36只,用于制作大鼠大脑中动脉栓塞模型。本研究大鼠均购于上海斯莱克实验动物中心,动物合格证编号:SCXK(沪)012-0002。
1.1.2实验试剂:L-DEME培养基来源美国Gibco公司;Percoll 淋巴细胞分离液来源美国Pharmacia公司;0.25%胰酶、胎牛血清(FBS)来源美国Hyclone公司;兔抗大鼠GAP-43一抗来源美国圣克鲁斯生物技术公司;SP二步法免疫组化试剂盒、AEC染色试剂盒来源北京中山生物技术有限公司;β-actin和辣根酶标记IgG来源上海远慕生物科技科技有限公司;Beyo ECL、Western荧光检测试剂来源上海瑞齐实验试剂有限公司。
1.2实验方法
1.2.1大鼠脑缺血模型的制备:将体重为250~280 g的大鼠进行随机分成三组:假手术组、ADSC组和模型组。ADSC组和模型组用改良线栓法制备大鼠大脑中动脉梗死模型[2],造模后进行神经功能评分,得分为1~3分的大鼠方能进行实验[2]。假手术组除了手术过程中不插入线栓外,其他手术步骤与模型组和ADSC组一致。
1.2.2ADSC分离及扩增、移植:将体重为80~100 g的SD大鼠,按课题组前期的实验方法[3]进行ADSC的分离培养与传代,取含1×106个第3代或第4代细胞的细胞悬液30 μl,在脑立体定位仪下对造模成功24 h的ADSC组大鼠经侧脑室注射进行移植。
1.2.3神经功能评定:参照Longa的5分法[2]进行评定,各组大鼠分别在术后第7天和第14天处死前行神经功能评分。0分为无神经功能缺损症状。
1.2.4模型处理和标本取材:分别于造模后第7天、第14天进行模型处理。用10%水合氯醛腹腔麻醉后,迅速暴露心脏,经左心室进行心脏灌注冲洗,取出全脑,于冰盘上迅速分离取出右半球视神经交叉后6~11 mm部分备用。
1.2.5免疫组织化学法检测GAP-43表达:按试剂盒说明的步骤进行检测,大鼠脑组织切片常规脱蜡、水化,孵育、高压修复,加入一抗兔抗大鼠GAP-43抗体(工作浓度约为1∶200),孵育后再加入滴加生物素化小鼠抗兔的二抗,AEC显色,封片。用0.01 mol/L PBS在各步骤间做5 min×3次的冲洗。随机挑选5个视野,在高倍镜下(400倍)进行阳性细胞数目的计数,计数后取其均值作为该组的阳性细胞数。
1.2.6Western blot法检测GAP-43蛋白表达:取脑组织100 mg,按说明书进行蛋白提取,然后测定浓度。取25 μg蛋白进行蛋白变性、垂直电泳,转膜封闭,按步骤加入一抗(兔抗大鼠GAP-43抗体,1∶1 500;兔抗大鼠β-actin抗体,1∶1 000)和二抗(1∶2 000)进行抗原抗体反应,ECL液显色,呈像。测定条带灰度值(Image J图像分析),比较目的蛋白灰度值和内参β-actin灰度值,并将两者比值作为结果进行分析。
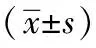
2 结果
2.1神经功能评分:假手术组术后无神经功能缺损症状,而模型组和ADSC组手术后则出现了明显的神经功能缺损,至第14天逐渐减轻。ADSC治疗组与模型组比较,第7天和第14天神经功能评分均较低,差异具有统计学意义(P<0.05)。详见表1。


分组第7天第14天假手术组00模型组3.31±0.722.79±0.72ADSC组2.27±0.58①1.82±0.51①
注:与模型组比较,①P<0.05
2.2免疫组织化学法检测GAP-43结果:如表2、图1所示,假手术组GAP-43阳性细胞较少,模型组和ADSC治疗组GAP-43阳性细胞表达较假手术组增加,ADSC治疗组GAP-43阳性细胞明显高于相应时间点的模型组,差异具有统计学意义(P<0.05)。


分组第7天第14天假手术组7.21±0.786.82±1.03模型组35.69±5.62①26.36±3.57①ADSC组57.06±7.80①②42.78±6.56①②
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05

图1 各组大鼠缺血侧脑组织不同时间点GAP-43阳性细胞的表达(×400):A为假手术组第7天;B为模型组第7天;C为ADSC组第7天;D为假手术组第14天;E为模型组第14天;F为ADSC组第14天

图2 各组大鼠不同时间GAP-43蛋白的表达:1为假手术组;2为模型组;3为ADSC组;A为第7天;B为第14天
2.3Western blot法检测GAP-43结果:如表3、图2所示。假手术组GAP-43蛋白呈低水平表达,模型组和ADSC治疗组GAP-43蛋白表达较假手术组增加,ADSC治疗组GAP-43蛋白明显高于相应时间点的模型组,差异有统计学意义(P<0.05)。


分组第7天第14天假手术组0.16±0.010.18±0.02模型组0.62±0.12①0.27±0.09①ADSC组0.83±0.25①②0.52±0.19①②
注:与假手术组比较,①P<0.05;与模型组比较,②P<0.05
3 讨论
脑细胞的损伤是永久和不可逆的,因而及时进行神经修复尤为重要。但是由于血脑屏障的存在,利用药物来促进神经系统损伤修复的可能性微乎其微。组织工程的飞跃发展为这些传统药物难以治疗的疾病带来福音,干细胞的研究正是其热点领域之一。干细胞的自我更新和多能分化能力对组织的修复有重要意义。脂肪来源的干细胞(ADSC)因其取材方便、来源丰富、较少引起免疫排斥、增殖速度快而受到广大的关注[4-7]。有实验证实了ADSC的分化能力,特别是向神经方向的分化能力。但是ADSC移植对损伤性脑缺血组织的具体机制尚未完全明确。
作为神经生长相关蛋白,GAP-43与轴突的生长密切相关,是轴突生长、发育的关键物质,也是神经损伤修复的标志物,对突触可塑性具有重要意义,是研究突触重塑变化的可靠指标。GAP-43具有一定的亲水性,广泛分布于中枢神经系统中。有研究认为,在发育中神经的分化、突触的再生或神经损伤后的修复等发生时,突触在形态或者结构上出现变化,可能导致GAP-43的高表达。在神经系统中GAP-43的高水平表达对神经元的生长、发育、再生等起到一定的促进作用[4]。故本实验通过检测GAP-43的表达来判断脑缺血大鼠损伤发生及ADSCs移植治疗后神经功能修复的可能性。
实验发现,模型组大鼠大脑中动脉栓塞发生以后,脑梗死部位组织中GAP-43蛋白表达有明显增加,说明机体的脑组织在发生缺血性损伤后有一定的可塑性,这种可塑性与突触的重塑有关,可能是神经系统通过增加GAP-43的表达,从而进行突触重塑,促进脑损伤后神经功能的修复。但是随着缺血时间的延长,模型组GAP-43的表达虽然较假手术组仍有明显升高,还是有表现出明显的下降趋势,神经功能缺损仍然较为明显。且在术后第7天和第14天两个不同的时间点,ADSC治疗组比模型组脑组织中GAP-43蛋白表达增加更为显著,神经功能缺损恢复明显,说明大鼠脑损伤后自身进行的神经功能修复能力有限。而在大鼠发生脑缺血损伤后及时移植ADSC能更快促进神经功能的恢复。笔者推测移植的ADSC能通过增加GAP-43蛋白的表达,重建有利于神经再生的微环境以促进神经轴突的再生,从而促进神经损伤的修复。因此,缺血性脑损伤后,及时进行ADSC的移植对修复损伤性脑缺血组织,恢复神经功能有积极的促进作用。

