过氧乙酸应用增敏动力学光充法与阳离子表面活性剂协同检测的效果
郑颖华
(菏泽市立医院 重症医学科,山东 菏泽 274000)
过氧乙酸又称过醋酸或乙酸,可在室内家具、居室表面、空气中广泛消毒。过氧乙酸的检测方法常见有动力学比色法、碘量法和其他分光光度法等[1]。碘量法操作十分繁琐,终点观察的稳定性较差,5 min内返蓝现象多次出现,影响最终结果[2];探究消毒液检测过氧乙酸的方法有重要价值,故本研究探究予以阳离子表面活性剂及增敏动力学联合检测消毒液中的过氧乙酸,现报道如下。
1 材料与方法
1.1 仪器与试剂
0.1 mg分析天平为北京天平仪器公司提供,可见分光光度计(7230G型)为上海美析科技有限公司提供;按照卫生部《消毒技术规范》(2002)对CH3COOOH标准溶液予以碘量法精确评估,二次稀释浓度为1.50×10-4mol/L;溶解水适宜,110℃下干燥硫酸亚铁至质量稳定,二价铁离子标准容积,加入3 mol/L硫酸至清亮,容积瓶为1 L,表面活性剂为十八烷基三甲基溴化铵、十四烷基溴吡啶(体积均为2 g/L,质量浓度均为56 μg/ml)混合;邻二氮杂菲溶液2 g/L、硫酸溶液、生理盐水均为1 mol/L。
1.2 方法
取50 ml容积的容量瓶2个,分别加入二价铁离子标准溶液(2.5 ml 56 μg/ml)、硫酸溶液(3 ml),待测的过氧乙酸溶液适度加入容积瓶中(阻抑体系标识),充分振荡后将氢氧化钠溶液6 ml加入,混合表面活性剂及邻二氮菲溶液(2 ml),混合充分后10 min静置,醋酸-醋酸钠缓冲液予以稀释至刻度;与不含铁的空白试液进行对比,1 cm比色皿检测510 nm处分光度计的阻抑体系吸光度A、非阻抑体系吸光度A0,且计算△A=A0-A。
2 结果
2.1 吸收光谱
在400~600 nm的波长范畴中,非阻抑体系VCH3COOOH=0.00 ml吸收峰为510 nm,尖锐峰形,峰值高,单一峰数,强吸收出现在2.20×104mol吸光系数,在510 nm处吸光谱未发生变化,阻抑体系为最大吸收值,吸光度值在加入过氧乙酸为阶梯式下降。见图1。

图1 吸收光谱
2.2 实验条件的选择
2.2.1 表面活性剂 阳离子表面活性剂的激活中吸光度升高,TPB-STAB混合体系出现明显优势,当TPB、STAB剂量相同时,吸光度突然升高,在2.20×104mol吸光系数吸收波长max。见图2。
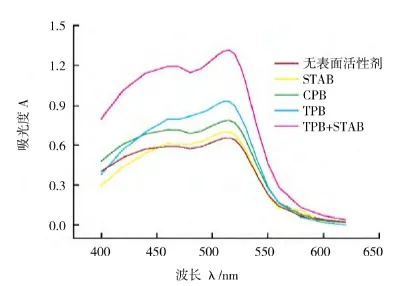
图2 表面活性剂不同剂型中邻二氮菲配合物的吸光谱
2.2.2 硫酸用量 过氧乙酸在酸性条件下有助于抑制水解三价铁离子,硫酸的用量对溶液褪色程度的影响,结果显示,控制硫酸在0~2.0 ml范围内,△A随之增大;△A在2.0~4.0 ml范围内逐渐平稳,大于4.0 ml时则下降,本研究为3.0 ml。
2.2.3 邻二氮菲用量 邻二氮菲含量0.6~2.0 ml,邻二氮菲和△A用量呈正相关,当邻二氮菲用量超过2.0 ml时,△A达到最大值且较平稳,本研究选择2.0 ml。
2.2.4 标准二价铁离子溶液用量 当标准二价铁离子溶液为2.5 ml时,非阻抑吸光度约为1.20,因此标准Fe2+溶液适宜用量为2.5 ml。
2.2.5 稳定性和反应时间 反应时间和吸光度在反应起始时间呈正比例,但其达到最大吸光度值及趋于恒定的时间具有一定的差异;当 PCH3COOOH=0 μg/ml时,非阻抑体系5~8 min(A值)缓慢上升,9 min后逐渐稳定;当PCH3COOOH=1.0 μg/ ml时,阻抑体系 A值在 1~5 min内增高显著,6 min后趋于平稳。在1 h左右A值无显著改变;本研究在10 min显色反应后对吸光度予以检测。
2.3 共存离子的影响
当过氧乙酸浓度为2 μg/ml时,对无机离子和有机化合物体系予以检测,当误差<5%时,MnO2-4、Cr2O2-7浓度相同时产生干扰,10倍的氢氧化氮、Zn2+、Ca2+、Mg2+、葡萄糖、三价铝离子、3 倍的二价铜离子、一价NO离子、碳酸氢离子等检测未发生变化。
2.4 工作曲线
工作曲线予以实验方式制定,移取不同量的过氧乙酸标准液。条件最佳时,△A和0.05~2.00 μg/ ml的过氧乙酸的线性关系较佳,线性回归方程为:△A为1.3234 PCH3COOOH-0.0154,相关系数r =0.9997,按照实验方式对空白平行检测10次,标准偏差s为0.01,按照3 s/k(k为标准曲线回归方程的斜率)计算方法的检出限为0.02 μg/ml。见图 3。

图3 工作曲线
2.5 样品分析
2.5.1 处理试样 取过氧乙酸-1#、过氧乙酸-2#均为5 ml,混合后置存24 h,加入10 ml的H2SO4溶液(2 mol/L),加入高锰酸钾溶液(0.1 mol/L)至出现粉红色溶液,溶液中加水至1 L,稀释液超过10 ml后再加水,最终稀释液为250 ml。
2.5.2 检测含量结果 按实验方式检测且加标回收待测液1 ml;加入、回收量大体相同,样品回收率为97.0%~101.7%,见表1。

表1 样品结果分析(n =6)
3 讨论
本研究于2015年1月‐2016年12月探析菏泽市立医院50 ml消毒液内予以阳离子表面活性剂和增敏动力学光充法检测过氧乙酸,结果 显 示: 在 0.05~1.50 μg/ml范 围 内 检 出 限 为0.02 μg/ml,过氧乙酸及吸光度呈现递减式线性关系;在400~600 nm的波长范畴中,非阻抑体系VCH3COOOH=0.00 ml吸收峰为510 nm,尖锐峰形,峰值高,单一峰数,强吸收出现在2.20×104mol吸光系数,在510 nm处吸光谱未发生变化,阻抑体系为最大吸收值,吸光度值在加入过氧乙酸为阶梯式下降;吸光度在阳离子表面活性剂的激活中升高,TPB-STAB混合体系出现明显优势,当TPB、STAB剂量相同时,吸光度突然升高,在2.20×104mol吸光系数吸收波长max。反应时间和吸光度在反应起始时间呈正比例,但其达到最大吸光度值及趋于恒定的时间具有一定的差异;当PCH3COOOH=0 μg/ml时,非阻抑体系5~8 min(A值)缓慢上升,9 min后逐渐稳定;当PCH3COOOH=1.0 μg/ml时,在1~5 min内阻抑体系A值增高显著,6 min后趋于平稳[3-6]。
试验结果显示,吸收光谱说明Fe2+和过氧乙酸仅出现氧化还原反应,生成物Fe3+未影响Fe2+二的显色反应,在溶剂效应的激活中,460 nm为吸收峰最小值,本吸收峰为Fe2+,检测吸光度(510 nm)无影响。在选择试验条件时,吸光度在予以阳离子表面活性剂发生程度不同的升高,为发生协同增敏机制[7-10]:长链STAB是两性功能化分子,邻二氮菲混合疏水剂,水溶性增强,与Fe2+接触较多,进而形成配位反应,TPB的吡啶基结构,可进行配位[11-13],在STAB的刺激下,TPB、邻二氮菲、二价铁离子反应生成颜色更深的三元络合物,摩尔吸光系数变大,增强光吸收度[14-16];TPB-STAB体系显著提高配合物的光敏感度,达到助溶、催化、增敏的功能[17]。其他试验显示,CTMAB等阳离子表面活性剂的催化反应的增敏功能强大,检出限为7.5 ng/ml,相对标准偏差为4×10-3%,与本研究结果相符[18]。试验显示,在体积50 ml内有混合表面活性剂2 ml时,吸光度出现峰值且较平稳。酸性环境中,过氧乙酸对三价铁离子的水解进行抑制,应用2.0~4.0 ml硫酸时,△A逐渐平稳,本研究选择3.0 ml;在反应的初始阶段吸光度随着反应时间的增加而增大,但其达到最大吸光度值及趋于恒定的时间不等;当PCH3COOOH=0 μg/ml时,非阻抑体系5~8 min(A值)缓慢上升,9 min后逐渐稳定;当PCH3COOOH=1.0 μg/ml时,在1~5 min内阻抑体系A值增高显著,6 min后趋于平稳。按实验方式检测且加标回收1 ml待测液,加入、回收量大体相同,样品回收率为97.0%~101.7%。综上所述,铁(II)-邻二氮杂菲分光光度法检测过氧乙酸效果确切。

