胶州湾典型河口湿地土壤活性有机碳和酶活性对互花米草入侵的响应
张晗冰,孔范龙,郗 敏,李 悦,孙小琳
青岛大学环境科学与工程学院,青岛 266071
土壤活性有机碳(LOC)是土壤中活跃的化学组分,不仅对土壤碳库周转变化响应敏感,而且直接参与土壤中生物化学转换过程,其分解、矿化过程直接影响微生物和酶的活性[1- 3],近年来已成为土壤、环境、生态学领域关注的焦点和研究的热点。土壤酶参与了土壤LOC的分解和转化过程,是土壤生物过程的主要调节者,酶活性的高低直接影响碳循环速率[4- 5]。因此,了解土壤LOC和酶活性有助于完善影响土壤碳循环的作用机制。
滨海湿地作为陆地和水域生态系统的过渡带,尽管其占全球陆地总面积比例很小,但其碳固定量是生态系统中最高的,在碳循环中起着重要的作用[6- 8]。已有研究证明,滨海湿地中外来物种的入侵会导致土壤碳循环发生改变[9],作为典型入侵物种的互花米草(Spartinaalterniflora)对我国海岸带生态环境及碳循环造成了重大影响而受到广泛关注[10]。目前关于互花米草入侵对土壤碳和微生物的研究已有大量文献报道,研究主要关注了互花米草对土壤总有机碳及其组分[9,11- 18]、微生物群落种类[19- 20]的影响。对于互花米草入侵对湿地土壤LOC和酶活性的影响也开展了一些研究,主要集中在长江口、闽江河口、杭州湾[15,21- 24]等区域,研究中以空间尺度分析为主,内容上重点关注了土壤LOC和酶活性的垂直分布特征[22]及其影响因素[23- 24]。由于互花米草具备高生物量和生产力的特征,随着入侵时间的增加,其对LOC和酶活性的影响程度会有明显不同,而当前从入侵时间这一角度上开展LOC和酶活性对互花米草入侵响应的研究工作尚未见报道。
本文选取胶州湾洋河口湿地内的互花米草入侵区为研究区域,从时间和空间综合尺度上系统开展土壤LOC和土壤酶(土壤碱性磷酸酶、脲酶、蔗糖酶、过氧化氢酶)活性对互花米草入侵的响应研究,旨在进一步研究互花米草入侵年限对湿地土壤活性有机碳和土壤酶活性的影响,为正确评价生物入侵对河口湿地生态系统的影响提供基础数据,同时为相关部门有效管理外来生物入侵提供科学依据。
1 研究样区与实验方法
1.1 研究区域概况
胶州湾湿地(36°03′—36°22′N,120°06′—120°19′E)是山东半岛面积最大的河口海湾型湿地,已被列入《国家重要湿地名录》。该区域湿地总面积约17.76×104hm2。据青岛市百年气象资料统计,胶州湾湿地年平均降雨量为900 mm,年均温度12℃,无霜期220 d左右,属于温带季风气候,受海洋季风调节,冬季寒冷干燥、夏季高温多雨,雨热同季,四季分明[25- 26]。本文研究区域设在洋河口,洋河为一条独立入海的天然河道,古称“洋水”。主源位于胶南市(现黄岛区)吕家一带,自西向东,流经胶州市的张应、洋河、九龙、营海四镇,于营房镇村王家滩村东注入胶州湾。河道全长31 km,流域面积303 km2,河口宽85 m。据大村水文站观测,洋河多年平均径流量6100万m3,最大洪峰流量达608 m3/s[27]。自1963年从国外引进互花米草以来,洋河口湿地逐渐形成典型的互花米草草滩。
1.2 样品采集与分析
利用GPS精确定位和现场测量的方法于2016年11月在洋河口潮滩湿地选取互花米草入侵不同年限下的样地进行采样,根据入侵时间分为3个样地:2016年互花米草入侵处、2012年互花米草入侵处、2009年互花米草入侵处,入侵时间分别为1、5、8年,分别用SAF-1、SAF-5、SAF-8表示。同时选择了相邻的未被互花米草入侵的光滩湿地作为对照样地,用MF表示(图1)。在上述4个样地分别用对角线法选择3个植被盖度较为一致的1 m×1 m的样方进行土壤样品的采集,共布设12个采样点。每个样方采用剖面挖掘法采集0—10、10—20、20—40、40—60 cm土层土样(待样品风干后,将样方同一层土样混合代表该样点对应土层样品),同时用环刀法取土样,测定不同层次土壤容重,取土后迅速将土壤装入密封袋中带回实验室,在自然条件下风干,剔除可见的动植物残体等,磨细过100目筛储存备用,土壤基本情况见表1

图1 胶州湾河口湿地采样区域分布Fig.1 Location of sampling area in the estuary wetland of Jiaozhou BayMF:光滩湿地 Mudflat;SAF-1:互花米草入侵1年湿地 S.alterniflora flat of about 1 years;SAF-5:互花米草入侵5年湿地 S.alterniflora flat of about 5 years;SAF-8:互花米草入侵8年湿地S.alterniflora flat of about 8 years

入侵时间Invasion time/ a样地编号Plot number植被覆盖度Vegetation fractional cover/%植被类型Vegetation form有机碳Organic carbon/(g/kg)总氮Total nitrogen/(g/kg)总磷Total phosphorus/ (g/kg)pH容重Volume weight/(g/cm3)含水率Water content/%0MF0裸滩6.25±1.8232.22±2.910.33±0.028.06±0.281.48±0.1034±2.381SAF-112.27互花米草6.76±0.8132.93±5.850.28±0.017.55±0.31.47±0.0730±3.065SAF-559.43互花米草7.59±0.3231.44±0.890.64±0.077.38±0.390.72±0.0697.00±2.878SAF-871.27互花米草9.13±2.7432.5±4.410.48±0.077.23±0.350.91±0.2179±8.55
MF:光滩湿地 Mudflat;SAF-1:互花米草入侵1年湿地S.alternifloraflat of about 1 years;SAF-5:互花米草入侵5年湿地S.alternifloraflat of about 5 years;SAF-8:互花米草入侵8年湿地S.alternifloraflat of about 8 years
1.3 研究方法
土壤活性有机碳的测定采用高锰酸钾氧化法[28];土壤脲酶活性采用靛酚蓝比色法;土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法;过氧化氢酶活性采用高锰酸钾滴定法[29];碱性磷酸酶活性采用磷酸苯二钠比色法确定[30]。土壤有机碳、总氮、总磷、pH分别用高锰酸钾外加热法、半微量开式法、钼锑抗比色法、电位法测定[31]。
1.4 实验数据统计
使用软件Excel 2007对实验数据进行初步整理,采用SPSS 20.0对整理的数据进行相关性分析,并采用Origin 7.0、CorelDRAW X7软件进行绘图。
2 结果与讨论
2.1 土壤活性有机碳含量对互花米草入侵的响应
2.1.1 土壤活性有机碳垂直分布特征
由土壤活性有机碳(LOC)含量垂直分布特征(图2)可见,互花米草入侵后,样地表层土壤LOC含量与光滩相比明显上升(P<0.05),且随着入侵时间延长而逐渐增加,该研究结果与王刚等人[15]报道的互花米草可有效提高表土LOC含量的研究结果一致。互花米草入侵改变了LOC含量垂直分布规律,SAF-1样地LOC含量与光滩垂直分布规律一致,均表现为沿剖面逐渐上升。SAF-5、SAF-8样地LOC含量均表现为沿剖面向下先增后减的趋势,这2种样地LOC含量垂直变化范围分别为5.7—8.1、7.3—8.0 mg/g,SAF-5样地含量最高土层为10—20 cm,而SAF-8样地LOC含量最高为20—40 cm(表2)。采用 Duncan方法对不同土层的LOC含量进行多重分析,结果显示4种样地各土层间LOC含量具有差异性,MF和SAF-1样地0—20 cm土层LOC含量差异显著(P<0.05),SAF-5样地表层土壤差异显著(P<0.05),而SAF-8样地土层LOC含量差异不明显。另外,4种样地0—60 cm不同土层LOC变异系数在0.4%—8%(图3)。根据雷志栋等[32]通过变异系数(CV)对土壤空间变异性进行划分:CV<10%为弱变异性,10%—100%为中等变异性,CV>100%为强变异性。据此说明,胶州湾河口湿地土壤活性有机碳含量变化属于弱变异。

图2 4种样地土壤活性有机碳垂直分布特征Fig.2 Vertical dynamics of soil labile organic carbon (LOC) in 4 types of sample plots

样地Plot最大值Maximum/ (mg/g)最小值Minimum/ (mg/g)均值Mean/ (mg/g)中值Median/ (mg/g)标准误差SD变异系数CV/%变幅RangeMF4.360.692.893.251.65557.265.31SAF-14.512.473.733.980.90624.290.83SAF-58.735.77.658.451.33717.480.53SAF-88.387.368.008.300.44856.030.14
土壤LOC垂直分布规律主要与互花米草枯落物和根系分布有关[33- 35]。首先,互花米草入侵后,枯落物以及根系分泌物的增加导致土壤表层有机碳来源增加,使LOC含量提高[36],并且随着入侵时间延长土壤表层LOC表现为累积效应;其次,互花米草入侵初期,其根系主要集中在表层,随着互花米草入侵时间的延长,其根系逐渐向下延伸,改变了不同深度土壤的通透性并促进了微生物活性[18],从而改变了LOC含量垂直分布规律。根据研究结果显示(图2),SAF-1样地根系作用影响较弱,影响范围也局限于表层,并未改变分布规律,因此光滩和SAF-1样地10—20 cm土层LOC含量差异显著(P<0.05)。随着入侵年限的增加,其根系逐渐向下延伸,根系影响作用增强,影响范围增大,导致SAF-5样地含量最高土层为10—20 cm,仅表层土壤LOC含量差异性显著(P<0.05)。另外,互花米草根系使得土壤通透性提高而有利于地表大量枯枝落叶经过腐殖化及淋溶过程由表层向深层机械迁移,逐年累积形成稳定的碳源[37- 38],因此SAF-8样地深层土壤LOC含量较高且各层之间差异性不显著(P>0.05)。
2.1.2 土壤活性有机碳含量对互花米草入侵年限的响应
由图4可以看出LOC含量随着互花米草入侵时间的延长而增加,具体表现为SAF-8>SAF-5>SAF-1>MF,SAF-5和SAF-8含量显著增加。图5表明了随着互花米草入侵时间增加,活性有机碳(LOC)与有机碳(SOC)比例逐渐减小,相关性分析表明LOC与SOC含量间呈正相关关系。

图3 土壤活性有机碳剖面各层变异系数Fig.3 The coefficient of variation in each layer of soil labile organic carbon

图4 互花米草入侵不同阶段土壤活性有机碳的含量变化Fig.4 The content variation of soil labile organic carbon (LOC) after S. alterniflora invasion

图5 土壤活性有机碳与有机碳的关系Fig.5 The relationship of soil labile organic carbon (LOC) and soil organic carbon (SOC)a:不同湿地土壤活性有机碳与有机碳比例的变化 Variation of the ratio of LOC to SOC in different wetlands;b:土壤活性有机碳与有机碳关系Relationship between LOC and SOC
互花米草入侵改变了土壤理化性质进而影响土壤微生物的活性,引起土壤各组分一系列的连锁变化[22]。首先,随着互花米草入侵年限增长,土壤细颗粒组分变大,使得腐殖化产物和根系分泌物增加[9]。同时,互花米草入侵后受根系的影响土壤比较疏松,通透性好,有利于微生物呼吸和土壤CO2的释放,这两个原因导致LOC含量不断增加。其次,SAF-1样地中互花米草对环境条件影响小,入侵5年后样地中互花米草进一步扩张发育,滩面高程增加,环境条件变化显著,因此SAF-5和SAF-8样地土壤LOC含量明显增加。LOC与SOC呈正相关关系说明土壤活性有机碳量可能会影响有机碳量[39- 40]。LOC/SOC随入侵年限增加逐渐降低,这说明虽然入侵后LOC含量显著提高,但是降低了土壤SOC中的活性组分比例,这与张耀鸿[40]等研究结果一致。另外,土壤活性有机碳与有机碳的比例(LOC/SOC)可以度量土壤有机碳的质量和稳定程度,该比例小则表示土壤有机碳较稳定[41],说明互花米草入侵促进了土壤碳库的稳定,也就是说互花米草湿地更有利于土壤有机碳的储存和固定。
2.2 土壤酶活性对互花米草入侵的响应
2.2.1 土壤酶活性垂直分布特征
由土壤不同酶活性垂直分布特征(图6)可见,与光滩相比,互花米草入侵后4种样地土壤酶活性显著提高(P<0.05),这与孙炳寅等[42]报道互花米草湿地土壤中酶(脲酶、过氧化氢酶)活性高于光滩的研究结果一致。但互花米草入侵并未改变酶活性沿剖面向下逐渐降低的垂直分布规律,不同样地中4种酶活性峰值均出现在0—10 cm范围内,这与杨文英等[21]对互花米草群落酶活性垂直分布特征的研究结果一致。研究区各样地中蔗糖酶和过氧化氢酶活性整体表现均为SAF-1样地较高,垂直变化范围分别为9—36.4 mg/g和0.02—0.026 mg KMnO4·g-1·min-1,脲酶和碱性磷酸酶活性最高出现在SAF-8样地中,垂直变化范围分别为6.33—10.23 mg/g和4.28—5.52 mg/g。采用Duncan方法对4种酶不同土层、不同样地进行多重分析,结果显示4种酶同一土层不同样地间酶活性差异显著(P<0.05),同时在同一样地不同土层酶活性也有差异,表现为SAF-1样地中蔗糖酶随土壤深度增加变化显著(P<0.05);SAF-5样地4种酶均随土壤深度变化显著(P<0.05);SAF-8样地中除过氧化氢酶外,其余3种酶土壤表层酶活性变化显著(P<0.05),深层土壤酶活性趋于稳定。
土壤酶是具有蛋白质性质的高分子生物催化剂,参与土壤中腐殖质的合成与分解、有机物和动植物及微生物残体的水解与转化,促进土壤中各种有机、无机物质转化与能量交换[43]。与光滩相比,互花米草所在的土壤中由于其高生物量和高生产力而具有丰富的碳源种类[33],随着入侵时间的延长,微生物功能群种类增加,酶活性也随之升高,这就使得不同样地酶活性差异显著(P<0.05)。但是随着土壤剖面的加深,氧气逐渐减少,抑制了微生物活性从而表现出酶活性随土壤深度逐渐降低的趋势。研究表明蔗糖酶和过氧化氢酶活性分别与土壤微生物数量、土壤呼吸强度和土壤pH有直接依赖性[29,44],SAF-1样地中新生植物根系生长旺盛,良好的土壤通透性使得酶活性较高,随着入侵时间增加,植物根系促使泥沙淤积并提高了土壤蓄水能力,降低了土壤呼吸强度,同时长时间入侵降低了土壤pH[45],pH值超过酶最适范围导致酶活性下降,这就是蔗糖酶和过氧化氢酶活性最高出现在SAF-1样地的原因。土壤脲酶和碱性磷酸酶与土壤有机质(有机碳)显著相关[46],互花米草入侵后土壤中积累了较多的植物残体和腐殖质,有机质含量丰富使得微生物生长旺盛,微生物数量增大导致酶活性上升,随着入侵时间增加,植物生长代谢稳定并通过枯枝落叶向土壤中输送养分,在一定程度上可促进酶活性,因此土壤脲酶和碱性磷酸酶活性在SAF-8样地中最高。至于不同土层同一样地中酶活性差异的显著性,主要与酶所属的环境有关,各土层中微生物种类、数量均有所差异,导致酶活性随土壤深度差异性显著,而互花米草长时间入侵,土壤各层均存在大量动植物残体分解产生的过氧化氢,因此各层过氧化氢酶活性差异性不显著(P>0.05)。
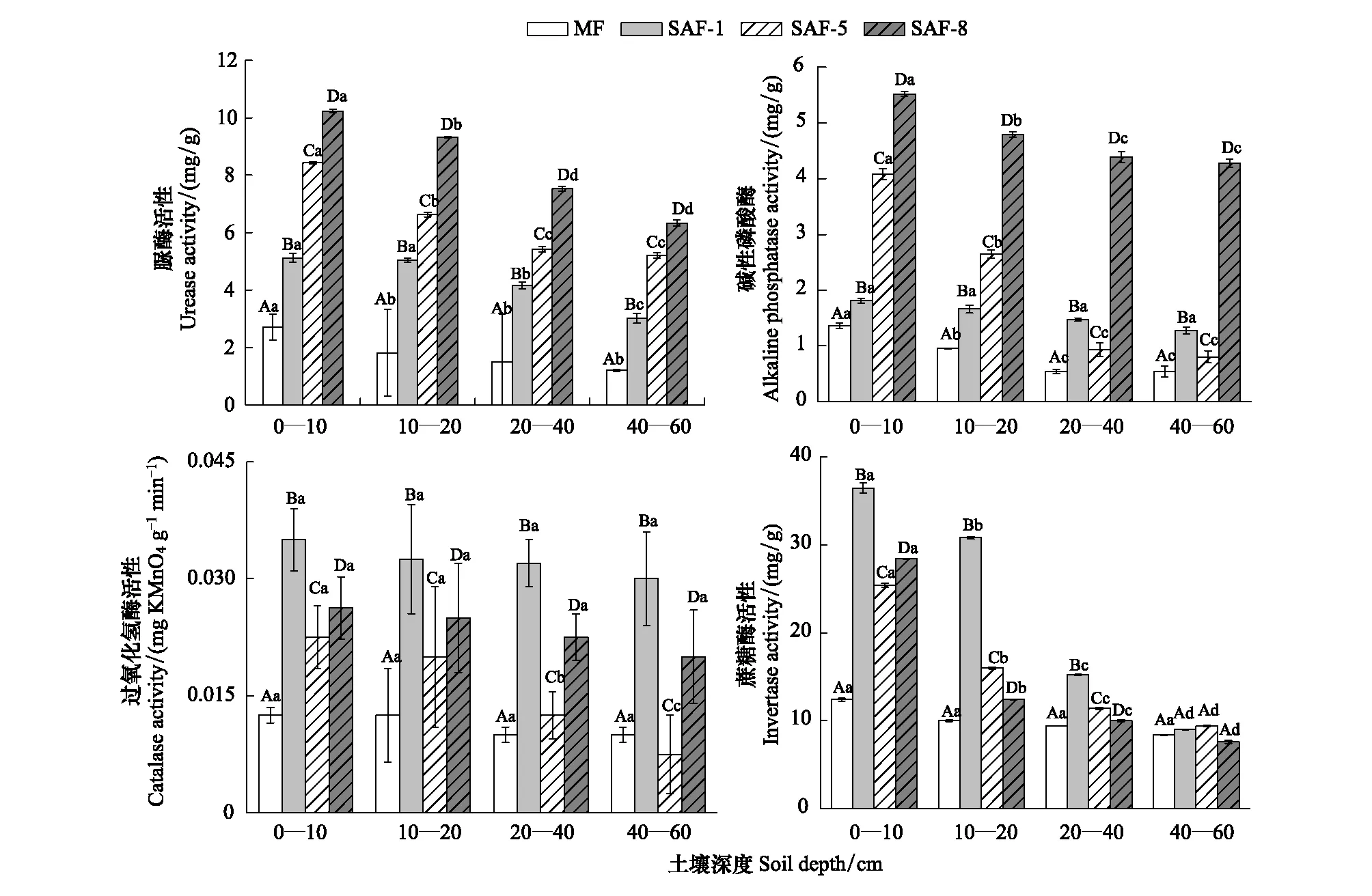
图6 不同酶活性的垂直分布特征Fig.6 Vertical dynamics of variation enzyme activities不同大写字母表示同一土层不同样点间差异显著,不同小写字母表示同一样点不同土层间差异显著(单因素方差分析,Duncan多重比较,P<0.05)

图7 互花米草入侵不同阶段土壤酶活性的变化 Fig.7 The variation of soil enzyme activity after S. alterniflora invasion
2.2.2 土壤酶活性对互花米草入侵年限的响应
由图7可以看出,土壤酶活性在时间上受互花米草植被入侵变化明显,过氧化氢酶和蔗糖酶活性随着入侵时间的增长呈现先急剧增加后逐渐减少的趋势,其值分别为0.01—0.03 mg KMnO4g-1min-1、9.4—28.5 mg/g,而碱性磷酸酶和脲酶活性随着入侵时间的延长逐渐增加,增长速率缓慢,其值分别为0.84—2.78、1.8—6.92 mg/g,此研究结果表明随着互花米草入侵时间延长4种酶活性发生变化。
土壤酶主要来源于土壤微生物的活动、植物根系分泌物和动植物残体腐解过程中释放的酶[47],土壤中广泛存在的酶类是氧化还原酶类(过氧化氢酶)和水解酶类(蔗糖酶、脲酶、碱性磷酸酶),其对土壤肥力起重要作用。首先,过氧化氢酶和蔗糖酶在生物呼吸、代谢过程以及土壤动植物根系分泌、残体分解中起重要作用[48]。互花米草植被发育过程中不断将碳氮等营养元素送入土壤,养分逐渐积累,酶活性也不断增大,但是随着入侵时间增加,互花米草根系发达,密度增加,滞水能力增强,而淹水条件抑制了微生物活性[49],同时也改变了酶反应过程中土壤酶的电子受体从而影响湿地土壤或沉积物中土壤酶的活性[50],导致蔗糖酶和过氧化氢酶活性降低,因而蔗糖酶和过氧化氢酶活性呈现随入侵时间先增加后降低的趋势;其次,研究表明,土壤脲酶和碱性磷酸酶与土壤碳氮含量、微生物总生物量显著相关[51],互花米草入侵初期对土壤酶刺激显著,在根系泌氧及根系分泌物的作用下微生物大量繁殖,随着互花米草入侵时间增加,土壤中酶活性上升,微生物群落种类增加,这就是脲酶和碱性磷酸酶活性随时间逐渐增加的原因。
2.3 土壤活性有机碳和酶活性相关性随互花米草入侵时间的变化
通过Pearson相关性分析(表3)可以看出,随着互花米草入侵时间的增长,LOC和土壤酶活性的相关性发生了改变:互花米草入侵前的光滩湿地中土壤LOC和土壤蔗糖酶活性呈显著负相关(P<0.01),相关系数高达0.991;SAF-1样地中土壤LOC和脲酶、碱性磷酸酶均显著负相关,相关系数分别为0.995和0.83;SAF-5样地中土壤LOC和土壤脲酶活性呈显著负相关,相关系数0.721低于SAF-1湿地相关系数;SAF-8样地中土壤LOC和4种酶活性无显著相关性,说明随着互花米草入侵时间延长,土壤LOC与酶活性相关性发生改变。
酶是湿地土壤的重要组分,参与湿地营养物质循环转化过程,而引起湿地土壤有机碳库的最初变化主要是活性有机碳部分[45],因此酶活性的变化在一定程度上影响土壤活性有机碳库的循环转化过程。同时,相关研究表明,土壤LOC和酶活性关系密切[6- 7]。首先,互花米草入侵后其植物残体经过微生物分解成尿素进入土壤,而脲酶以尿素为底物,通过为硝化微生物提供养料来改变氮循环,土壤氮含量增加又反过来促进互花米草的生长和生物量分配,研究表明植物生物量会显著影响土壤有机碳组成含量[14],因此互花米草入侵后LOC与脲酶呈显著相关。同时,互花米草根系分泌的酸性物质改变了土壤酸碱性,使得LOC与碱性磷酸酶显著相关;另外,互花米草入侵初期以土壤养分为主,造成土壤群落组成发生改变,从而造成LOC和酶活性相关性改变,长时间入侵互花米草对土壤环境作用复杂,水淹条件、土壤酸碱度还有植被本身的影响可能导致LOC和酶活性无相关性,由此可见不同酶在各个入侵阶段受环境影响程度不同,对湿地土壤有机碳库的贡献也不同。

表3 不同样地土壤活性有机碳与酶活性的相关性分析
** 在0.01水平(双侧)上显著相关;* 在0.05水平(双侧)上显著相关
3 结论
洋河口湿地互花米草不同入侵年限对土壤LOC含量的影响程度具有差异性。MF、SAF-1、SAF-5、SAF-8样地LOC含量平均值分别为2.89、3.73、7.64、8.0 mg/g。垂直方向上,互花米草入侵后土壤LOC含量明显(P<0.05)上升,且其改变了LOC垂直分布特征规律,除MF和SAF-1样地表现出沿剖面逐渐上升之外,其他样地表现为沿剖面先上升后下降的趋势;时间上,随着互花米草入侵时间的延长LOC含量逐渐增加,SAF-5和SAF-8样地中增加显著。另外,相关性分析表明LOC与SOC含量间呈正相关关系,LOC与SOC比例逐渐减小。互花米草入侵后增加了土壤碳源输入以及植被的根系分布是LOC变化的主要原因。
土壤酶活性对入侵物种互花米草响应敏感。垂直方向上,互花米草入侵后4种样地土壤酶活性显著(P<0.05)提高,但其并未改变酶活性沿剖面向下逐渐降低的垂直分布规律,不同样地中4种酶活性峰值均出现在0—10 cm范围内;时间上,随着互花米草入侵时间的延长,4种酶活性发生变化且趋势不同,过氧化氢酶和蔗糖酶活性随着入侵时间的增长呈现先急剧增加后逐渐减少的趋势,而碱性磷酸酶和脲酶活性随着入侵时间的延长逐渐增加,趋势变化小。土壤中碳氮磷等营养元素和微生物功能种类群的变化是酶活性变化的主要原因。
酶活性的变化在一定程度上影响土壤活性有机碳库的循环转化过程。利用Pearson相关性分析表明随着互花米草入侵时间延长,LOC和土壤酶活性的相关性发生了改变,MF、SAF-1、SAF-5样地中土壤LOC分别与蔗糖酶、脲酶和碱性磷酸酶、脲酶呈负相关,相关系数逐渐降低,直至SAF-8样地中无显著相关性。这主要是水淹条件、土壤性质、植物根系等综合作用的结果。

