3 种有机酸在不同pH值条件下酸沉处理对米糠蛋白结构的影响
吴 伟,吴晓娟*,杨滔滔
米糠是糙米加工成精米过程中碾下的种皮层、外胚乳层、糊粉层、胚芽和少量碎米的混合物。我国是稻谷生产大国,米糠年产量近1 400万 t[1]。米糠营养丰富,含有14%~24%脂肪、12%~16%蛋白质、23%~30%膳食纤维和多种生理活性物质,极具开发利用价值[2]。在食品工业中,米糠主要用于提取米糠油和米糠蛋白[3]。米糠蛋白氨基酸种类齐全,组成平衡,接近氨基酸理想构成模式,还具有消化性能好、抗过敏性的特点,可作为婴幼儿食品的蛋白原料,是一种高附加值的植物蛋白资源[4]。
近年来,由于我国农业环境中镉污染现象突出,稻谷制品镉含量超标情况比较严重。在稻谷籽粒中,镉主要分布在蛋白含量高的米糠层,米糠平均镉含量约为稻谷的2 倍,由此可见,米糠蛋白在开发利用之前需进行除镉处理[5]。一些天然的有机酸,如:酒石酸、苹果酸、柠檬酸等,能与金属离子形成可溶性络合物,常作为除镉剂使用[6]。杨滔滔等[7]将传统“碱溶酸沉”提取米糠蛋白生产工艺的盐酸替换为有机酸,在不同pH值条件下酸沉制备米糠蛋白,发现酒石酸、苹果酸、柠檬酸具有很好的除镉效果,但会引起米糠蛋白功能性质的改变。蛋白质的功能特性与其结构特征密切相关[8],功能性质的改变必然是由结构特征的变化引起的[9-10]。目前鲜见关于有机酸酸沉对蛋白质结构特征影响的研究报道。本实验选用酒石酸、苹果酸、柠檬酸分别在不同pH值条件下酸沉制备米糠蛋白,以盐酸为对照,研究有机酸酸沉对米糠蛋白结构特征的影响,以期为开发有机酸除镉技术和提高米糠蛋白附加值提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
脱脂米糠 湖南金霞九鼎农牧有限公司;5,5’-二硫代二硝基苯甲酸(5,5’-dithiobis(2-nitrobenzoic acid),DNTB)、1-苯氨基萘-8-磺酸 美国Sigma-Aldrich公司;盐酸、酒石酸、柠檬酸、苹果酸、三羟甲基氨基甲烷、三氯乙酸、2,4-二硝基苯肼、丙烯酰胺、N,N-亚甲基双丙烯酰胺、β-巯基乙醇、十二烷基硫酸钠 国药集团化学试剂有限公司;所有试剂均为分析纯。
1.2 仪器与设备
F7000荧光分光光度计 日本日立公司;IRTracer-100傅里叶红外光谱仪、LC-20A高效液相色谱仪日本岛津公司;Nano ZS纳米粒度分析仪 英国Malvern公司;Healthcare SE260电泳仪 美国GE公司。
1.3 方法
1.3.1 米糠蛋白的制备
参考杨滔滔等[7]酸沉处理的方法制备米糠蛋白,脱脂米糠粉碎过60 目筛备用,取100 g脱脂米糠与900 mL去离子水混合,40 ℃条件下磁力搅拌4 h,并用2 mol/L氢氧化钠溶液调pH值至9.0,之后在4 ℃条件下8 000 r/min离心20 min,取上清液酸沉,所用酸分别为盐酸、酒石酸、苹果酸、柠檬酸,pH值分别为2.0、3.0、3.5、4.0,常温静置2 h后于4 ℃条件下8 000 r/min离心15 min,取沉淀水洗3 次,分散于去离子水中并调pH值至7.0,随后透析72 h去除碱溶酸沉过程中形成的盐类物质,-20 ℃冷冻24 h以上,冷冻干燥得到米糠蛋白。
1.3.2 米糠蛋白游离巯基、总巯基含量的测定
参考Huang Youru等[11]方法。称取120 mg米糠蛋白,分散于20 mL 0.1 mol/L含有l mmol/L乙二胺四乙酸和1%十二烷基硫酸钠pH 8.0的磷酸盐缓冲液,常温条件下磁力搅拌2 h后10 000 r/min离心10 min,采取考马斯亮蓝G-250法测定上清液中蛋白质的质量浓度,采取DNTB比色法在412 nm波长处测定吸光度,以13 600 mol/(L·cm)消光系数计算米糠蛋白游离巯基和总巯基含量。
1.3.3 米糠蛋白傅里叶红外光谱的测定
取2 mg米糠蛋白样品和200 mg干燥的溴化钾混合,研磨混匀后制成透明薄片,室温干燥环境中进行傅里叶红外扫描。扫描条件:扫描范围400~4 000 cm-1,分辨率4 cm-1,样品扫描128 次。
1.3.4 米糠蛋白粒径的测定
将米糠蛋白溶解于0.01 mol/L pH 7.0磷酸盐缓冲液中,磁力搅拌2 h后室温10 000 r/min离心20 min收集上清液并稀释,取上清液1 mL,采用Nano ZS纳米粒度分析仪测定米糠蛋白粒径分布。
1.3.5 米糠蛋白内源荧光光谱的测定
参考Liu Yan等[12]方法。将米糠蛋白溶解于pH 7.0的0.01 mol/L磷酸盐缓冲液中,室温条件下磁力搅拌2 h后10 000 r/min离心20 min,收集上清液。以考马斯亮蓝G-250法测定上清液中蛋白质的质量浓度,通过稀释使蛋白质的质量浓度达到0.1 mg/mL。采用F-4600型荧光光谱仪在激发波长280 nm条件下扫描300~500 nm之间的发射光谱,以pH 7.0、0.01 mol/L的磷酸盐缓冲液为空白。
1.3.6 米糠蛋白表面疏水性的测定
采用荧光探针法[13]测定表面疏水性。以1-苯氨基萘-8-磺酸为外源荧光探针,测定不同质量浓度的米糠蛋白在370 nm激发波长和490 nm发射波长条件下的荧光强度。以荧光强度对蛋白质质量浓度作图,曲线斜率即为蛋白质表面疏水性指数。
1.3.7 凝胶色谱测定米糠蛋白的分子质量分布
参考Fang Yanqing等[14]方法。将米糠蛋白分散于0.05 mol/L含有0.05 mol/L氯化钠pH 7.2的磷酸盐缓冲液中,配制成质量浓度为10 mg/mL的蛋白溶液,室温条件下磁力搅拌2 h后10 000 r/min离心30 min,取上清液用孔径0.45 μm的醋酸纤维素膜过滤,收集滤液,采用LC-20A高效液相色谱系统进行分析。色谱条件:TSKgel SW G4000 SWXL凝胶色谱柱(7.8 mm×300 mm,8 µm);检测器为Waters 996光电二极管阵列检测器;流动相为0.05 mol/L含0.05 mol/L氯化钠pH 7.2的磷酸盐缓冲液;紫外检测波长280 nm;流速1 mL/min;柱温25 ℃。
1.3.8 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
参考Wu Wei等[15]的不连续电泳方法。分离胶用量12.5%,浓缩胶用量4%,pH 8.3的电极缓冲液含0.1%十二烷基硫酸钠、0.05 mol/L三羟甲基氨基甲烷、0.384 mol/L甘氨酸,用样品溶解液(内含5% β-巯基乙醇、2%十二烷基硫酸钠、0.02%溴酚蓝、10%甘油、0.01 mol/L pH 8.0的三羟甲基氨基甲烷-盐酸缓冲液)配制蛋白质量浓度为2.0 mg/mL的样品。电泳采用0.75 mm的凝胶板;上样量为12 μL;样品在浓缩胶时电流为10 mA,待样品进入分离胶后电流升至25 mA,采用考马斯亮蓝R-250染色。
1.4 数据处理与统计分析
所有实验平行测定3 次。数据采用Microsoft Excel 2003和Origin 7.5进行处理,结果以 ±s表示。差异分析采用最小显著差异法,取95%置信度(P<0.05)。
2 结果与分析
2.1 酸沉处理对米糠蛋白巯基含量的影响
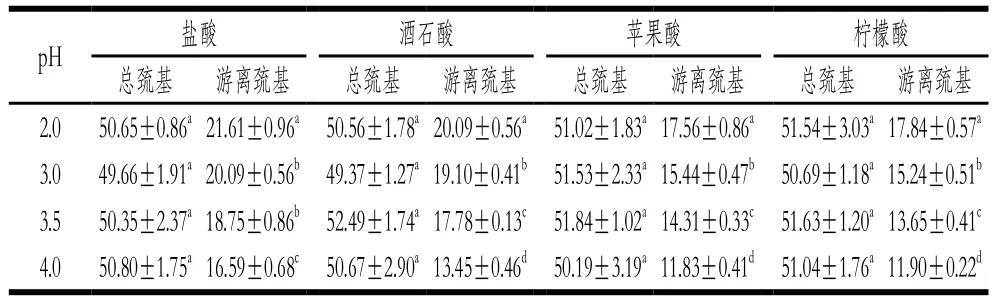
表1 不同有机酸酸沉对米糠蛋白总巯基、游离巯基含量的影响Table 1 Effect of acid precipitation with different organic acids on the contents of total sulphydryl and free sulphydryl of rice bran protein nmol/mg
如表1所示,采用同种有机酸在不同pH值条件下酸沉时,随着酸沉pH值下降,米糠蛋白的游离巯基含量逐渐上升,总巯基含量无显著变化。游离巯基的增加一方面可能是因为蛋白质结构展开导致内部巯基暴露,另一方面可能是二硫键断裂生成新巯基,但新巯基生成必然导致总巯基含量增加[16-17],表1中米糠蛋白总巯基含量无显著变化,从侧面说明酸沉pH值下降没有造成米糠蛋白二硫键的断裂,而是米糠蛋白结构逐渐展开,导致巯基暴露程度不断增加。Liu Qian等[18]在研究pH值偏移处理对大豆分离蛋白结构的影响时发现,酸处理(pH 1.5,3 h)后大豆分离蛋白的总巯基含量无显著变化,而游离巯基含量增加,并提出二硫键在酸性环境中较稳定,不易断裂。相比于盐酸,采用有机酸在相同pH值条件下酸沉制备的米糠蛋白游离巯基含量显著减小,这可能是因为3 种有机酸的酸性较弱,对米糠蛋白结构的影响较小。
2.2 酸沉处理对米糠蛋白二级结构的影响
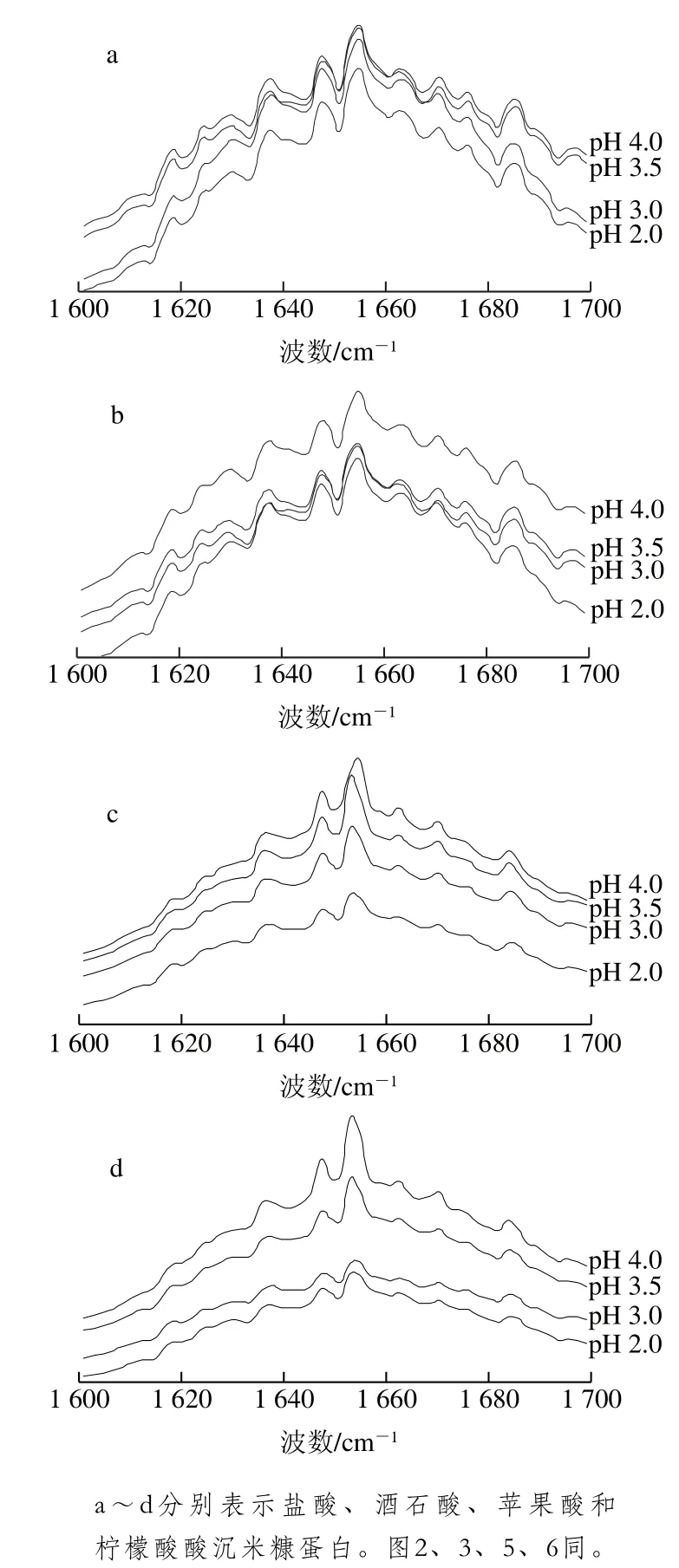
图1 不同有机酸酸沉制备米糠蛋白的傅里叶变换红外光谱酰胺I带Fig. 1 Amide I band of Fourier transform infrared spectra of rice bran protein precipitated with different organic acids
参考王长远等[19]方法对米糠蛋白去卷积酰胺I带图谱进行鉴定,如图1所示。β-折叠结构:1 617~1 618、1 626~1 627、1 637~1 638、1 695~1 696 cm-1;α-螺旋结构:1 646、1 651~1 653 cm-1;无规卷曲结构:1 660~1 661 cm-1;β-转角结构:1 670~1 672、1 681~1 683 cm-1。运用Peak Fit 4.12软件对酰胺I带图谱进行分峰拟合,得到米糠蛋白的二级结构组成,如图2所示。采用同种有机酸在不同pH值条件下酸沉时,随着酸沉pH值的下降,米糠蛋白二级结构中的β-折叠和β-转角相对含量下降,无规卷曲相对含量上升,α-螺旋相对含量则无显著变化。出现上述现象可能是因为,在酸性环境中米糠蛋白二级结构中的β-折叠和β-转角会向α-螺旋和无规卷曲转化,且随着pH值下降,转化程度增加,而将pH值再调回7.0时米糠蛋白发生聚集,α-螺旋和无规卷曲向β-折叠和β-转角转化,但是蛋白结构在展开又聚集的过程中,米糠蛋白二级结构难以完全按照之前的方式重组,整体趋于向无规卷曲转变,且随着酸沉pH值下降,米糠蛋白二级结构的变化程度越大,无规卷曲相对含量越高。赵谋明等[20]采用圆二光谱仪分析酸性条件对大豆分离蛋白二级结构的影响时发现,酸处理导致蛋白解离程度增加,二级结构中无规卷曲含量上升。采用不同有机酸和盐酸在相同pH值条件下酸沉时,米糠蛋白的二级结构组成无显著差异。

图2 不同有机酸酸沉对米糠蛋白二级结构组成的影响Fig. 2 Effect of acid precipitation with different organic acids on secondary structure contents of rice bran protein
2.3 酸沉处理对米糠蛋白内源荧光光谱的影响
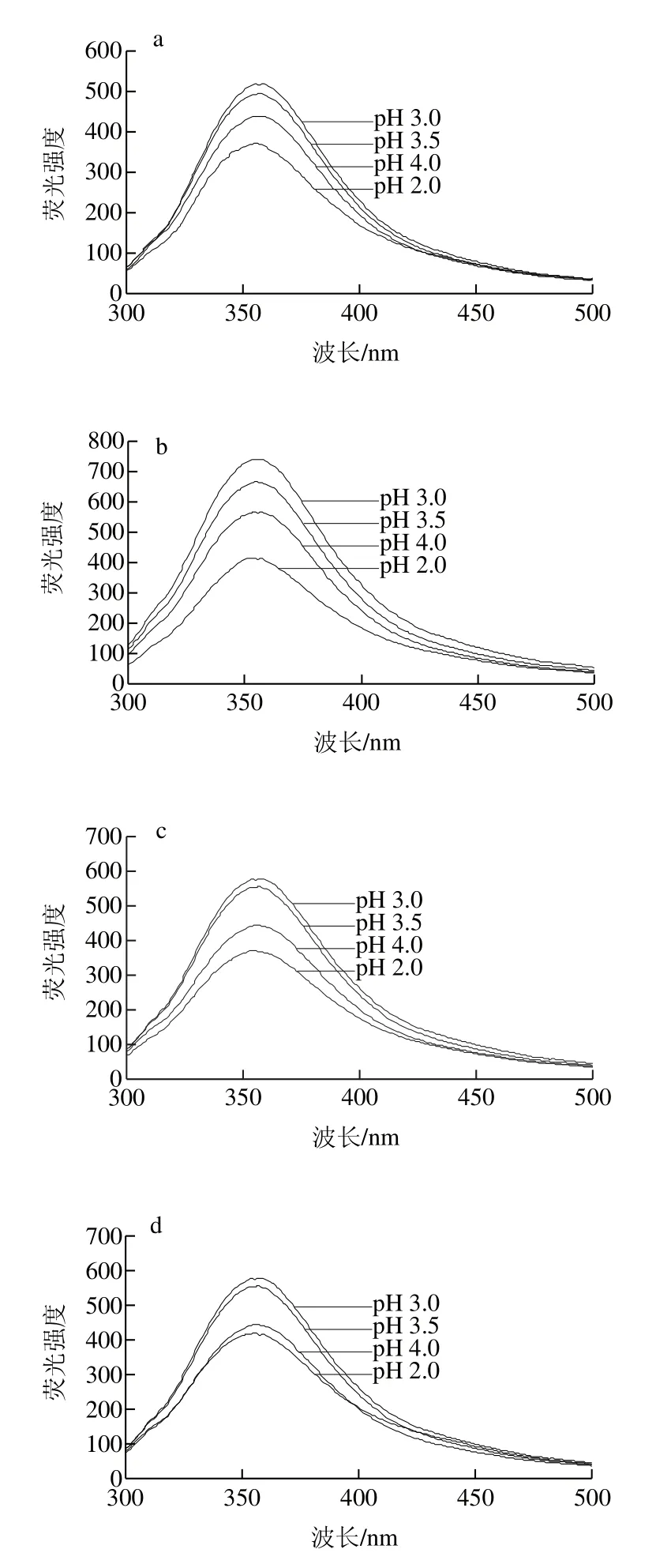
图3 不同有机酸酸沉制备米糠蛋白的荧光光谱Fig. 3 Intrinsic emission fluorescence spectra of rice bran protein precipitated with different organic acids
如图3所示,采用同种有机酸在不同pH值条件下酸沉时,随着酸沉pH值下降,米糠蛋白的荧光强度先增加后下降,当酸沉pH值为3.0时,米糠蛋白的荧光强度最高;相应的,米糠蛋白的最大荧光峰位移也先向长波长方向移动(红移),然后再向短波长方向移动(蓝移)。Jiang Jiang等[21]在研究pH值偏移处理对大豆蛋白结构的影响时发现,酸处理后大豆蛋白表面的色氨酸残基暴露程度增加,导致蛋白荧光强度增加,最大吸收波长发生红移。此外,Dong Xinhong等[22]在研究酸性条件下花生分离蛋白亚基结构的变化时发现,在极端酸性条件下(pH值小于3.0),蛋白分子间的静电斥力因离子静电屏蔽而减弱,蛋白质发生聚集而使结构变得紧密,暴露于亲水环境中色氨酸残基减少。因此,米糠蛋白的酸沉pH值由4.0下降至3.0时,米糠蛋白结构逐渐展开,内部色氨酸残基暴露程度不断增强,导致荧光强度不断增加,最大荧光峰位发生红移;而当酸沉pH值为2.0时,蛋白质之间的静电斥力减少而发生聚集,导致米糠蛋白荧光强度降低,最大荧光峰位反而发生蓝移。相比盐酸酸沉,采用3 种有机酸在相同pH值条件下酸沉时,米糠蛋白的荧光强度明显增强,原因可能是相比盐酸酸沉,相同pH值条件下3 种有机酸酸沉使得米糠蛋白表面的色氨酸残基暴露程度增加。
2.4 酸沉处理对米糠蛋白表面疏水性的影响
如图4所示,采用同种有机酸在不同pH值条件下酸沉时,随着酸沉pH值的下降,米糠蛋白的表面疏水性先增加后下降,当酸沉pH值为3.0时,米糠蛋白的表面疏水性达到最高。这可能是因为当酸沉pH值由4.0下降至3.0时,米糠蛋白的结构展开程度不断增加,更多的疏水性氨基酸残基暴露出来[23-24],导致米糠蛋白表面疏水性增加;而酸沉pH值继续下降至2.0时,蛋白质之间的静电斥力减少,部分米糠蛋白发生了聚集反应[25],降低了米糠蛋白疏水基团整体的暴露程度。3 种有机酸在pH 2.0条件下酸沉时,制备米糠蛋白的表面疏水性显著小于相同条件下盐酸酸沉制备的米糠蛋白表面疏水性(P<0.05),3 种有机酸和盐酸在pH 3.0、3.5和4.0条件下酸沉时,米糠蛋白的表面疏水性无显著差异(P>0.05)。
2.5 酸沉处理对米糠蛋白分子质量分布的影响
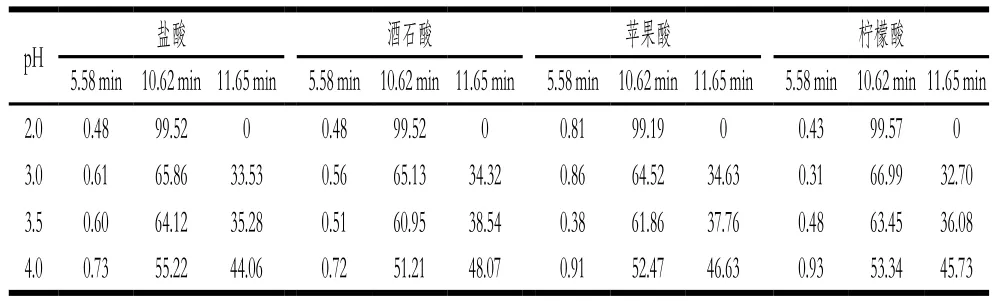
表2 米糠蛋白的分子质量分布图中峰面积百分比Table 2 Peak area percentage in molecular mass distribution of rice bran protein%
如表2所示,采用3 种有机酸和盐酸在不同pH值条件下酸沉,当酸沉pH值为4.0、3.5、3.0时,米糠蛋白分子质量分布图中出现3 个峰,保留时间依次为5.58、10.62、11.65 min,对应的蛋白质分子质量依次减小。采用同种酸酸沉时,随着酸沉pH值的下降,保留时间5.58 min处的峰面积百分比没有明显变化,保留时间10.62 min处的峰面积百分比逐渐增加,保留时间11.65 min处的峰面积百分比逐渐减少,表明酸沉没有导致米糠蛋白形成高分子质量聚集体,但是小分子质量蛋白逐渐形成大分子质量蛋白。当酸沉pH值为2.0时,3 种有机酸和盐酸酸沉制备米糠蛋白分子质量分布图中都只出现2 个峰,保留时间依次为5.58、10.62 min,而保留时间11.65 min处的峰消失,表明较低pH值条件下的酸沉可导致米糠蛋白结构发生部分解离和聚集。在相同酸沉pH值条件下,3 种有机酸和盐酸酸沉制备米糠蛋白分子质量分布图非常接近,表明3 种有机酸酸沉基本不影响米糠蛋白的分子质量分布。Lakemond等[26]研究pH值对大豆分离蛋白分子结构的影响时发现,酸处理(pH 2.0)导致大豆蛋白部分酸性亚基和碱性亚基解离,而解离出来的亚基在pH调回7.0的过程中发生了重组装,导致蛋白分子质量分布发生了变化。因此,可推测当酸沉pH值为2.0时,米糠蛋白发生了亚基解离,小分子质量的蛋白质在调回中性时形成大分子质量的蛋白分子,导致保留时间11.65 min处的峰消失[27]。
2.6 酸沉处理对米糠蛋白粒径的影响


图5 不同有机酸酸沉对米糠蛋白粒径分布的影响Fig. 5 Effect of acid precipitation with different organic acids on particle size distribution of rice bran protein
如图5所示,采用同种酸在不同pH值条件下酸沉时,随着酸沉pH值的下降,米糠蛋白的平均水平粒径不断增大。这可能是因为随着酸沉pH值的下降,米糠蛋白结构松散程度增加,肽链不断展开,在重新调回中性(pH 7.0)的时候,蛋白虽然会发生聚集,但难以恢复到天然的紧密球状结构,因此导致粒径相对增大[28]。采用不同酸酸沉,当pH值为2.0时,由4 种酸酸沉制备米糠蛋白的粒径分布之间没有差异;当酸沉pH值为3.0、3.5时,由苹果酸、柠檬酸酸沉制备的米糠蛋白粒径小于盐酸、酒石酸酸沉米糠蛋白。此外,米糠蛋白的粒径分布均只有一个峰,表明有机酸酸沉制备的米糠蛋白没有解离出新的亚基或形成聚集体。
2.7 酸沉处理对米糠蛋白亚基结构的影响
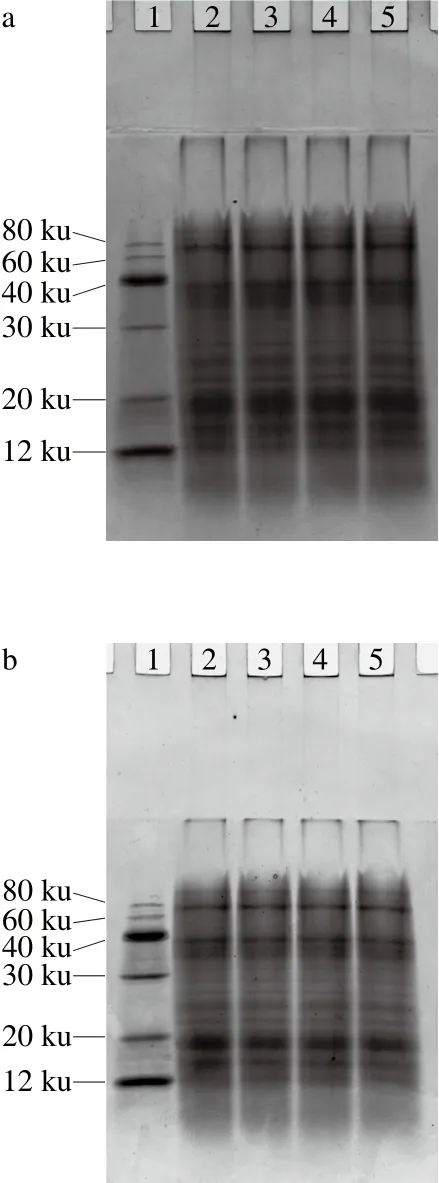
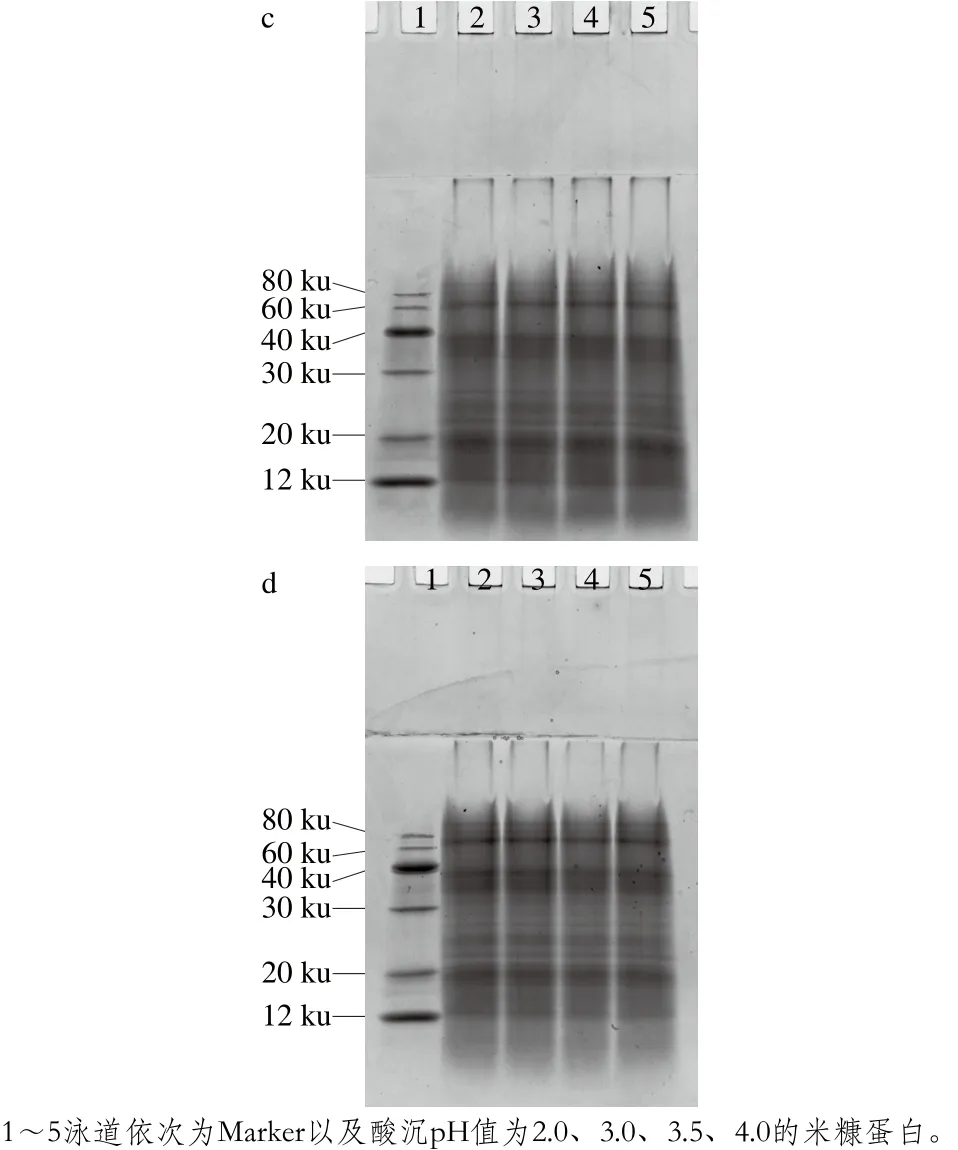
图6 不同有机酸酸沉对米糠蛋白亚基结构的影响Fig. 6 Effect of acid precipitation with different organic acids on subunit structure of rice bran protein
如图6所示,采用同种酸在不同pH值条件下酸沉时,随着酸沉pH值的下降,米糠蛋白电泳条带颜色深浅无显著变化,也没有出现条带增加或消失的现象,说明米糠蛋白的亚基结构没有变化。在酸性环境中,蛋白分子间静电排斥力较强,蛋白会发生亚基解离,但是解离的亚基在pH值调回中性时发生聚集,不再以解离状态单独存在[29-30]。所以,米糠蛋白的酸沉pH值下降,只是促使米糠蛋白的亚基解离,并没有对亚基进一步破坏,形成新的亚基。采用不同酸在相同pH值条件下酸沉时,米糠蛋白的亚基结构变化无显著差异。
3 结 论
采用酒石酸、苹果酸、柠檬酸分别在pH 4.0、3.5、3.0、2.0条件下酸沉制备米糠蛋白,通过测定可表征蛋白结构的指标,探索有机酸酸沉处理对米糠蛋白结构特征的影响。结果发现,采用同种有机酸在不同pH值条件下酸沉时,随着酸沉pH值下降,米糠蛋白游离巯基含量上升,总巯基含量无显著变化;无规卷曲相对含量上升,β-折叠和β-转角相对含量下降,α-螺旋相对含量无显著变化;内源荧光强度和表面疏水性均先增加后下降,在pH 3.0时达到最大值。这表明有机酸酸沉处理没有造成米糠蛋白二硫键的断裂,但使蛋白结构逐渐展开,当pH值再调回7.0时发生聚集,米糠蛋白的二级结构在这一过程中发生了变化。相比于传统的盐酸酸沉,在相同pH值条件下采用有机酸酸沉制备的米糠蛋白,其总巯基含量无显著差别,游离巯基含量较低;二级结构和表面疏水性无显著差异,内源荧光强度增强。分子质量分布、粒径分布及电泳分析结果表明,有机酸酸沉处理过程中,米糠蛋白结构发生了部分解离和聚集,但没有形成新的亚基和高分子质量聚集体。本实验关于酒石酸、苹果酸、柠檬酸在不同pH值条件下酸沉对米糠蛋白结构的研究结果为开发和应用除镉米糠蛋白提供了的理论参考。

