侧脑室注射GT-0198对坐骨神经慢性压迫性损伤大鼠的研究
(山西大同大学医学院 外科教研室,山西 大同 037009)
甘氨酸是中枢神经系统主要的抑制性神经递质。脊髓背角中甘氨酸传递在各种疼痛进程中起着关键的作用;而鞘内注射甘氨酸在动物疼痛模型中具有镇痛作用[1-2]。以往研究表明[3],侧脑室注射甘氨酸可通过甘氨酸受体对急性热痛和化学伤害性刺激大鼠产生镇痛作用。细胞外液甘氨酸浓度受到甘氨酸转运体(Glycine transporters,GlyT)调控,GlyT有2个亚型,GlyT1和GlyT2[4]。其中GlyT2位于脊髓甘氨酸能神经元突触前膜,可转运突触间隙中的甘氨酸,抑制甘氨酸传递。最近研究表明[5],鞘内注射GlyT2抑制剂ALX1393对神经病理性疼痛动物模型具有镇痛作用。但是GlyT2抑制剂在脊髓以上区域伤害性传递中的作用仍不明确。近年有研究报道[6],GT-0198是一种结构新颖的GlyT2抑制剂,具有很强的抑制GlyT2作用。因此,本研究主要观察侧脑室注射选择性GlyT2抑制剂GT-0198对大鼠慢性压迫损伤(chronic constriction injury,CCI)神经病理性疼痛模型的镇痛作用。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 35只雄性SD大鼠,体重200~250 g,购于山西医科大学实验动物中心,动物许可证号:SCXK(晋)2009-0001。室内温度保持在25℃左右,湿度在50%左右。明暗周期12 h,自由饮水和进食。将SD大鼠随机分成正常对照组和CCI组。CCI组大鼠进一步分为Sham组、Vehicle+CCI组、GT-0198(10 μg)+CCI组、GT-0198(50 μg)+CCI组、GT-0198(100 μg)+CCI组和 GT-0198(100μg)+士的宁(Strychnine,STR)(10 μg)+CCI组,每组5只大鼠。
1.1.2 实验仪器和试剂 GT-0198和STR(美国Sigma公司),脑立体定位仪(北京智鼠多宝生物科技有限责任公司),ZH-RXZ型柔性颅骨钻(安徽正华生物仪器有限公司),冷热板测痛仪(北京米兰科技有限公司),Von Frey针刺触觉测量套件(深圳沃德生命科技有限公司),热痛刺激仪(上海玉研科学仪器有限公司),大鼠旋转活动轮监测系统(北京拜安吉科技有限公司)。
1.2 方法
1.2.1 大鼠CCI模型复制 10%水合氯醛麻醉(150~200 mg/kg)大鼠,从大鼠左后肢大腿中后部切开皮肤,然后钝性分离肌肉,暴露大鼠坐骨神经,在坐骨神经三根分叉上游主干部位游离神经7 mm左右,在距神经起始处上方2 mm,用线结扎坐骨神经4道,每道间隔约1 mm[7]。Sham组除不结扎坐骨神经,其余程序同CCI。
1.2.2 侧脑室插管 在CCI模型复制同一天,把麻醉大鼠固定于立体定位仪上。剪去大鼠头部毛发,碘伏消毒。导管安装位置为:前骨缝的交点处即前囟沿着中骨缝向前约1.5 mm,水平离中骨缝向右约1.5 mm的位置。使立体定位仪上方钢针的针头对准导管安装位置打孔。将导管慢慢插入侧脑室。专用胶水将导管固定于颅骨上,然后缝合颅骨皮肤。腹腔注射适量青霉素钠以防止感染。在CCI手术后7 d侧脑室注射各种试剂,注射量均为5 μl,且在1 min内完成。
1.2.3 电子Von Frey检测 主要是对大鼠缩足阈值(paw withdrawal threshold,PWT)进行测定。Von Frey细丝(1.0~15 g)垂直刺激CCI大鼠后足中央处,持续5~10 s,出现明显缩足、舔足及抬足行为为阳性反应,重复3次,间隔5 min。
1.2.4 冷板实验 将CCI大鼠放置在冷板测试仪器上,冷板温度为4℃。观察并记录大鼠缩足反应潜伏期(paw withdrawal latency,PWL)。重复3次,间隔5 min,取平均值。
1.2.5 热刺激仪检测 采用热痛刺激仪记录CCI大鼠对热刺激的PWL。为避免损伤,30 s为上限。重复3次,间隔5 min,取平均值。
1.2.6 旋转实验 正常大鼠置于旋转滚筒上,其速度为在5 min内从4增加到40 r/min,迫使其向前走,避免跌下。记录大鼠跌下的时间。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,采用Kolmogorov-Smirnov检验对数据进行正态性分析,进一步两两比较采用Bonferroni法,多组间比较采用方差分析和重复测量设计的方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 GT-0198在CCI大鼠机械性痛觉过敏中的作用
Vehicle+CCI组大鼠左后肢 PWT 为(15.2±3.8)g,而Sham组大鼠为(36.8±4.4)g,差异有统计学意义(t=10.823,P=0.000),Vehicle+CCI组PWT降低。不同剂量GT-0198均可提高CCI大鼠PWT,经方差分析差异有统计学意义(F=21.865,P=0.002),且呈剂量依赖性。大鼠PWT Vehicle+CCI组与不同剂量GT-0198+CCI组比较,采用重复测量设计的方差分析,结果:①不同时间的PWT有差异(F=16.754,P=0.003);②多组间PWT有差异(F=21.305,P=0.000),Vehicle+CCI组PWT低于不同剂量GT-0198+CCI组;③多组PWT变化趋势有差异(F=13.964,P=0.006)。此外,GT-0198(100 μg)的效应可被 STR(10 μg)完全逆转。见表1和图1。
表1 各组不同时间的PWT比较 (n=5,g,±s)
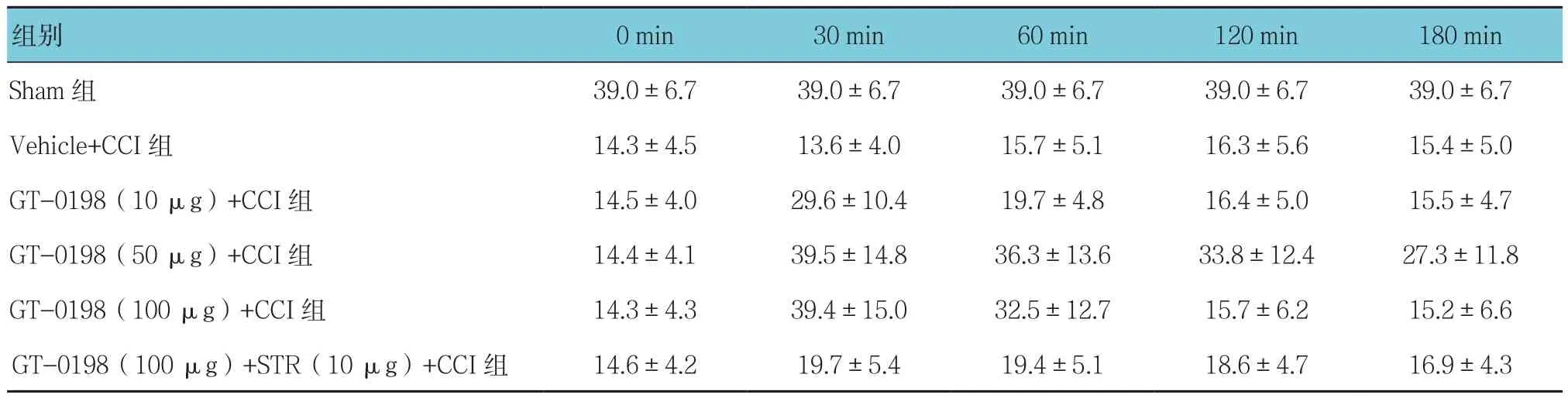
表1 各组不同时间的PWT比较 (n=5,g,±s)
0 min 30 min 60 min 120 min 180 min Sham 组 39.0±6.7 39.0±6.7 39.0±6.7 39.0±6.7 39.0±6.7 Vehicle+CCI组 14.3±4.5 13.6±4.0 15.7±5.1 16.3±5.6 15.4±5.0 GT-0198(10 μg)+CCI组 14.5±4.0 29.6±10.4 19.7±4.8 16.4±5.0 15.5±4.7 GT-0198(50 μg)+CCI组 14.4±4.1 39.5±14.8 36.3±13.6 33.8±12.4 27.3±11.8 GT-0198(100 μg)+CCI组 14.3±4.3 39.4±15.0 32.5±12.7 15.7±6.2 15.2±6.6 GT-0198(100 μg)+STR(10 μg)+CCI组 14.6±4.2 19.7±5.4 19.4±5.1 18.6±4.7 16.9±4.3组别

图1 侧脑室注射GT-0198对CCI大鼠机械性痛觉过敏的影响
2.2 GT-0198在CCI大鼠冷痛觉过敏中的作用
Sham组大鼠在观察期内未出现肢体移动和晃动,而Vehicle+CCI组大鼠基线后肢PWL为(30.3±8.8)s,差异有统计学意义(t=11.247,P=0.000),Vehicle+CCI组大鼠PWL降低。不同剂量GT-0198均可延长CCI大鼠PWL,经方差分析差异有统计学意义(F=16.632,P=0.004),且呈剂量依赖性。大鼠PWL Vehicle+CCI组与不同剂量GT-0198+CCI组比较,采用重复测量设计的方差分析,结果:①不同时间的PWL有差异(F=19.073,P=0.001);②多组PWL有差异(F=25.624,P=0.000),Vehicle+CCI组PWL短于不同剂量GT-0198+CCI组;③多组PWL变化趋势有差异(F=12.861,P=0.007)。此外,GT-0198(100μg)的效应可被STR(10 μg)完全逆转。见表2和图2。
2.3 GT-0198在CCI大鼠热痛觉过敏中的作用
Vehicle+CCI组大鼠基线后肢 PWL 为(6.0±0.8)s,而Sham组大鼠PWL是(9.8±1.1)s,差异有统计学意义(t=9.729,P=0.000),Vehicle+CCI组大鼠PWL缩短。不同剂量GT-0198对CCI大鼠PWL均无显著影响(F=6.042,P=0.067)。大鼠 PWL Vehicle+CCI组与不同剂量GT-0198+CCI组比较,采用重复测量设计的方差分析,结果:①不同时间点的PWL无差异(F=5.847,P=0.074);②多组 PWL无差异(F=3.305,P=0.153);③多组PWL变化趋势无差异(F=4.971,P=0.087)。见表3和图3。
表2 各组不同时间的PWL比较 (n=5,s,±s)

表2 各组不同时间的PWL比较 (n=5,s,±s)
0 min 30 min 60 min 120 min 180 min Sham 组 180.0±0.0 180.0±0.0 180.0±0.0 180.0±0.0 180.0±0.0 Vehicle+CCI组 30.6±14.4 29.3±15.0 28.7±15.3 30.3±15.6 29.4±15.2 GT-0198(10 μg)+CCI组 30.5±15.0 102.6±19.4 56.7±16.8 40.4±17.3 39.5±17.5 GT-0198(50 μg)+CCI组 30.4±14.2 165.6±21.8 176.3±20.7 118.8±18.6 59.5±17.0 GT-0198(100 μg)+CCI组 30.7±14.3 178.4±22.3 179.5±22.0 136.7±19.7 90.6±18.4 GT-0198(100 μg)+STR(10 μg)+CCI组 30.0±13.9 40.7±15.2 39.1±14.1 38.6±14.5 37.9±14.3组别

图2 侧脑室注射GT-0198对CCI大鼠冷痛觉过敏的影响 (n=5)
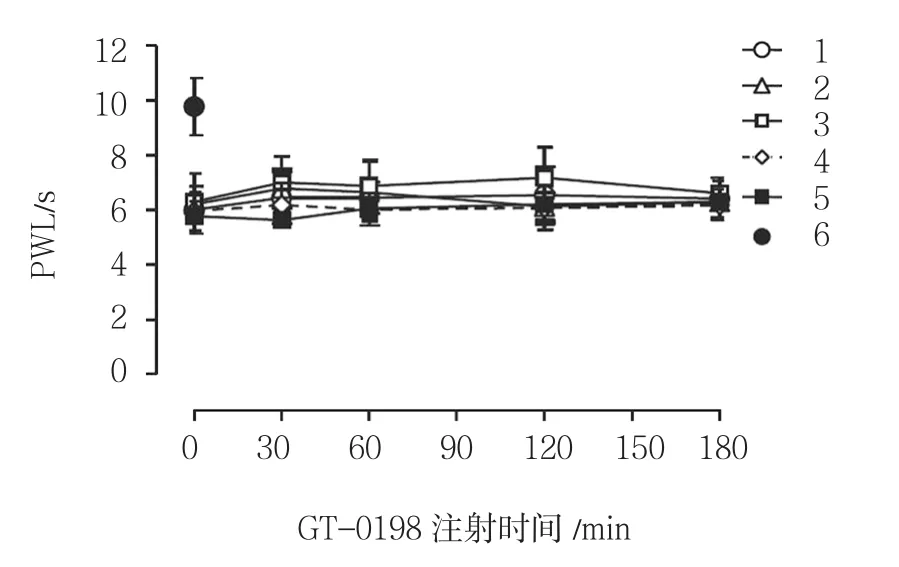
图3 侧脑室注射GT-0198对CCI大鼠热痛觉过敏的影响
表3 各组不同时间的PWL比较 (n=5,s,±s)
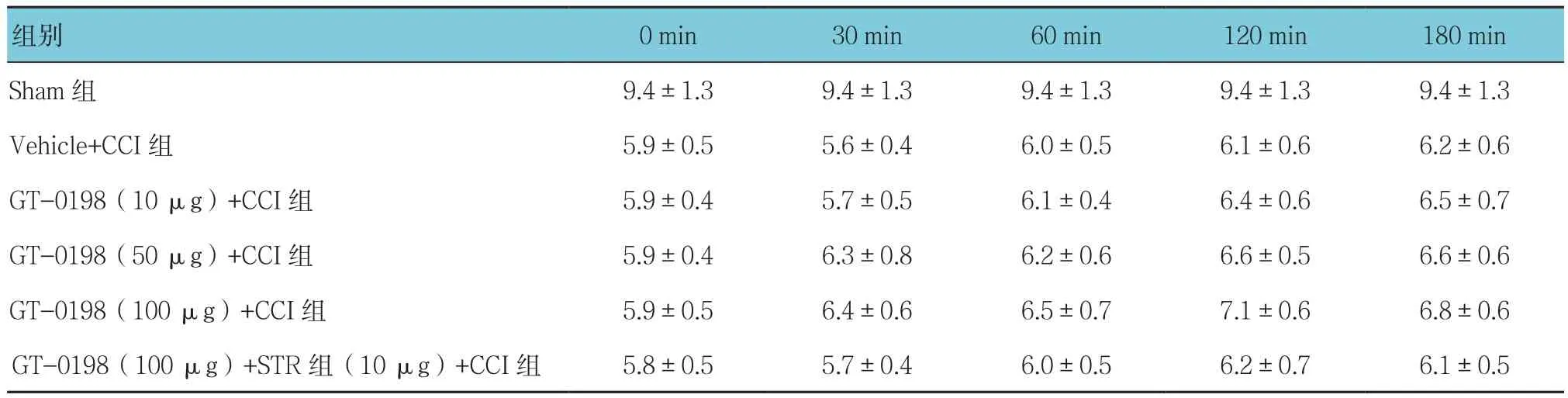
表3 各组不同时间的PWL比较 (n=5,s,±s)
0 min 30 min 60 min 120 min 180 min Sham 组 9.4±1.3 9.4±1.3 9.4±1.3 9.4±1.3 9.4±1.3 Vehicle+CCI组 5.9±0.5 5.6±0.4 6.0±0.5 6.1±0.6 6.2±0.6 GT-0198(10 μg)+CCI组 5.9±0.4 5.7±0.5 6.1±0.4 6.4±0.6 6.5±0.7 GT-0198(50 μg)+CCI组 5.9±0.4 6.3±0.8 6.2±0.6 6.6±0.5 6.6±0.6 GT-0198(100 μg)+CCI组 5.9±0.5 6.4±0.6 6.5±0.7 7.1±0.6 6.8±0.6 GT-0198(100 μg)+STR 组(10 μg)+CCI组 5.8±0.5 5.7±0.4 6.0±0.5 6.2±0.7 6.1±0.5组别

图4 侧脑室注射GT-0198对正常大鼠旋转功能的影响
2.4 GT-0198对正常大鼠运动功能的影响
Vehicle+CCI组大鼠基线旋转潜伏期是(108±12)s。不同剂量GT-0198对正常大鼠旋转潜伏期均无显著影响(F=7.184,P=0.059)。大鼠旋转潜伏期Vehicle+CCI组与不同剂量GT-0198+CCI组比较,采用重复测量设计的方差分析,结果:①不同时间点的旋转潜伏期无差异(F=3.769,P=0.145);②多组旋转潜伏期无差异(F=4.735,P=0.097);③多组旋转潜伏期变化趋势无差异(F=2.086,P=0.262)。见表4和图4。
表4 各组不同时间的大鼠旋转功能比较 (n=5,±s)
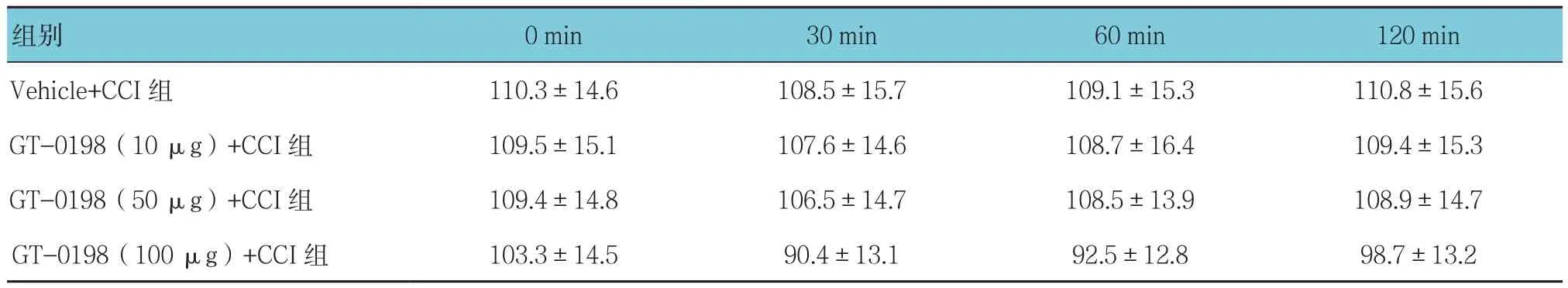
表4 各组不同时间的大鼠旋转功能比较 (n=5,±s)
组别 0 min 30 min 60 min 120 min Vehicle+CCI组 110.3±14.6 108.5±15.7 109.1±15.3 110.8±15.6 GT-0198(10 μg)+CCI组 109.5±15.1 107.6±14.6 108.7±16.4 109.4±15.3 GT-0198(50 μg)+CCI组 109.4±14.8 106.5±14.7 108.5±13.9 108.9±14.7 GT-0198(100 μg)+CCI组 103.3±14.5 90.4±13.1 92.5±12.8 98.7±13.2
3 讨论
GlyT2在脊髓及脊髓上的甘氨酸能在神经元中表达,在抑制甘氨酸传递调节中发挥重要作用[8]。选择性GlyT2抑制剂可能是一种新型的镇痛药物,可缓解不同类型的疼痛。全身或鞘内注射GlyT2抑制剂对急性、持续性和慢性疼痛具有镇痛作用[9]。但是GlyT2抑制剂在脊髓以上中枢区域伤害性传递中的作用仍不明确。
GT-0198剂量依赖性抑制CCI大鼠机械和冷痛觉过敏,但对热痛觉过敏无影响。尽管甘氨酸在不同疼痛模型中传递方式不一样,但不同疼痛模型中的镇痛效应仍不能完全解释。为了确认GT-0198介导的抗痛觉过敏是通过抑制脊髓上GlyT2及活化的甘氨酸受体,因而侧脑室预先注射甘氨酸受体拮抗剂STR。结果显示,STR可完全逆转GT-0198对CCI大鼠机械和冷痛觉过敏的影响。GT-0198是通过增强甘氨酸能传递而发挥作用的。脊髓上GT-0198的作用机制可能是激活疼痛抑制系统。延髓头端腹内侧髓质的甘氨酸神经元直接投射到脊髓,有助于脊髓伤害性刺激的抑制[10]。外源甘氨酸注入丘脑腹侧基底可减少躯体感觉神经元放电,而联合应用STR可拮抗该作用[11]。上述结果表明,通过GT-0198增加丘脑甘氨酸水平可抑制伤害性传递。但是目前仍不明确中枢神经系统其他区域GlyT2表达是否与GT-0198镇痛作用相关。同时在大脑特定区域GlyT1抑制剂也可产生镇痛作用。GlyT1抑制剂(肌氨酸),注入到前额叶皮层可减少神经病理性疼痛大鼠模型损伤足的机械敏感性[12]。本研究发现,虽然甘氨酸神经元在控制脊髓运动功能方面发挥重要的作用,但它们在大脑中的作用仍不明确。侧脑室注射甘氨酸不影响动物的运动功能[13]。GlyT2在脊髓中枢的生理作用仍不清楚。下丘脑室旁核微量注射甘氨酸可引起心率减慢,尿量增加等,而STR可抑制上述反应[14]。下丘脑中GlyT2抑制剂可能对心血管和肾脏有影响。要明确GlyT2生理作用以及GlyT2抑制剂的药理作用,需要GT-0198注射到中枢神经系统中特定区域。
综上所述,脑室注射选择性GlyT2抑制剂GT-0198可减轻CCI大鼠模型机械和冷痛觉过敏,而且对正常大鼠运动功能无影响。

