髓系来源的抑制细胞在肝病发病中的作用研究进展*
高苗苗,张纪元 综述,邹正升 审校
2013年全球疾病负担研究表明,我国居民所有死亡原因中,肝脏疾病所致死亡的比例为5.98%,给社会造成极大的经济负担。机体的免疫功能在肝病的进展中发挥重要作用,当前的研究也表明多种免疫细胞参与调节肝病的进展。髓系来源抑制细胞(Myeloid derived suppressor cells,MDSC)是一群异质性细胞。正常生理情况下,髓系祖细胞可分化为成熟的粒细胞、巨噬细胞、树突状细胞(Dendritic cell,DC)。然而在肿瘤、感染、败血症、外伤等病理状态下,髓系祖细胞及未成熟髓系细胞的成熟受阻,停留在分化的各个阶段,成为MDSC[1,2]。MDSC具有广泛的调节作用,在多种疾病的进展中发挥着重要作用。近年来,MDSC在免疫调节方面发挥的作用受到越来越多的关注。
1 MDSC的历史与亚群
1978年,一项关于卡介苗对脾脏免疫影响的研究中发现脾脏中存在抑制免疫的细胞,实验证明这些抑制性细胞来自骨髓。由于这些异常的髓系细胞缺乏成熟T细胞、B细胞、自然杀伤细胞(Natural killer cell,NK)及巨噬细胞的膜性标记物,因此被命名为失效细胞、否决细胞或者自然抑制细胞[3]。随后的多项研究证实这些细胞在肿瘤等疾病中扩增,并能够抑制淋巴细胞数量、细胞毒性T细胞诱导和激活、以及DC细胞的活化等[4]。研究发现 GM-CSF[5]、G-CSF[6]、VEGF、iNOS[7]、STAT3、MyD88 和 NF-κB[8]、Flt3L、SCF 和 S100A8/9、趋化因子[9]、miRNA-494、ASAM10和Notch等促使这些异常的髓系细胞扩增,相反,全反式维甲酸、Sutent等抑制其增长。直到2007年,Gabrilovich DI等发表文章,将此类细胞命名为MDSC达成一致[10]。
小鼠MDSC的共同特点是均可检测到其细胞表面表达GR1和CD11b分子。GR1包括Ly6C和Ly6G,分别表达于巨噬细胞和中性粒细胞。CD11b是巨噬细胞的标记物。根据Ly-6C与Ly-6G的表达,小鼠MDSC细胞分为两类,CD11b+Ly-6GlowLy-6Chigh细胞是类单核细胞形态,主要表达氮氧合酶,T细胞抑制性活动增强,定义为单核细胞型MDSC(mMDSC)。与此相对,CD11b+Ly-6G+Ly-6Clow 细胞是类粒细胞形态,高表达精氨酸酶 -1(Arginase 1,Arg-1),定义为粒细胞型MDSC(gMDSC)。后者有多核形态,因此,多核形态的MDSC也称作gMDSC[11]。另外一些研究发现,MDSC的某些亚群表达IL-4和IL-13(IL-4Rα)受体的α链,另一种巨噬细胞标记(F4/80),M-CSF-1R 或 c-fms(CD115),和共刺激分子CD80。
与小鼠的MDSC类似,人的MDSC也可分为mMDSC与gMDSC两群。mMDSC表型为 CD11b+CD33+HLA-DR-C D14+CD15-,相对的,gMDSC 为 CD11b+CD33+HLA-DR-CD14-CD15+[3]。随着研究的进一步深入,MDSC更多的表型被发现,包括高表达的CD66b,低表达的CD62L和CD16[12],血管内皮细胞生长因子受体1[13]及S100A9[14]。
2 MDSC的作用机制
多种证据表明,MDSC参与维持机体的免疫耐受,通过多种免疫学机制调节人体的固有免疫和适应性免疫。
精氨酸是T细胞活化的必需氨基酸,MDSC抑制CD4+和CD8+T细胞摄取精氨酸,同时其细胞内高水平的精氨酸酶-1耗尽环境中的精氨酸[15]。MDSC产生的活性氧和过氧化亚硝酸盐通过催化TCR的硝基化抑制CD8+T细胞,从而防止T细胞抗原肽的相互作用[16]。肿瘤浸润可能刺激MDSC产生 TGF-β,从而诱导调节性 T 细胞(Regulatory cell,Treg)产生,间接抑制T细胞活化[17]。MDSC还可下调TCR相关的ζ-链,后者是CD4+/CD8+T细胞活化所需信号。MDSC下调CD62L(一种幼稚T细胞归巢到淋巴结必要的膜分子),使得T细胞无法迁移到淋巴结。MDSC还可通过剥夺半胱氨酸抑制T细胞活化。半胱氨酸是T细胞活化的另外一种必需氨基酸。T细胞的半胱氨酸来自DC细胞和巨噬细胞,它们利用蛋氨酸和细胞外胱氨酸合成半胱氨酸。当MDSC高浓度聚集时,吸收大部分可用的胱氨酸,使得DC细胞和巨噬细胞合成半胱氨酸受阻。由于得不到足量的半胱氨酸,T细胞合成激活相关的蛋白受阻[18]。
MDSC也通过产生IL-10、TGF-β或精氨酸酶-1诱导Treg,间接影响T细胞活化,进而下调细胞免疫[19]。MDSC还可使得抗肿瘤免疫应答转变为促进肿瘤发展的2型应答,其产生的细胞因子IL-10可下调巨噬细胞产生的IL-12。另一方面,巨噬细胞可以反作用于MDSC,促进其产生更多的IL-10,进一步放大2型促肿瘤免疫应答。虽然MDSC调节NK细胞的作用尚不明确,但一些研究表明,MDSC可以抑制NK细胞对肿瘤细胞的细胞毒作用并下调NK细胞产生IFN-γ,进一步的研究发现NKG2D是NK细胞活化所需的一种受体,MDSC的这种抑制NK细胞功能的作用就是通过阻断NKG2D的表达[20]。然而,另一项研究表明,MDSC表达NKG2D配体Rae-1,从而激活NK细胞[21],提示激活的NK细胞也可以杀死MDSC。这些研究结果的差异可能源于MDSC不同亚群的差异。
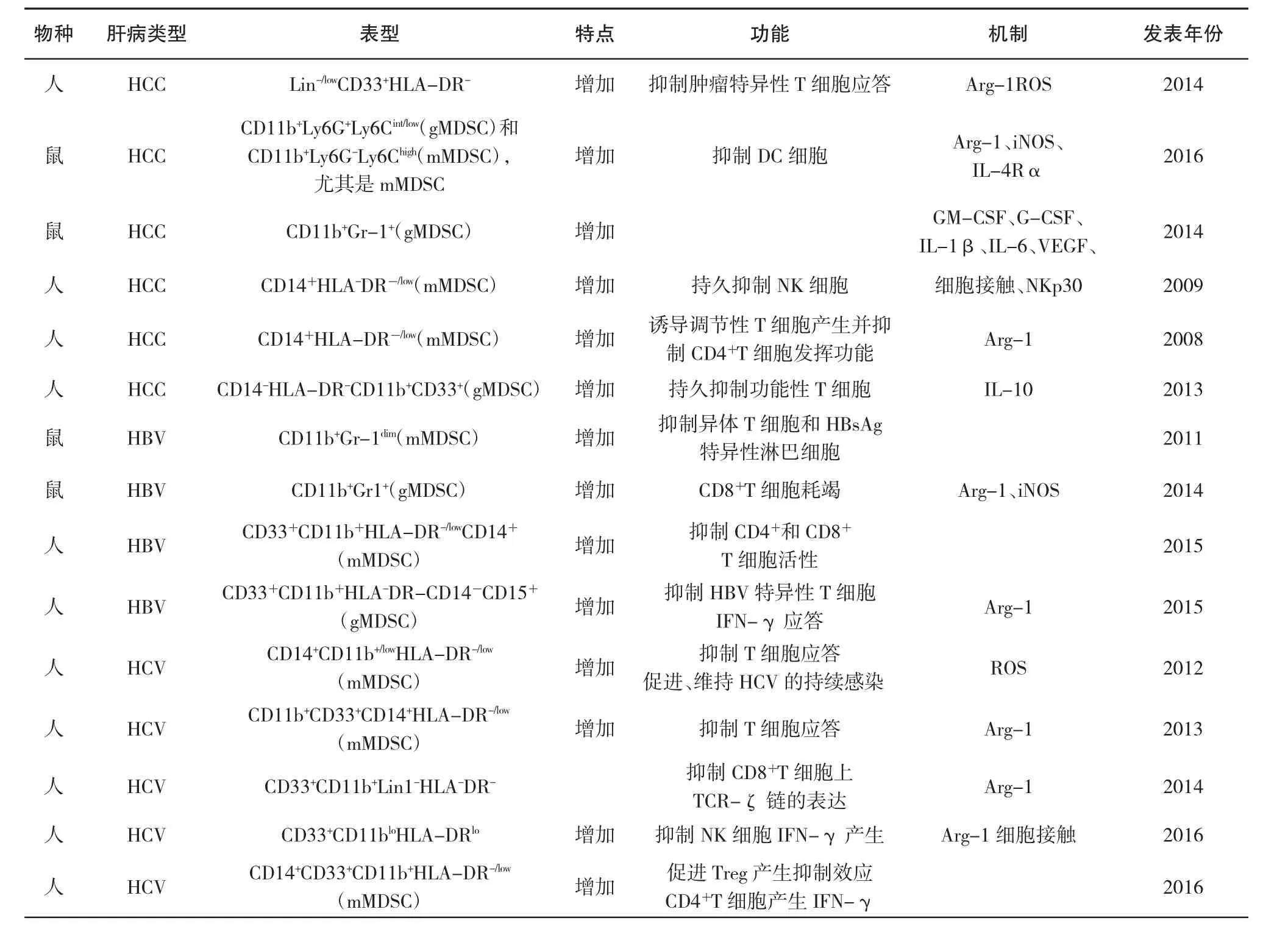
表1 MDSC在人和小鼠肝脏疾病中的调节作用
3 MDSC与肝脏疾病
近年研究发现,MDSC与肝脏疾病的发生发展具有密切关系,通过多种机制作用于肝脏疾病的发生发展。近年来,MDSC在人肝脏疾病中发挥的作用越来越受到重视,现就肝脏疾病中的MDSC研究现状做一综述。表1为近年来关于MDSC在人和小鼠肝脏疾病中发挥调节作用的相关研究及其作用机制的汇总。
3.1 MDSC与肝癌MDSC能够有效抑制抗肿瘤免疫 Shen研究发现,未治疗的HCC患者外周血Lin-/lowCD33+HLA-DRMDSC细胞频率明显高于健康对照组,升高的频率与癌症严重程度呈正相关,三四期肝癌患者MDSC细胞频率显著高于一二期患者,而后者显著高于健康对照组。有趣的是,研究发现伴有脾肿大的肝癌患者与不伴有者相比,其MDSC水平频率进一步升高。MDSC对T细胞增殖及IFN-γ水平的抑制程度与癌症的严重程度呈正相关,随着癌症分期的增加,其IFN-γ浓度逐级降低。晚期肝癌患者MMP13表达增加,与MDSC水平呈正相关;而其COX-2表达减少,与MDSC水平呈负相关[22]。Xu研究表明,活化的肝星状细胞能够诱导骨髓来源细胞分化为MDSC,其中对mMDSC的产生影响最显著。肝星状细胞通过精氨酸酶-1、iNOS、IL-4Rα抑制DC细胞形成并促进MDSC的生成。肝星状细胞还可通过COX2-PGE2-EP4信号通路促进MDSC的产生。肝星状细胞产生PGE2,作用于MDSC表面的EP4受体。因而EP4受体拮抗剂可阻断MDSC的积累。同样的,使用COX-2阻断剂可抑制HSC诱导MDSC的产生。并发现该通路主要作用于gMDSC,对 mMDSC 的作用微乎其微[23]。Kapanadze T et al研究发现,肿瘤诱导产生的GM-CSF介导肝癌MDSC的累积[24]。γδ T细胞来源的IL-17具有同样的作用。IL-17诱导肿瘤分泌CXCL5,然后通过CXCR2参与招募MDSC。此外,IL-17也直接作用于MDSC,提高它们的抑制能力。反过来,MDSC通过释放 IL-23和 IL-1β增加 γδT细胞产生 IL-17[25]。Hoechst等研究发现,在肝癌患者,MDSC对NK细胞的抑制作用主要是通过细胞接触的方式下调NKp30,而与精氨酸酶-1及iNOS通路无关[26]。在肝癌患者的体外实验中,CD14+HLA-DR-/low诱导与CD4+T细胞共培养的CD4+CD25+Foxp3+调节性T细胞,从而发挥其抑制作用[27]。Fumitaka研究发现,MDSC频率与肝癌的进展有关,而与其纤维化和炎症程度无关。并且患者经过射频消融等治疗后的疗效与体内MDSC的频率呈负相关,这些研究提示抑制MDSC频率可能会改善患者预后[28]。
3.2 MDSC与乙型肝炎 Chen发现,在HBV转基因小鼠,肝脏CD11b+Gr-1-MDSC频次大约是正常小鼠肝脏的两倍。HBV转基因小鼠的肝脏源性的CD11b+Gr-1-MDSC也抑制异体T细胞和HBsAg特异性淋巴细胞的增殖能力[29]。Kong研究发现,HBV持续感染的小鼠,其γδT细胞能够诱导CD11b+Gr1+MDSC 介导的CD8+T细胞耗竭[30]。Anthony研究表明,在HIV患者中,高频的MDSC有助于第16周HBV疫苗的应答。Lu研究发现,慢性乙型肝炎患者外周血Lin-HLA-DR-CD11b+CD33+MDSC频率显著高于健康人,且其频率在HBeAg+活动期与ALT、AST及TBil呈负相关,而与ALB呈正相关。Fang发现,慢性乙型肝炎患者血中mMDSC的水平与血清中HBsAg的高浓度呈正相关,而急性乙型肝炎患者的低水平HBsAg可能不会诱导mMDSC的积聚。研究发现,HBsAg以IL-6依赖的方式诱导STAT3的磷酸化,IL-6与单核细胞上的受体结合通常会激活转录因子STAT3。另一方面,HBsAg激活ERK1/2信号通路,从而诱导IL-6和MDSCs的分化。与此不同的是,Laura等研究发现,慢性乙型肝炎患者的mMDSC频率与健康对照组无显著差别,而其体内的gMDSC的频率是显著增加的。研究虽然没有发现gMDSC数量与病毒载量、HBsAg及HBeAg等之间有相关性,但在慢性乙型肝炎疾病进展的四个分期中,处于免疫耐受期(即HBV持续复制而不伴有肝脏炎症)的患者,其gMDSC的频率明显高于其他期,这一研究提示gMDSC可能参与维持乙型肝炎的免疫耐受。慢性乙型肝炎患者gMDSC高表达精氨酸酶-1,并且慢性乙型肝炎患者循环血中的精氨酸酶+gMDSC比例明显高于健康对照组,其肝内精氨酸酶+gMDSC富集,高于循环血中的频率。研究显示,gMDSC产生大量精氨酸酶消耗精氨酸,抑制T细胞功能,进而损伤肝脏。
3.3 MDSC与丙型肝炎 Tacke发现,HCV可以提高CD33+CD14+CD11b+/lowHLA-DR-/lowMDSC表达,并上调ROS介导抑制T细胞反应,进而促进、维持HCV的持续感染。Cai发现,慢性丙型肝炎患者的MDSC水平与血浆HCV-RNA,ALT,AST,活化的CD38+T细胞水平呈正相关,并以精氨酸-1-依赖途径抑制T细胞功能。此外还发现,慢性丙型肝炎患者进行临床治疗后,MDSC水平最早在第4周时开始下降,但在治疗12周后反弹。Zeng研究发现,慢性丙型肝炎患者外周血以及肝内CD8+T细胞表面的ζ链表达均下调,并与未治疗的慢性丙型肝炎患者MDSC频率呈负相关。Pang研究表明,HCV核心蛋白通过上调吲哚胺2,3-双加氧酶表达及抑制T细胞增殖促进CD14+单核细胞转变为CD14+HLA-DR/低表型(即mMDSC)。更重要的是,HCV通过PI3K通路增加IL-10和TNF-α分泌,从而诱导mMDSC扩增。Goh研究发现,与未感染HCV的CD33+PBMCs相比,NK细胞与HCV感染的CD33+PBMCs共培养产生IFN-γ较少。而两组的NK细胞表达量并无差别,因此,MDSC下调NK细胞产生IFN-γ可能发生在转录后。并发现了CD33+CD11blowHLA-DRlowMDSC通过精氨酸酶-1耗竭精氨酸,进而抑制mTOR通路介导的细胞增殖以及细胞因子的产生,例如抑制NK细胞产生IFN-γ。Ren研究显示,HCV诱导mMDSC高表达磷酸化信号转导与转录激活因子3和IL-10,而阻断STAT3信号通路会抑制HCV介导的mMDSC的扩增及IL-10的产生。同时发现,HCV诱导的MDSC可以显著增加健康人来源的PBMC中CD4+CD25+Foxp3+调节性T细胞的数量,而慢性丙型肝炎患者的MDSC减少导致其Foxp3+Treg细胞显著减少以及效应CD4+T细胞产生的IFN-γ显著增加。这些结果表明,HCV诱导的MDSC促进Treg细胞的增加和抑制效应CD4+T细胞的功能。
4 小结与展望
目前为止,关于MDSC与肝脏疾病的研究取得了很大的进步,多项研究表明MDSC在肝脏的疾病状态下表达上调,通过精氨酸酶、诱导型一氧化氮合酶等途径抑制T细胞应答、促进T细胞耗竭,且在肝癌中诱导调节性T细胞产生;通过细胞接触和NKp30途径持久抑制NK细胞的功能;通过IL-4Rα及精氨酸酶等途径抑制DC细胞功能,经多种途径调节肝脏的免疫状态,在肝脏疾病的发生发展中发挥着重要的作用。因此调节MDSC及其相关分子信号有可能成为治疗肝病的新靶点。值得注意的是,当前关于MDSC在肝脏疾病中的研究主要集中在肝癌、乙型肝炎和丙型肝炎,随着乙型肝炎疫苗的广泛使用、输血管理的加强和有效抗病毒药物的使用,我国乙型肝炎、丙型肝炎的感染率逐年下降。而伴随着人民生活水平的不断提高,嗜酒人群比例不断上升,酒精相关的健康问题逐渐凸显,不容忽视。一项多中心的研究表明,2000~2004年肝病住院患者中酒精性肝病患者分别占2.7%、2.9%、3.0%、3.6%和4.4%,所占比例呈不断上升趋势,5年间上升了1.63倍。而目前为止,MDSC与酒精性肝病的发生发展的关系尚缺乏研究,因此阐示MDSC在酒精性肝病中的免疫学特点,一方面可以弥补这一空白,另一方面有可能发现酒精性肝病新的治疗靶点。

