替诺福韦酯治疗多重耐药的乙型肝炎肝硬化患者疗效初步研究*
陈欣,陈立冬,李庭红
慢性乙型肝炎(chronic hepatitis B,CHB)是由乙型肝炎病毒(hepatitis B virus,HBV)感染引起的慢性肝炎。据统计,15%~49%CHB会转变成肝硬化和肝癌[1]。CHB的发病机制复杂,病毒的持续复制和免疫功能紊乱是发病的重要因素。核苷(酸)类似物(nucleoside/nucleotide analogues,NAs)是治疗乙型肝炎肝硬化(liver cirrhosis,LC)的一线药物,但随着多种NAs的上市和广泛使用,HBV耐药率也逐渐升高。有研究报道,拉米夫定作为早期被批准用于治疗CHB的NAs,治疗第1、2、3、4年HBV耐药率分别为14%、38%、49%、66%[2]。不同NAs联合治疗还会出现双重或多重耐药[3]。替诺福韦酯(tenofovir disoproxil fumarate,TDF)于2008年被美国食品药品管理局批准用于治疗CHB。国外多项研究证实,TDF用于初治代偿期乙型肝炎肝硬化患者,可长期有效地抑制HBV复制,改善患者生物化学和组织学指标,且安全性和耐受性良好。2015年美国肝病协会和亚太肝病研究学会发布的CHB防治指南均将TDF推荐为NAs耐药患者的一线治疗药物。TDF于2014年6月在我国正式上市,对于我国多重耐药的乙型肝炎肝硬化患者治疗的有效性及安全性尚缺乏循证医学的证据证明。本研究应用TDF和恩替卡韦(entecavir,ETV)治疗了80例多重耐药的乙型肝炎肝硬化患者,先将结果报道如下。
1 资料与方法
1.1 一般资料 2014年10月~2016年6月本院诊治的多重耐药的乙型肝炎肝硬化患者80例,男性47例,女性33例;年龄29~57岁,平均年龄(40.5±8.6)岁。病程5~16年,平均病程(7.6±3.2)年。符合《慢性乙型肝炎防治指南(2015年版)》诊断标准[4],并经血生化、病毒学和影像学检查确诊,其中HBV基因B型25例,C型52例,未分型3例;血清HBeAg阳性16例;代偿期肝硬化62例,失代偿期18例。纳入标准:初始选择拉米夫定(lamivudine,LAM)治疗,其后发生病毒耐药,再选择阿德福韦酯(adefovir,ADV)、替比夫定(telbivudine,LdT)或恩替卡韦(entecavir,ETV)单药序贯治疗,再次发生耐药者,其中对LAM和ADV双重耐药者55例,对LAM、ADV和LdT三重耐药者22例,对LAM、ADV和ETV三重耐药者3例。排除标准:①重叠其他肝炎病毒或艾滋病病毒感染;②合并酒精性肝炎、自身免疫性肝病或肝癌者;③伴有严重的心、脑、肾或血液系统疾病者;④对本研究所使用药物过敏者;⑤妊娠或哺乳期妇女。采用随机数字表法将80例(对LAM、ADV和LdT三重耐药)患者分为TDF治疗组和ETV治疗组,每组40例,两组性别、年龄、病程和病情等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准通过,患者签署知情同意书。
1.2 治疗方法 两组入组后均给予TDF【葛兰素史克(天津)有限公司,国药准字H20050651】300 mg随餐口服,1次/d,持续治疗12 w;随后,在TDF组继续给予TDF治疗,而在ETV组则改为ETV(中美上海施贵宝制药有限公司,国药准字H20052237)1 mg口服,1次/d,观察两组48 w。
1.3 观察指标 使用日本OLYMPUS AU5400全自动生化分析仪检测血肌酐(serum creatinine,sCr)、总胆红素(total bilirubin,TBIL)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和磷(phosphorus,P+);使用美国 Roche LightCycler 480II 实时荧光定量PCR仪定量检测血清HBV DNA;对于病毒学突破者,采用PCR产物直接测序法进行耐药基因检测;采用ELISA法检测HBV血清标志物(美国雅培公司生产的i2000R免疫发光检测系统及其试剂);使用法国Echosens公司生产的FibroScan502型瞬时弹性扫描仪检测肝硬度值;采用ELISA法检测血清成纤维细胞生长因子-23(fibroblast growth factor,FGF-23,美国 BioRad 公司,BioRad450 酶标仪);采用免疫透射比浊法检测血清胱抑素-C(cystatin-C,Cys-C)、β2- 微球蛋白(β2-microglobulin,β2-MG)和视黄醇结合蛋白(retinol binding protein,RBP,上海远慕生物科技有限公司)。
1.4 统计学方法 应用SPSS 21.0软件包对数据进行统计学分析,计量资料以(±s)表示,采用t或F检验;计数资料采用x2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组血生化学和病毒学应答率比较 在治疗12 w,两组ALT复常率和HBV DNA阴转率比较,差异无统计学意义(P>0.05),而在治疗24 w和48 w时,TDF组ALT复常和病毒学应答率显著高于ETV组,差异有统计学意义(P<0.05,表1)。
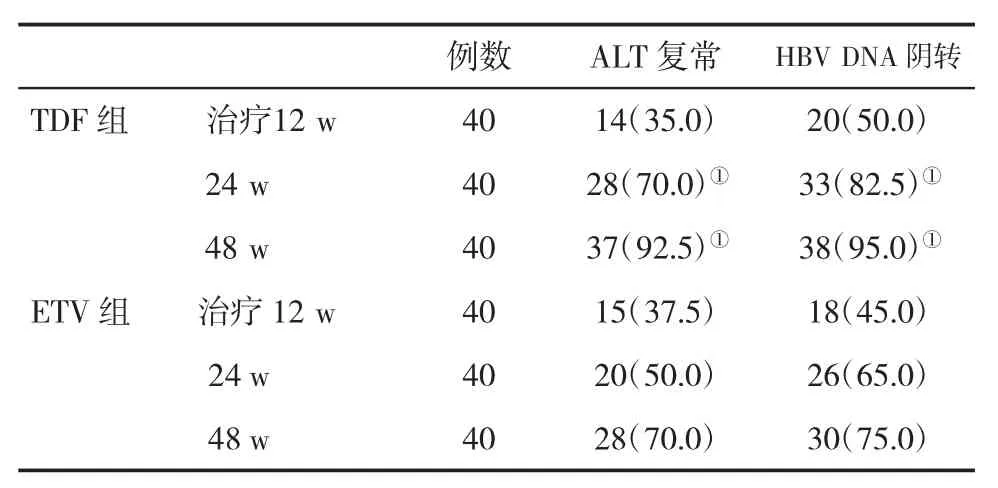
表1 两组生化学和病毒学应答率(%)比较
2.2 两组肝功能指标和肝硬度值变化的比较 在治疗24 w和48 w时,TDF组肝功能指标显著好于ETV组,差异有统计学意义(P<0.05,表2)。
2.3 安全性和耐药情况 在治疗48 w,两组血清FGF-23、Cys-C、β2-MG、RBP、sCr和 P+水平差异无统计学意义(P>0.05,表3);在治疗过程中,TDF组出现病毒学突破1例(2.5%),对PCR产物直接测序未提示TDF耐药。在ETV组,出现病毒学突破2例(5.0%),对PCR产物直接测序提示ETV耐药1例,存在rtT184位点突变。
表2 两组肝功能指标和肝硬度值(±s)变化的比较
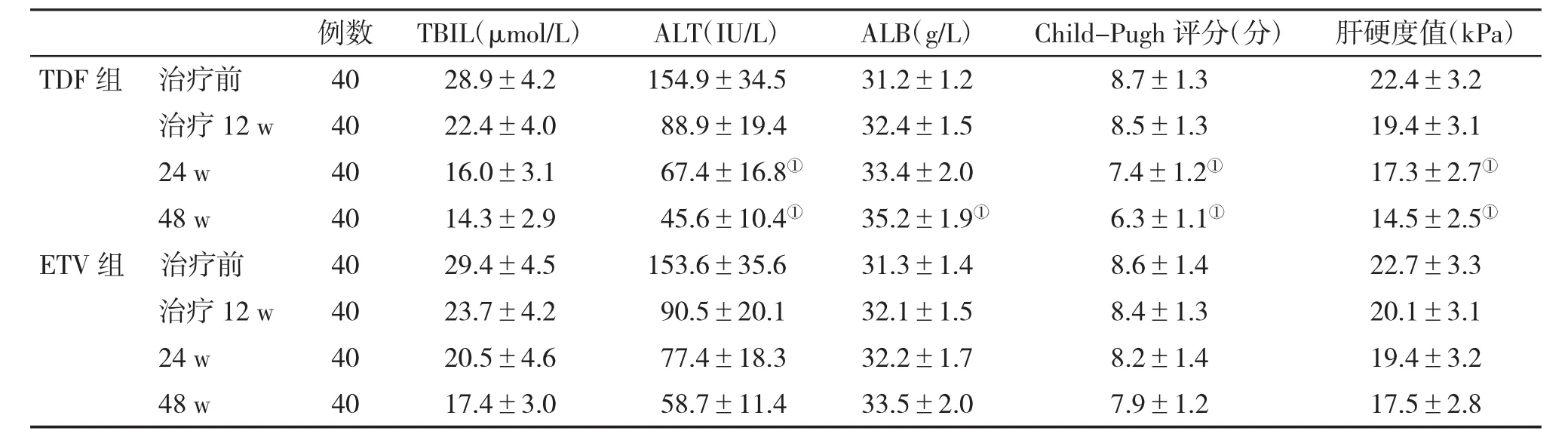
表2 两组肝功能指标和肝硬度值(±s)变化的比较
与ETV组比,①P<0.05
例数 TBIL(μmol/L) ALT(IU/L) ALB(g/L) Child-Pugh评分(分) 肝硬度值(kPa)TDF组 治疗前 40 28.9±4.2 154.9±34.5 31.2±1.2 8.7±1.3 22.4±3.2治疗 12 w 40 22.4±4.0 88.9±19.4 32.4±1.5 8.5±1.3 19.4±3.1 24 w 40 16.0±3.1 67.4±16.8① 33.4±2.0 7.4±1.2① 17.3±2.7①48 w 40 14.3±2.9 45.6±10.4① 35.2±1.9① 6.3±1.1① 14.5±2.5①ETV组 治疗前 40 29.4±4.5 153.6±35.6 31.3±1.4 8.6±1.4 22.7±3.3治疗 12 w 40 23.7±4.2 90.5±20.1 32.1±1.5 8.4±1.3 20.1±3.1 24 w 40 20.5±4.6 77.4±18.3 32.2±1.7 8.2±1.4 19.4±3.2 48 w 40 17.4±3.0 58.7±11.4 33.5±2.0 7.9±1.2 17.5±2.8
表3 两组肾功能指标和细胞因子水平(±s)比较
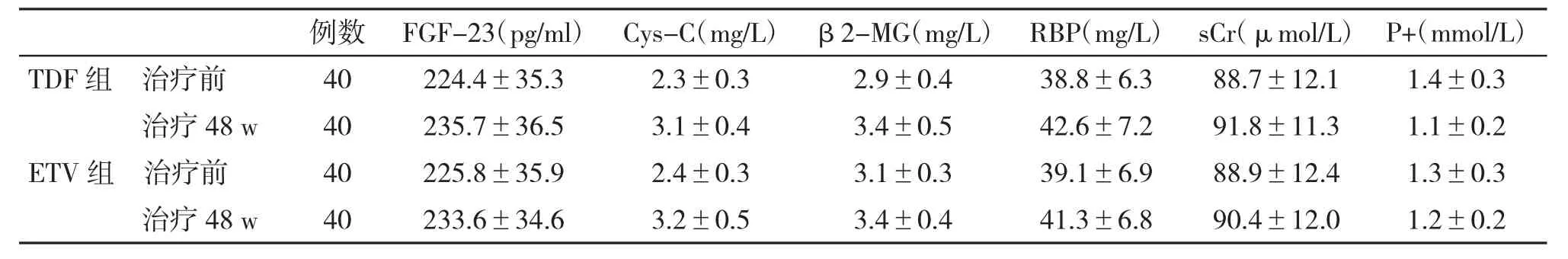
表3 两组肾功能指标和细胞因子水平(±s)比较
例数 FGF-23(pg/ml) Cys-C(mg/L) β2-MG(mg/L) RBP(mg/L)TDF组 治疗前 40 224.4±35.3 2.3±0.3 2.9±0.4 38.8±6.3治疗 48 w 40 235.7±36.5 3.1±0.4 3.4±0.5 42.6±7.2 ETV组 治疗前 40 225.8±35.9 2.4±0.3 3.1±0.3 39.1±6.9治疗 48 w 40 233.6±34.6 3.2±0.5 3.4±0.4 41.3±6.8 sCr(μmol/L)88.7±12.1 91.8±11.3 88.9±12.4 90.4±12.0 P+(mmol/L)1.4±0.3 1.1±0.2 1.3±0.3 1.2±0.2
3 讨论
NAs因具有口服方便、抗病毒作用强、不良反应少、安全性好等优点而在抗病毒治疗CHB患者方面占据重要的地位。但由于NAs的广泛使用及使用时间较长,耐药率逐年升高。目前,世界各类指南及专家共识均认为使用强效、没有交叉耐药的抗病毒药物是NAs耐药后挽救治疗的主要原则。
TDF是替诺福韦的酯前药物,口服后很快水解为替诺福韦,其抗病毒机制为经肠道吸收进入细胞后,在磷酸激酶的作用下成为活性二磷酸,可与HBV DNA合成所需的5’-三磷酸脱氧腺苷酸竞争性结合HBV DNA反转录酶而抑制HBV DNA合成[5]。TDF对HBV复制的抑制作用具有高效性,可使HBeAg阳性或阴性的CHB患者迅速获得完全病毒学应答。有研究报道,在81例LAM耐药患者,经替换ADV治疗后有32例发生对ADV耐药,49例对LAM或ADV不完全应答,给予TDF治疗6个月和12个月时病毒学应答率分别为68.2%和75.9%[6]。在一项多中心回顾性分析研究发现,给予153例对LAM耐药的CHB患者TDF或LdT治疗,12月后两组病毒学应答率分别为92.6%和78.4%,TDF组HBeAg转阴率和ALT复常率也高于LdT组(P<0.05)[7]。进一步研究发现,基线HBV DNA<1×103IU/mL时容易达到完全病毒抑制。本研究两组患者均对NAs耐药,部分患者发生双重甚至三重耐药,给予TDF治疗12周再分组,结果TDF组治疗24周和48周,上述指标均优于ETV组。
大量研究证实,HBV的持续复制及耐药病毒株的产生是引起肝纤维化和肝癌的独立危险因素[8,9]。2015年亚太肝病研究学会CHB指南将TDF推荐为乙型肝炎肝硬化的一线药物,国外已有多项研究证实TDF在代偿期乙型肝炎肝硬化患者可长期有效地抑制HBV复制,改善患者生物化学和组织学指标,延缓LC进程。对于HBV相关性慢加急性肝衰竭和肝硬化患者,给予TDF治疗48周,随着HBV DNA 载量的下降,肝功能显著改善[10,11]。TDF可改善肝功能Child-Pugh评分,降低肝硬度值。本研究治疗24周和48周后,随着HBV DNA载量的下降,TDF组肝功能指标和肝硬度值水平均显著下降,与有关报道[12]相符。
在TDF上市前,美国肝病学会和欧洲肝病学会将对HBV有强效抑制作用且具有高耐药基因屏障的ETV推荐为一线药物[13]。国内外对于LAM耐药的患者,在挽救治疗时不少采用ETV序贯方案[14,15]。但随着ETV的广泛使用,ETV耐药毒株的检出率也开始显现。2015年美国肝病协会和亚太肝病研究学会发布的CHB诊治指南建议,对于ETV治疗失败的CHB患者,可加用或单用TDF治疗,可降低耐药率。有人进行为期5年的研究观察,用TDF作为NAs耐药的挽救用药,结果5年耐药发生率仅为2.5%,且目前尚未检测出对TDF的耐药基因[16]。研究发现,含有rtA181V和rtN236T基因的LAM或ADV耐药株可使对TDF的易感性下降3.2~4.0倍,但这种不足可被大剂量的TDF克服[17]。本研究在治疗过程中,TDF组有1例出现病毒学突破,但经PCR产物直接测序未提示对TDF耐药。
TDF主要经肾小球过滤和肾小管主动转运系统排泄,约70%~80%以原形经尿液排出体外[18],长期服用有肾功能不全和低磷酸盐血症发生的危险。如何预防和降低TDF对肾功能及磷代谢的影响是临床医师关注的热点问题。Cys-C、β2-MG和RBP是监测早期肾功能损伤的敏感指标,而FGF-23是机体的重要调磷因子。在一项应用TDF治疗CHB患者的长期观察中发现,血清Cys-C、β2-MG和RBP水平分别于服用TDF 24周、32周和48周首次出现升高,适当调低TDF剂量后可恢复正常[19]。服用TDF 56周后出现FGF-23升高,调低TDF剂量后FGF-23也恢复正常[20]。本研究在治疗48周后两组 FGF-23、Cys-C、β2-MG、RBP、sCr 水平略高于治疗前,但差异无统计学意义(P>0.05),在治疗过程中也无患者出现sCr升高至≥2 mg/dL和血P+<2 mg/dL的情况,提示应用TDF治疗乙型肝炎肝硬化患者对肾功能和血P+的影响还是轻微的,需进一步随访。

