血管紧张素Ⅱ对巨噬细胞移动抑制因子mRNA表达的影响
王艳宁 王旭光 张 珉 韩 莹 吴 凡
(沈阳医学院基础医学院病理教研室,辽宁 沈阳 110034)
动脉粥样硬化是一个包括免疫系统、血管细胞及某些器官的慢性炎症性疾病〔1〕。目前已知内皮细胞、白细胞和平滑肌细胞在动脉粥样硬化炎症过程中起着决定性的作用,最近研究也证实许多组织和器官能产生一些可溶的炎性介质〔2〕。一些细胞因子、趋化因子、生长因子可调节炎症进程,同时内分泌激素也参与了炎症活动〔3,4〕,肾素-血管紧张素(Ang)-醛固酮系统(RASS)在其中起到了重要作用〔5〕。AngⅡ是RASS中的活性肽产物,参与了动脉粥样硬化的发生、发展〔6〕。巨噬细胞移动抑制因子(MIF)是许多急性和慢性炎症性疾病的前炎症调节因子,能抑制巨噬细胞的游走,促进巨噬细胞在炎症局部浸润,也是体内唯一能对糖皮质激素的抗炎性作用起负调节作用的物质〔7〕。本研究观察AngⅡ能否调节巨噬细胞MIF的表达,同时观察AngⅡ对MIF表达的调节是否能通过核因子(NF)-κB通路来实现。
1 材料与方法
1.1主要材料 THP-1细胞是由日本山梨大学医学部分子病理教研室惠赠。胎牛血清购于天津TBD公司,RPMI1640购于美国Hyclone公司,AngⅡ购于美国CS BIO公司,吡咯烷二硫代氨基甲酸铵(PDTC)、聚氰基丙烯酸正丁酯(BCA)蛋白浓度测定试剂盒、佛波酯、核浆蛋白抽提试剂盒、Histon H3抗体购于上海碧云天公司,CD68抗体购于福州迈新公司,NF-κBp65抗体购于美国Santa Cruz公司,real time RT-PCR试剂盒和RNA抽提试剂盒购于大连宝生物公司,PCR引物为Invitrogen公司合成。
1.2THP-1来源的巨噬细胞的培养和鉴定 THP-1细胞的培养:将THP-1细胞置于含10%胎牛血清的RPMI1640培养液中,在37℃及5%CO2条件下培养。THP-1细胞悬浮生长。将THP-1细胞诱导为巨噬细胞:在含有THP-1细胞的培养液中加入50 ng/ml的佛波酯,培养48 h,可见大部分THP-1悬浮细胞分化成贴壁生长的巨噬细胞。巨噬细胞的鉴定:在培养皿中放入盖玻片,THP-1细胞经佛波酯刺激后贴壁生长。48 h后将细胞取出,以4%多聚甲醛固定30 min后进行免疫细胞化学染色,一抗为CD68,4℃过夜,吸出一抗后磷酸盐缓冲液(PBS)清洗干净加入二抗,室温孵育1 h,PBS冲洗干净,二氨基联苯胺(DAB)染色。CD68染色阳性的即为巨噬细胞。
1.3分组方法 THP-1细胞经佛波酯刺激转化为巨噬细胞后进行分组。第一组包括对照组、AngⅡ 1×10-8mol/L组、AngⅡ 1×10-7mol/L组、AngⅡ 1×10-6mol/L组、AngⅡ 1×10-5mol/L组共5份。第二组包括对照组、AngⅡ(1×10-6mol/L)组、AngⅡ(1×10-6mol/L)+PDTC组、PDTC组共4份。AngⅡ+PDTC组先用1×10-5mol/L PDTC刺激30 min,再加入AngⅡ,作用时间为24 h。PDTC是NF-κB的特异性阻断剂。
1.4Western印迹检测巨噬细胞核内NF-κB的表达 核浆蛋白分离:操作步骤按照核浆蛋白分离试剂盒说明书进行。蛋白浓度的测定(BCA法):将蛋白标准配制成25 mg/ml的蛋白标准溶液,稀释至终浓度为0.5 mg/ml。按50体积BCA试剂A加1体积BCA试剂B配制适量BCA工作液。标准品按0,1,2,4,8,12,16,20 μl加到96孔板的标准品孔中,加标准品稀释液补足到20 μl。将各孔加入200 μl BCA工作液,于37℃放置30 min。测定A562,依据标准曲线计算样品的蛋白浓度。
十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE):配制5%的浓缩胶与10%的分离胶;取将要上样的蛋白样品60 μg/孔,将6倍上样缓冲液与蛋白样品混合。样品漂浮于自来水中,慢慢煮沸5 min,取出后立即放置于冰上,防止蛋白复性。12 000 r/min离心以去除残渣;垂直凝胶电泳分离不同分子量的蛋白质,浓缩胶80 V,30 min,分离胶120 V,当Marker的绿色条带跑至胶中部时,停止电泳。
Western印迹步骤:制作“三明治”并开始电转膜,50 V及120 V,1~2 h转印;取出聚偏二氟乙烯膜(PVDF),漂洗后放入含5%脱脂奶粉的T-PBS中封闭,室温下摇晃1 h;洗膜3次,每次5 min;将膜置入含NF-κBp65(1∶500)和Histon H3(1∶500)的一抗中,在摇床上孵育,4℃过夜;洗膜3次,每次5 min,将膜置于二抗溶液中(二抗浓度1∶1 000),孵育1 h;凝胶成像仪成像。
1.5Real time RT-PCR方法检测巨噬细胞MIF mRNA的表达 用RNA抽提试剂盒提取第二组细胞的总RNA,并用核酸分析仪分别检测其含量和纯度。取1 μl RNA进行反转录合成cDNA,之后再取3 μl cDNA进行PCR反应。MIF上游引物5′-GACATGAAC GCGGCCAAT-3′,下游引物5′-GGGTCCCTGCGGCTCTTA-3′。GAPDH上游引物5′-AGAAGGCTGGGGCTACATTTG-3′,下游引物 5′-AGGGGCCATCCACAGTCTTC-3′;反应条件:95℃ 30 s,1个循环;95℃ 5 s,60℃ 31 s,40个循环。用内参引物GAPDH的CT值对样本的拷贝数进行校正,并用2-ΔΔCT法计算出MIF mRNA与GAPDH mRNA的相对表达量。
1.6统计学方法 采用SPSS17.0软件行方差分析。
2 结 果
2.1巨噬细胞的鉴定 THP-1细胞为悬浮生长的圆形细胞,给予佛波酯刺激后贴壁,并从胞体伸出伪足。免疫细胞化学染色结果显示:一抗滴加CD68抗体(图1),细胞内染成棕黄色,证实THP-1细胞已转变为巨噬细胞。THP-1细胞经佛波酯刺激后出现伪足,CD68染色后可见细胞内为棕黄色。
图1 巨噬细胞鉴定(DAB,×400)
2.2AngⅡ对巨噬细胞核内NF-κBp65表达的影响 Western印迹检测细胞核内NF-κBp65蛋白的表达,结果显示:伴随AngⅡ浓度的升高,NF-κBp65蛋白的表达逐渐增强(图2),可见随着AngⅡ浓度的增高,NF-κBp65的表达逐渐增强。
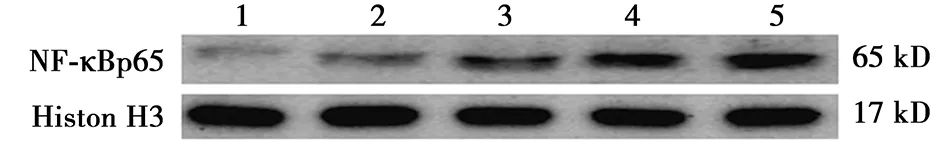
1~5:对照组、AngⅡ1×10-8mol/L组、AngⅡ1×10-7mol/L组、AngⅡ1×10-6mol/L组、AngⅡ1×10-5mol/L组图2 各组巨噬细胞核内NF-κBp65的表达
2.3巨噬细胞MIF mRNA的表达 与对照组(1)相比,AngⅡ组MIF mRNA表达量明显增高(3.05±0.13);给予PDTC后,MIF mRNA表达明显降低(AngⅡ+PDTC组为2.01±0.10,PDTC组为1.22±0.05,P<0.01)。
3 讨 论
动脉粥样硬化的形成一直是人们关注的要点,对于其发病机制目前已经有多种学说。研究表明,炎症在动脉粥样硬化斑块的发生、发展及破裂的过程中具有重要的作用。动脉粥样硬化炎症学说主要包括:炎症反应介导脂质沉积于动脉壁,参与形成动脉粥样硬化斑块的过程;在病变处可见大量单核/巨噬细胞及活化的T 细胞;细胞免疫应答和抗体都能调控炎症反应,促进动脉粥样硬化的发生与发展。
巨噬细胞在动脉粥样硬化病变中具有极为重要的作用,其贯穿于动脉粥样硬化各时期的病变,是炎症学说中的关键细胞。巨噬细胞作用主要为:通过分泌多种蛋白酶,参与细胞外基质的降解〔8〕;通过清道夫受体摄取氧化型低密度脂蛋白(ox-LDL),使巨噬细胞转变为泡沫细胞;释放生长因子刺激平滑肌细胞增殖和迁移等。由此可见,研究促进巨噬细胞聚集的因素对研究动脉粥样硬化病变具有重要的作用。以往研究显示基质金属蛋白酶(MMP)的活性增加及降解弹性蛋白形成弹性蛋白肽与巨噬细胞的浸润有关〔9〕,这只是众多因素之一。
有研究表明,MIF有刺激巨噬细胞聚集的作用,其可在血管内皮细胞、巨噬细胞、平滑肌细胞〔10〕等多种细胞中表达。MIF在促进动脉粥样硬化的作用中,体现在能直接增加T细胞和巨噬细胞的聚集〔11,12〕,还可以诱导不稳定斑块中MMP-1和MMP-9的表达,这表明MIF在削弱纤维帽、降解胶原蛋白及在斑块的不稳定性中都发挥着重要作用。目前AngⅡ对MIF的调节,文献报道的很少。研究表明,人动脉粥样硬化斑块内的MIF的表达量和强度与动脉粥样硬化的分期有关。在斑块有较多炎症和新生血管的区域,能见到AngⅡ刺激后的单核细胞表达MIF〔13〕。本研究结果显示,在体外实验中,AngⅡ能上调巨噬细胞MIF mRNA的表达。NF-κB参与调节基因转录,并与动脉粥样硬化的发生、发展和斑块的稳定性密切相关。通过药物META060抑制NF-κB通路,能抑制如白细胞介素(IL)-1β、MMP-9、巨噬细胞趋化因子(MCP)-1等THP-1细胞炎症因子的表达〔14〕。本研究结果显示随AngⅡ浓度的增高,NF-κB在核内的表达也增加,并同对照组相比均有明显差异,据此判断AngⅡ可以调节NF-κB的核内活化程度。研究显示,AngⅡ对THP-1细胞MMP-9的调节实验中,NF-κB通路能被激活〔15〕,我们研究的实验结果也证实了AngⅡ对NF-κB具有上调作用,且可以促进巨噬细胞内MIF mRNA的表达,而PDTC作为NF-κB的特异性阻断剂可抑制这种作用。有研究发现通过用ox-LDL刺激巨噬细胞,能使其核内NF-κB表达增高,而胞质中IκB表达下降,证实了刺激因子能促进NF-κBP65入核,而PDTC可抑制这一过程〔16〕。本研究显示PDTC作为NF-κB的阻断剂,起到抑制AngⅡ对MIF的上调作用,也说明了AngⅡ对巨噬细胞MIF mRNA的表达可以通过NF-κB通路调节,这也说明了在AngⅡ对MIF调节过程中,NF-κB信号通路并不是唯一的通路。

