Hedgehog信号通路通过调控缝隙连接蛋白43表达影响胃癌MGC-803细胞增殖和凋亡
程 玉 刘 曼 王明娟 薛 晶
(承德医学院, 1 病理学教研室, 2 附属医院病理科, 承德 067000)
据估计,全球每年新增胃癌病例95.16万,死亡病例72.31万,包括中国在内的东亚地区是该疾病的高发区域[1]。在我国,其发病率男性中排名第二,女性中排名第三[2]。目前对于胃癌发病机制的认识还很局限,认为是多个信号通路参与的复杂过程。近年来研究表明,Hedgehog过表达与胃癌细胞增殖与转移关系密切,但其具体作用机制目前还无定论。缝隙连接蛋白43(Cx43)是缝隙连接蛋白家族中的重要成员,其能维持正常细胞间信息交换、调节细胞增殖与分化[3]。目前有研究表明,Hedgehog可通过调节在乳腺癌细胞Cx43蛋白表达从而促进癌细胞增殖[4],然而Hedgehog通路能否通过调控Cx43从而调节胃癌细胞的增殖及凋亡查阅文献,尚未见相关报道。本研究应用Hedgehog通路抑制剂cyclopamine阻断该通路,观察胃癌细胞MGC-803细胞增殖和凋亡能力变化,以及其对缝隙连接蛋白Cx43 mRNA及蛋白表达的影响,初步探讨此通路在胃癌细胞增殖及凋亡中的作用机制。
1 材料和方法
1.1 细胞及试剂
人胃癌MGC-803细胞由承德医学院基础医学研究所馈赠;cyclopamine、MTT及DMSO均购自北京索莱宝科技有限公司;RPMI-1640培养基及胰酶购自Gibco公司;胎牛血清购自四季青;TUNEL试剂盒购自罗氏公司;qRT-PCR试剂盒购自北京天根生化科技有限公司;Cx43多克隆抗体购自Bioworld;所用引物由TaKaRa设计合成,引物序列见表1。
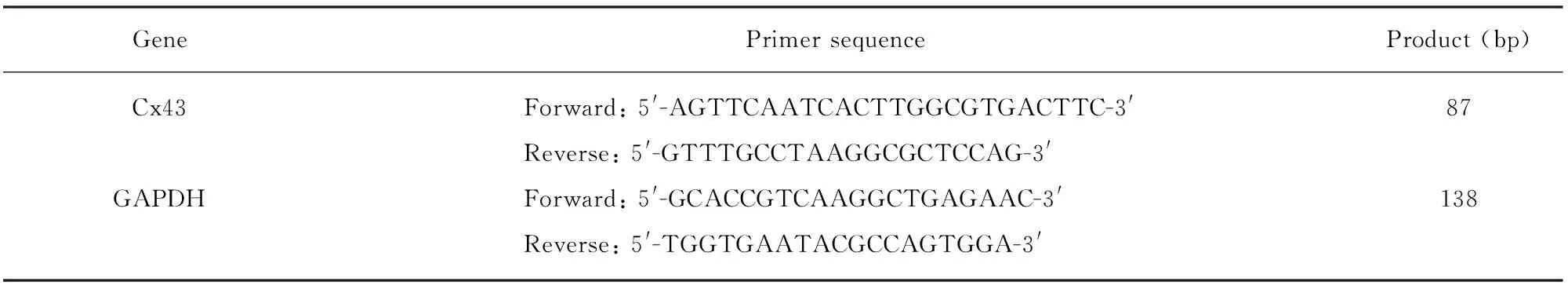
表1 引物序列
1.2 细胞培养
将MGC-803细胞培养于含10%胎牛血清的RPMI-1640培养基中,置于37℃、5% CO2培养箱中孵育。细胞融合度达到60%~70%时,胰蛋白酶消化,1∶3传代。
1.3 MTT法检测细胞增殖抑制率
收集对数期MGC-803细胞,细胞浓度调整为5×104/ml 分于96孔板中,置于37℃、5% CO2温箱中培养。24h后,吸掉各孔内的培养基,加入浓度分别为5、10、20、30、40、50μmol/L的cyclopamine,同时设立空白对照0μmol/L。继续培养24、48、72h后,加入20μl MTT溶液,继续孵育4h。终止培养,小心吸去孔内培养液,每孔加入DMSO 100μl,置于水平摇床上震荡10min。在酶联免疫检测仪490nm处测定吸光度。同时设置调零孔、对中孔,每孔设3复孔。
1.4 TUNEL检测细胞凋亡率
取对数生长期的MGC-803细胞,胰蛋白酶消化至悬液,将细胞接种于6孔板,每孔2ml,置于温箱内继续培养24h,吸弃原培养基,加入不同浓度的cyclopamine(0、30、40μmol/L),处理48h后,弃上清。严格按照试剂盒说明书步骤,经过水合、细胞通透、加TUNEL反应液等步骤,最后放于暗湿盒中反应37℃,1h,加1滴PBS再计数凋亡细胞。
1.5 qRT-PCR检测Cx43 mRNA的表达
加入不同浓度cyclopamine(0、30、40μmol/L)之后,放于温箱内培养48h后,用TRIzol提取细胞总RNA,用PrimeScript®RT reagent Kit with gDNA Eraser逆转录试剂盒将RNA转成cDNA,用SYBR Premix Ex Taq II反应体系进行PCR扩增,反应条件: 95℃预变性30s,95℃ 变性40s,60℃退火30s,共40个循环。以GAPDH为内参,2-△△ct方法计算mRNA的相对表达水平。
1.6 免疫印迹检测Cx43蛋白表达
收集MGC-803细胞,用RIPA裂解液提取总蛋白,BCA法检测蛋白浓度。收集的蛋白样品中加入5×SDS-PAGE蛋白上样缓冲液,沸水浴加热3~5min,充分变性蛋白。直接上样到SDS-PAGE胶加样孔内,每孔20μg,常规电泳及转膜,硝酸纤维膜于5%脱脂奶粉中室温封闭1h,加入Cx43(1∶500)及β-actin一抗,4℃孵育过夜。经TBST洗膜后,加入对应的二抗,室温孵育1h。再经TBST洗膜,ECL化学发光曝光显影。用Image J图像软件分析目的条带,计算相对表达量。
1.7 统计学处理

2 结果
2.1 MGC-803细胞增殖抑制率
MTT实验结果显示,与空白对照组相比,经30、40μmol/L cyclopamine处理48h后,MGC-803细胞增殖抑制率明显升高(P<0.05,P<0.01)(图1)。
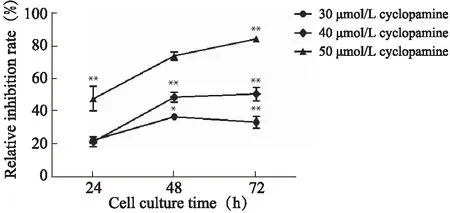
图1 各组MGC-803细胞增殖抑制率
2.2 MGC-803细胞凋亡率
TUNEL结果显示,MGC-803细胞经30、40μmol/L cyclopamine处理48h后,与空白对照组相比,处理组细胞凋亡率明显升高(P<0.01)(图2)。
2.3 Cx43 mRNA表达
30、40μmol/L cyclopamine作用细胞48h后,与空白对照组相比,Cx43 mRNA表达水平明显增高(P<0.05,P<0.01)(图3)。

图2 各组MGC-803细胞凋亡率
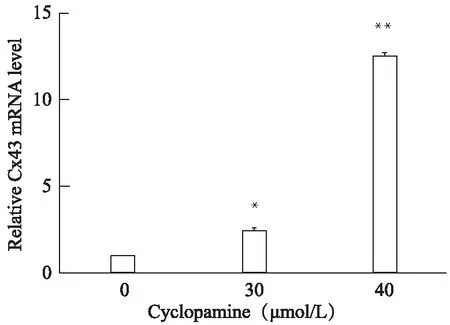
图3 Cyclopamine处理后Cx43 mRNA表达变化
2.4 Cx43蛋白表达
30、40μmol/L cyclopamine作用细胞48h后,与空白对照组相比,Cx43蛋白表达水平明显增高(P<0.05,P<0.01)(图4)。
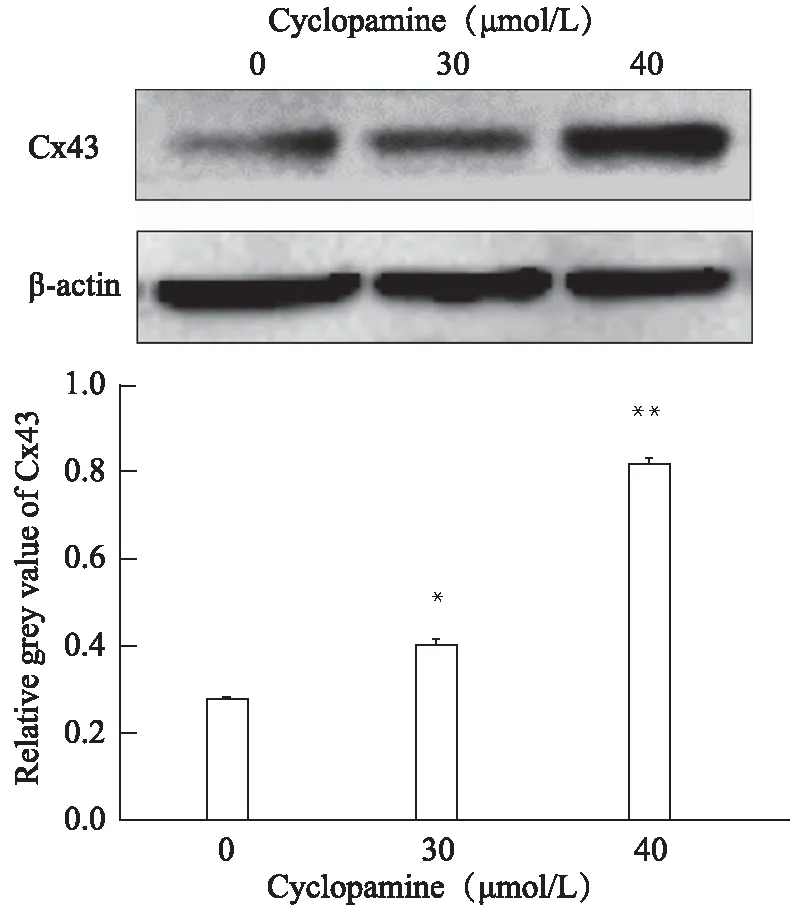
图4 Cyclopamine处理后Cx43 蛋白表达变化
3 讨论
在我国胃癌的发病率和死亡率远远高于欧美发达国家,对国民健康造成了极大的危害,胃癌的高度侵袭性和转移是导致胃癌患者高死亡率的主要原因。胃癌细胞的无限增殖和癌细胞凋亡失控是其侵袭和转移的基础,但是目前胃癌细胞异常增殖和凋亡的分子机制并不清楚。
近期有研究指出,从慢性炎症到胃癌的一步步演变过程中,Hedgehog信号通路起着至关重要的作用[5]。该信号通路异常激活与人类多种恶性肿瘤的发病相关,比如肺癌,肝细胞癌,大肠癌等[6-8]。人类Hedgehog信号通路主要由分泌型信号蛋白Shh配体、跨膜蛋白受体Ptch和另一跨膜蛋白Smo以及下游转录因子Gli蛋白组成,可简述为Hh-Ptch-Smo-Gli信号轴[9]。
在细胞实验中应用非常广泛的Hedgehog信号通路cyclopamine可以特异性结合和抑制Smo[10]。本实验应用cyclopamine阻断Hedgehog信号通路,观察胃癌MGC-803细胞增殖和凋亡。结果显示,阻断Hedgehog通路后胃癌MGC-803细胞增殖活力下降,而细胞凋亡率增高。该结果提示,Hedgehog信号通路可能是胃癌细胞的增殖和凋亡的分子机制。
为了进一步探讨Hedgehog信号通路影响胃癌细胞增殖及凋亡的机制,阻断Hedgehog信号通路后,本研究应用qRT-PCR和免疫印迹分别检测了Cx43 mRNA和蛋白的表达,结果显示Cx43 mRNA和蛋白的表达都增多。此研究结果提示,Hedgehog通路可能同时调节了Cx43的mRNA和蛋白水平的表达。本课题组前期研究显示,Cx43 mRNA及蛋白在胃癌组织中表达明显少于正常胃黏膜中的表达,其参与了胃癌的发生及发展,并且与PI3K/Akt等信号通路相关[11]。所以笔者推测,Hedgehog通路作用于胃癌的机制可能与Cx43 mRNA及蛋白相关。Hedgehog通路与Cx43 mRNA及蛋白之间存在一定的关联,但是主要集中于胚胎细胞方面。有研究者证实[12],在心肌胚胎干细胞发育过程中具有协同作用。还有研究表明[13],在胚胎期小鼠的舌中,抑制Cx43基因会阻断Hedgehog通路。还有一项研究指出[14],Cx43基因突变或者敲除都能导致并指的发生,其机制是由于Cx43基因突变或者敲除抑制了Hedgehog。新近研究报道,Hedgehog通路可通过影响Cx43蛋白膜表达,从而调控乳腺癌MCF-7细胞的增殖和凋亡[4],但是关于胃癌细胞中两者相互作用关系,目前尚未完全清楚。
综上所述,本研究证实了Hedgehog信号通路可促进胃癌细胞增殖,抑制细胞凋亡,并且表明该通路影响胃癌细胞增殖和凋亡的机制可能与调控Cx43 mRNA及蛋白有关。但此研究还存在一些不足,如只是通过阻断Hedgehog信号通路观察Cx43 mRNA和蛋白表达变化,后续还需要通过一系列实验激活该信号通路再研究Cx43 mRNA和蛋白的表达。此外,Hedgehog信号通路是如何影响Cx43 mRNA和蛋白表达的具体作用机制还有待进一步研究阐明。