替代模板法制备花椒麻味物质分子印迹聚合物及其吸附性能研究
李耀, 何叶子, 陈晓龙,2,3, 阚建全,2,3*
1(西南大学 食品科学学院,重庆,400715) 2(重庆市农产品加工与贮藏重点实验室,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715) 3(中匈食品科学联合研究中心,重庆,400715)
花椒(ZanthoxylumbungeanumMaxim)含有多种生理活性成分,如挥发油类、生物碱类和酰胺类物质,目前从花椒中分离纯化得到的酰胺类物质主要是山椒素及其羟基山椒素(见图1),这类酰胺物质被称为花椒麻味物质,山椒素是最能代表花椒引起麻刺感的成分,花椒麻味物质具有麻醉、兴奋、抑菌、祛风除湿、杀虫和镇痛等功效,在食品医药、化妆品等方面具有良好的应用前景[1-2]。花椒麻味物质在空气中易氧化,目前还没有商品化的标准品,传统分离纯化方法存在繁琐、成本高等缺点,而花椒麻味物质的结构、性质、含量等方面还有待深入研究,因此迫切需要研究出花椒麻味物质更加高效的分离纯化方法[3-4]。分子印迹技术为花椒麻味物质的分离纯化提供了新的思路。在分子印迹技术中,采用与印迹分子结构相似的化合物作为替代模板分子(dummy template molecular),可以解决一些印迹分子难获得、溶解性差等问题[5-6]。用替代模板分子制备的分子印迹聚合物对目标印迹分子仍具有较好的印迹效果[7-8]。近些年替代模板分子印迹快速发展,但目前仍未见有关花椒麻味物质的替代模板分子印迹技术的报道。
现有花椒麻味物质标准品制备过程繁琐、成本高,其分子链上的多个不饱和碳碳双键容易发生共价键化学反应,使花椒麻味物质不易洗脱[9];为解决上述问题,本实验合成一种羟基山椒素的结构类似物LM2(见图1-d)作为花椒麻味物质的分子印迹替代模板分子(理论分子质量为271),采用本体聚合法制备了花椒麻味物质替代模板分子印迹聚合物(MIPs),并对其吸附性能和分子识别能力进行了考察,以期为高纯度花椒麻味物质的分离提取奠定基础。
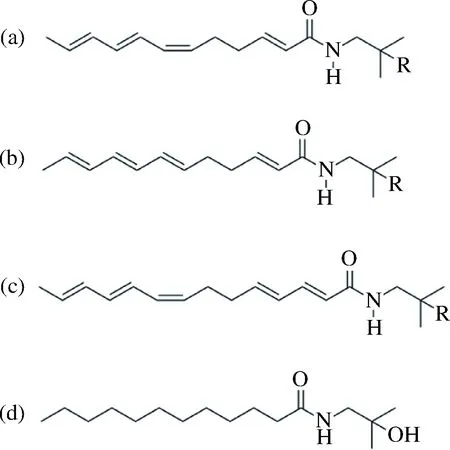
a-α-山椒素(R=H)和羟基-α-山椒素(R=OH);b-β-山椒素R=H和羟基-β-山椒素 R=OH;c-γ-山椒素 R=H及羟基-γ-山椒素 R=OH;d-替代模板的分子结构图图1 花椒麻味物质主要成分及替代模板的分子结构图Fig.1 Structures of acid amide components identifiedin pepper and the molecular structure analogs ofsanshool acid amide components
1 材料与方法
1.1 材料与试剂
花椒麻味物质(HJMS)标准品(纯度95%以上),按照逆流干柱层析法、制备型HPLC法等工序制备[10];鲜花椒,重庆凯扬农业有限公司;乙二醇二甲基丙烯酸酯(EDMA)、2-乙烯基吡啶(2-Vpy)均为分析纯,阿拉丁公司;偶氮二异丁腈(AIBN)、氯仿、甲醇、冰乙酸、乙腈均为分析纯,成都科隆试剂公司;1-氨基-2-甲基-2-丙醇、二异丙基乙基胺、1-羟基苯并三唑(HOBT)、月硅酸、异丁胺、1-H-苯并三唑-1-基氧三吡咯烷基鏻六氟磷酸盐均为分析纯,Sigma试剂公司;实验用水为蒸馏水。
1.2 仪器与设备
DSHZ-300型水浴振荡仪,苏州市培英实验设备有限公司;DHG-9123A 型电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;Eppendorf 5810型离心机,艾本德公司;超声波清洗器,上海科导超声仪器有限公司;HH-6型数显恒温水浴锅,金坛市富华仪器有限公司;HPLC 1260型高效液相色谱仪,美国Agilent公司;CP214型电子天平,奥豪斯仪器上海有限公司;Equinox55傅里叶变换红外光谱仪,德国Bruker公司;HITACHI S-3400N I型扫描电镜,Hitachi Science Systems;R215旋转蒸发器,BUCHI公司。
1.3 方法
1.3.1 花椒麻味物质结构类似物的合成方法[11]
取10 mmol月桂酸,于500 mL圆底烧瓶中,加入10 mmol的1-氨基-2-甲基-2-丙醇和20 mmol的二异丙基乙基胺,用60 mL无水DMF溶解后,于0 ℃冰浴下加入催化剂1-H-苯并三唑-1-基氧三吡咯烷基鏻六氟磷酸盐(PyBOP),30 ℃下揽拌反应24 h后,往混合液中加入200 mL水和100 mL乙酸乙酯稀释,于500 mL分液漏斗中分层萃取,有机层用40 mL浓度为1 mol/L的NaOH和40 mL浓度为1 mol/L的HCl分别洗涤3次,再用40 mL的NaHCO3洗涤1次后用40 mL饱和NaCl洗涤,最后用无水硫酸钠干燥1 h,倾倒出溶解有产物的乙酸乙酯溶液作为过硅胶柱层析的上样液;薄层色谱点板以确定产物的层析位置,以乙酸乙酯/石油醚(V/V=1∶2)作为展开剂,湿法上样,进行硅胶柱层析纯化,根据薄层色谱点板的结果接收含有产物部分的过柱流出液,将含有产物的流出液旋蒸干,将结晶产物溶解在少量石油醚中重结晶,得到无色固体结晶,即为LM2。
1.3.2 花椒麻味物质结构类似物(LM2)的结构确证
核磁共振氢谱和碳谱检测:取6 mg的结构类似物LM2于核磁管中,常温下分别加入0.5 mL氘代氯仿(CDCl3)使之完全溶解,上超导核磁共振仪测定1H-NMR和13C-NMR图谱,1H-NMR设置核磁兆数400 MHz,13C-NMR设置核磁兆数101 MHz。
气相色谱质谱联用检测条件[10]:DB-5 ms毛细管柱,30 mm×0.25 mm;载气氦气,流速30 mL/min;进样口温度250 ℃;接样口温度280 ℃;柱温80 ℃,升温速度5℃/min;进样量1 μL。倍增电压:1 963 eV;离子源能量70 eV,发射电流2 mA;离子源温度250 ℃。扫描速度0.82循环/s,扫描质量范围(m/z):35~500,标准图库NIST05。
1.3.3 花椒麻味物质的高效液相色谱(HPLC)检测条件及标准曲线[12]
HPLC色谱检测条件:色谱柱-Agilent EclipseXDB-C18(5 μm,4.6 mm×250 mm),流动相-甲醇∶水(体积比60∶40),流速-1 mL/min,保留时间15 min,进样量10 μL,柱温40 ℃,紫外检测波长254 nm。以高相液相色谱目标峰的平均面积(Y)对浓度(X,mg/mL)绘制标准曲线,花椒麻味物质标准曲线的线性回归方程:Y=18 040X+265(R2=0.999)。
1.3.4 花椒麻味物质分子印迹聚合物的制备[13]
取67.75 mg(0.25 mmol)替代模板分子于50 mL烧瓶中,加入12 mL乙腈,1 mmol功能单体2-Vpy,充分溶解后,放置过夜;加入5 mmol交联剂EDMA和10 mg引发剂AIBN,充分溶解后,向混合液中通氮气20 min,使瓶内保持惰性氛围,并在氮气保护下用封口膜密封烧瓶;于50 ℃恒温水浴锅内热引发聚合4 h后再于60℃恒温水浴锅内热引发聚合20 h,得乳白色块状聚合物,将聚合物反复研磨,过200目标准检验筛;用丙酮自然沉降3次,每次1 h,弃去上层浊液,以除去聚合物中过细小的粒子;真空干燥处理沉淀物,以甲醇-乙酸(体积比9∶1)为洗脱液进行索氏提取,直至索氏提取器内溶液不含替代模板分子为止;用甲醇反复洗涤聚合物,将处理好的聚合物置于真空干燥箱内,50 ℃干燥至恒重,即制备了花椒麻味物质替代模板分子印迹聚合物(MIPs)。
空白印迹聚合物(NIPs)的制备及处理方法与MIPs相同,只是在聚合物合成过程中不加入替代模板分子[14]。
1.3.5 分子印迹聚合物的静态吸附试验
称取50 mg替代模板分子印迹聚合物,置于20 mL具塞锥形瓶中,加入8 mL一定浓度的HJMS氯仿溶液,于振荡器上25 ℃下150 r/min振荡12 h后,倒入10 mL离心管中6 000 r/min离心5 min,高效液相色谱法测定上层清液中HJMS浓度,差减法计算该聚合物对HJMS的吸附量Q[15],计算公式见式(1),
Q=(C1-C0)V/M
(1)
其中:Q为MIPs的吸附容量,mg/g;C1为氯仿溶液中HJMS的原始浓度,μg/mL;C0为吸附后上层清液中HJMS的浓度,μg/mL;V为氯仿溶液的体积,mL;M为MIPs的重量,g。
1.3.6 MIPs和 NIPs的吸附动力学试验
称取50.0 mg MIPs和50.0mg NIPs,分置于20 mL具塞锥形瓶中,然后分别加入8 mL浓度为250 μg/mL的HJMS氯仿溶液,放入25 ℃恒温振荡器中(150 r/min),每隔2、4、6、8、10、12、14 h取出MIPs和NIPs上清液各1份,测定其中HJMS浓度,绘制吸附容量Q(mg/g)与吸附时间t之间的变化曲线[16]。
1.3.7 MIPs和 NIPs的等温吸附试验
分别配制浓度为50、100、150、200、250、300 μg/mL的花椒麻味物质氯仿溶液。分别称取多份50 mg MIPs和NIPs,分置于20 mL具塞锥形瓶中,按浓度梯度在每个容量瓶中加入8 mL上述溶液,于25℃恒温振荡器中振荡12 h,取出,6 000 r/min离心5 min,高效液相色谱法测定上层清液中HJMS浓度,计算吸附容量、特异结合量、特异因子[17]。
特异结合量定义为式(2):
ΔQ=QMIP-QNIP
(2)
特异因子定义为式(3):
α=QMIP/QNIP
(3)
式中:α为特异因子;QMIP为MIPs的吸附容量;QNIP为NIPs的吸附容量。分子印迹研究中通常用QMIP表示吸附容量,特异因子α表示印迹效果。
用Scatchard模型评价MIPs的吸附特性,计算公式为式(4):
Q/C=(Qmax-Q)/Kd
(4)
式中:Kd为结合位点的解离平衡常数;Qmax为结合位点的最大表观结合量,mg/g;Q为MIPs对目标分子的吸附容量,mg/g;C为平衡时吸附液中目标分子的浓度,mg/mL[18]。
1.3.8 花椒麻味物质分子印迹聚合物的电镜表征
称取SMIP和SNIP粉末各100 mg,过200目筛后镀金,于扫描电镜下观测样品表观形态[19]。
1.3.9 数据处理方法
每个实验重复3次,用Origin 8.0和Excel 2003处理实验数据并作图,结果以“平均值±标准方差”来表示。
2 结果与分析
2.1 LM2 的气相色谱-质谱联用分析
由图2可以看出,该花椒麻味物质的分子印迹替代模板分子LM2主要成分只有1个峰,按峰面积归一化法进行积分计算,可估算出结构类似物LM2的相对百分含量在95%以上。通过分析主峰的离子质谱图,发现LM2的加氢离子峰(M+H)的最大质荷比为272,减去氢质子即为271,按照分子式C16H33NO2计算的相对分子质量应为271,质谱图显示的最大质荷比与理论上计算出的相对分子质量相吻合[12]。

图2 LM2的气相色谱-质谱联用图谱Fig.2 Total ion current chromatogram and Massspectrogram peak of LM2
2.2 LM2 的核磁共振氢谱图和碳谱图分析
LM2(分子式C16H33NO2)的核磁解谱数据:1H-NMR (400 MHz, CDCl3):δ 6.06 (s, 1H), 3.26 (d,J=6.0 Hz, 2H), 2.75 (s, 2H), 2.20~2.24 (m, 2H), 1.86 (s, 1H), 1.68~1.60 (m, 2H), 1.38~1.30 (m, 6H), 1.26 (s, 8H), 1.22 (s, 6H), 0.88 (t,J=6.9 Hz, 3H)。13C-NMR (101 MHz, CDCl3):δ 174.4, 70.9, 50.3, 36.8, 31.9, 29.6, 29.5, 29.3, 29.3, 28.9,28.6,27.3, 25.9, 22.7, 14.1.
由图3可知,氢原子的化学位移数可以与理论上对应的官能团吻合,经积分计算,氢原子有33个,与理论个数一致,碳谱上显示碳原子均有15个,理论上LM2碳原子个数均为16,这是因为异丁基部分有两个对称的甲基碳的化学位移发生重叠,从核磁氢谱和核磁碳谱中看不出明显杂质干扰,说明合成的LM2产物纯度较高。

图3 LM2的1H-NMR谱图和13C-NMR谱图Fig.3 1H-NMR and 13C-NMR spectrum of LM2
2.3 分子印迹聚合物的电镜扫描表征
由图4可知,MIPs与NIPs相比,立体效果更加明显,表面有更多孔隙;MIPs具有良好的分散性,而NIPs表面看起来分散不均与,形状不规则,有结块现象发生。经比较可知,制备分子印迹聚合物过程中加入替代模板分子,对形成特异性吸附花椒麻味物质分子的空间结构有关键作用[20]。

图4 MIPs(A)和 NIPs(B)的扫描电镜图(×10 000)Fig.4 The SEM photos of MIPs and NIPs(×10 000)
2.4 MIPs对花椒麻味物质的吸附动力学试验
由图5可知,MIPs和NIPs对HJMS的吸附容量均随时间延长而增加,最后达到吸附平衡。MIPs和HJMS的接触时间约10 h时就基本达到吸附平衡,达到吸附平衡后的吸附容量几乎保持不变,MIPs对HJMS的吸附容量为(15.34±0.85) mg/g。这是因为MIPs表面存在结合位点,其内部也存在结合位点,而结合位点分布不均匀,刚开始吸附时,目标分子与表面结合位点快速结合,随着表面结合位点的饱和,产生空间位阻,目标分子与内部结合位点逐渐缓慢结合,最终MIPs吸附目标分子达到饱和[21]。

图5 MIPs及NIPs对花椒麻味物质的吸附动力学分析Fig.5 Binding dynamics of MIPs and NIPs to HJMS
2.5 MIPs对花椒麻味物质的等温吸附试验
由图6可知,随着底物HJMS的浓度增大,MIPs的吸附容量明显增大,NIPs的吸附容量则增大缓慢。这说明MIPs对HJMS有较强的特异性结合能力,而空白印迹聚合物的这种能力很弱[22],这是因为替代模板分子在MIPs中留下了对HJMS有特异识别性的空间结构及结合位点,而NIPs对HJMS的吸附作用主要是分子间作用力。实验测定了花椒麻味物质在MIPs和NIPs上的结合等温线,MIPs的拟合等温吸附方程为y=1.363+66.127x-42.509 9x2,NIPs的拟合等温吸附方程为y=1.357 2+29.836 4x-43.735 0x2,其中y表示吸附容量Q,x表示花椒麻味物质的初始浓度C,该拟合等温吸附方程为研究MIPs对HJMS的特异性吸附能力、对其进行定量分析构建了理论模型。

图6 MIPs和NIPs对花椒麻味物质的吸附等温曲线Fig.6 The adsorption isotherms of MIPs and NIPs to HJMS
2.6 MIPs对花椒麻味物质的Scatchard模型分析
由图7可知,MIPs吸附花椒麻味物质的Scatchard曲线,整体上呈非线性关系,可分为2段,2条斜率不同的直线均呈现良好的线性关系。在质量HJMS浓度为0.05~0.30 mg/mL时,MIPs对HJMS形成高亲和性结合位点和低亲合性结合位点[23],其原因是在聚合过程中,替代模板分子与功能单体形成比例不同的复合物,使非共价结合作用力的大小不均匀[24]。以这两段线性关系为依据,分别进行线性拟合,得到MIPs的Scatchard拟合方程Q/C=267.206 6-15.280 5Q(R2=0.999 7)和Q/C=145.829 9-3.239 3Q(R2=0.969 5),其中Q为MIPs对花椒麻味物质的吸附容量、C为吸附平衡时花椒麻味物质的质量浓度。由Scatchard曲线(图6)的斜率和截距计算可得:高亲和力结合位点的离解常数为Kd1=6.544×10-2mg/mL,结合位点最大结合量为Qmax1=17.487mg/g;低亲和力结合位点的离解常数为Kd2=3.087×10-1mg/mL;结合位点最大结合量为Qmax2=45.019 mg/g。NIPs的Scathcdard模型可拟合成一条直线,这是因为NIPs只存在一种非特异性的吸附位点[25]。

图7 分子印迹聚合物对HJMS的Scatchard分析图Fig.7 Scatchard Plots Analysis of MIPs and NIPs for HJMS and LM2
3 结论
本实验采用成功合成的LM2为替代模板分子,本体聚合的方法制备了MIPs,MIPs与HJMS接触时间约10 h可达到吸附平衡,对花椒麻味物质特异因子α可达到2.53;在吸附过程中HJMS与MIPs形成两种结合位点,高亲和力结合位点的离解常数为Kd1=6.544×10-2mg/mL,结合位点最大结合量为Qmax1=17.487 mg/g;低亲和力结合位点的离解常数为Kd2=3.087×10-1mg/mL,结合位点最大结合量为Qmax2=45.019 mg/g;结果表明,MIPs对花椒麻味物质表现出优异的特异性吸附能力。

