清香型白酒发酵过程中微生物种群空间分布
王雪山,杜海,徐岩*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,酿酒科学与酶技术中心,江苏 无锡,214122) 2(宿迁市江南大学产业技术研究院,江苏 宿迁,223814)
白酒是我国传统蒸馏酒,酿造历史悠久,其以酒曲(大曲、小曲或麸曲)为糖化发酵剂,将粮谷原料(高梁、大米、糯米、玉米等)通过边糖化边发酵的双边固态发酵后,通过固态蒸馏、贮存勾兑,最终形成含有上千种微量组分的蒸馏酒[1]。由于固态发酵时酒醅物料的异质性,酒醅内部存在着复杂的固-液、气-液、固-气等多种界面,促使不同位置酒醅内形成了丰富的微生物种群多样性及代谢特征多样性[2]。
由于白酒固态发酵过程中微生物分布的不均一性对白酒品质具有影响,国内开展了大量针对白酒酿造微生物空间分布的研究。如陈林等结合微生物培养和变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)等技术分析酱香窖池中不同层次酒醅微生物组成,认为不同层次酒醅中霉菌、细菌、酵母组成各不相同[3]。胡峰等结合微生物分离培养技术与风味分析手段分析不同层次酱香型白酒酒醅,认为上层酒醅的细菌、霉菌和酵母含量均高于中、下层酒醅,且微生物含量的差异造成了不同层次白酒风味特征的差异[4]。吴衍庸等利用传统培养技术分析不同位置窖泥中细菌种群结构,结果表明窖泥中己酸菌和甲烷菌含量随窖池上、中、下位置顺序递增[5]。然而传统的可培养方法及PCR-DGGE等分子方法费时费力,且对微生物种群结构的认识较有局限性。随着测序技术的进步,高通量测序手段的应用进一步推动了对白酒酿造微生物的研究。如WANG等通过焦磷酸测序技术分析不同年份、不同位置窖泥的细菌种群结构,结果表明窖泥从上到下芽孢杆菌属和梭菌属含量逐渐上升,而乳杆菌属含量逐渐下降[6]。
清香型白酒是中国白酒四大主要香型之一,目前国内对清香型白酒酿造微生态的研究多数是针对发酵过程中酒醅微生物种群演替的研究。如韩莎等通过可培养技术分析汾酒酿造过程中微生物群落结构,并找出微生物种群与代谢物之间的关系[7]。LI等基于核糖体高通量测序分析汾酒发酵过程中的微生物,认为汾酒发酵过程中主要细菌主要是乳杆菌科,真菌主要是酵母科和复膜孢酵母科[8]。仅有雷振河通过高通量测序手段分析清香型白酒地缸中心与边缘位置酒醅微生物种群结构差异[9]。然而其研究缺少针对上、中、下位置酒醅的分析,而且其仅分析发酵10 d的酒醅,缺乏对不同位置酒醅整个酿造过程微生物演替规律差异的解析。
本研究以清香型白酒发酵过程中酒醅为对象,通过高通量测序技术解析不同位置酒醅中微生物种群组成及结构差异,有助于提升白酒酿造可控性及白酒品质稳定性。
1 材料与方法
1.1 酒醅样品采集
样品采集自某清香型白酒发酵过程中0、4、8、15和27天酒醅。每个时间点(0天除外)分别采集酒醅面层(上)、面层往下约50 cm处(中)及底层(下)3个层次的酒醅样品。清香型白酒地缸中心位置与边缘位置微生物种群结构存在差异[9]。因此本研究样品采集时,每个层次采集中间和边缘位置混合作为一个样品以表征每一层次酒醅的综合情况,以此研究上、中、下不同空间位置酒醅发酵过程中微生物种群演替差异。每份样品采集500 g,于-80 ℃保存备用。
1.2 酒醅理化指标检测
酒醅基本理化指标检测方法参考文献[10],大致流程如下:
(1)温度测定:样品采集同时将温度计插入取样点附近,保持1 min左右,至温度计读数稳定后,记录温度数据。
(2)pH测定:称取10 g酒醅加入装有50 mL超纯水的三角瓶中,充分振荡摇匀后,用pH计直接检测。
(3)含水量测定:称取10 g酒醅样品,于105℃烘箱中烘干4 h,根据酒醅烘干前后的重量计算酒醅的含水量。
(4)酒醅乙醇含量测定:乙醇含量的检测参考WU等报道的方法[11],乙醇定量采用外标法,标准曲线为:y=0.000 04x-0.041 9,R2=1.000 0,x为峰面积,y为乙醇质量浓度(g/L)。
1.3 样品宏基因组提取
基因组提取采用间接提取法,首先通过0.1 mol/L PBS缓冲液(0.057 7 mol/L Na2HP04,0.042 3 mol/L NaH2PO4)收集菌体[12]。然后通过Omega EZNATM土壤基因组提取试剂盒完成基因组提取,步骤参考操作说明书。
1.4 PCR扩增及Illumina Miseq测序
通过细菌16S rRNA基因V3-V4可变区研究细菌种群结构,以F338(5’-ACTCCTACGGGAGGCAGCAG-3’)和R806(5’-GGACTACHVGGGTWTCTAAT-3’)为引物对酒醅基因组进行扩增[13]。扩增产物回收、定量后按照所需数据深度进行建库,然后在Illumina Miseq平台上进行2×300 bp双端测序。通过真菌内转录间隔区(ITS)ITS2区研究真菌种群结构,以ITS3(5’-GCATCGATGAAGAACGCAGC-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)为引物对酒醅基因组进行扩增[14]。扩增产物回收、定量后按照所需数据深度进行文库制备,然后在Illumina Miseq平台上进行2×250 bp双端测序。
1.5 高通量数据分析
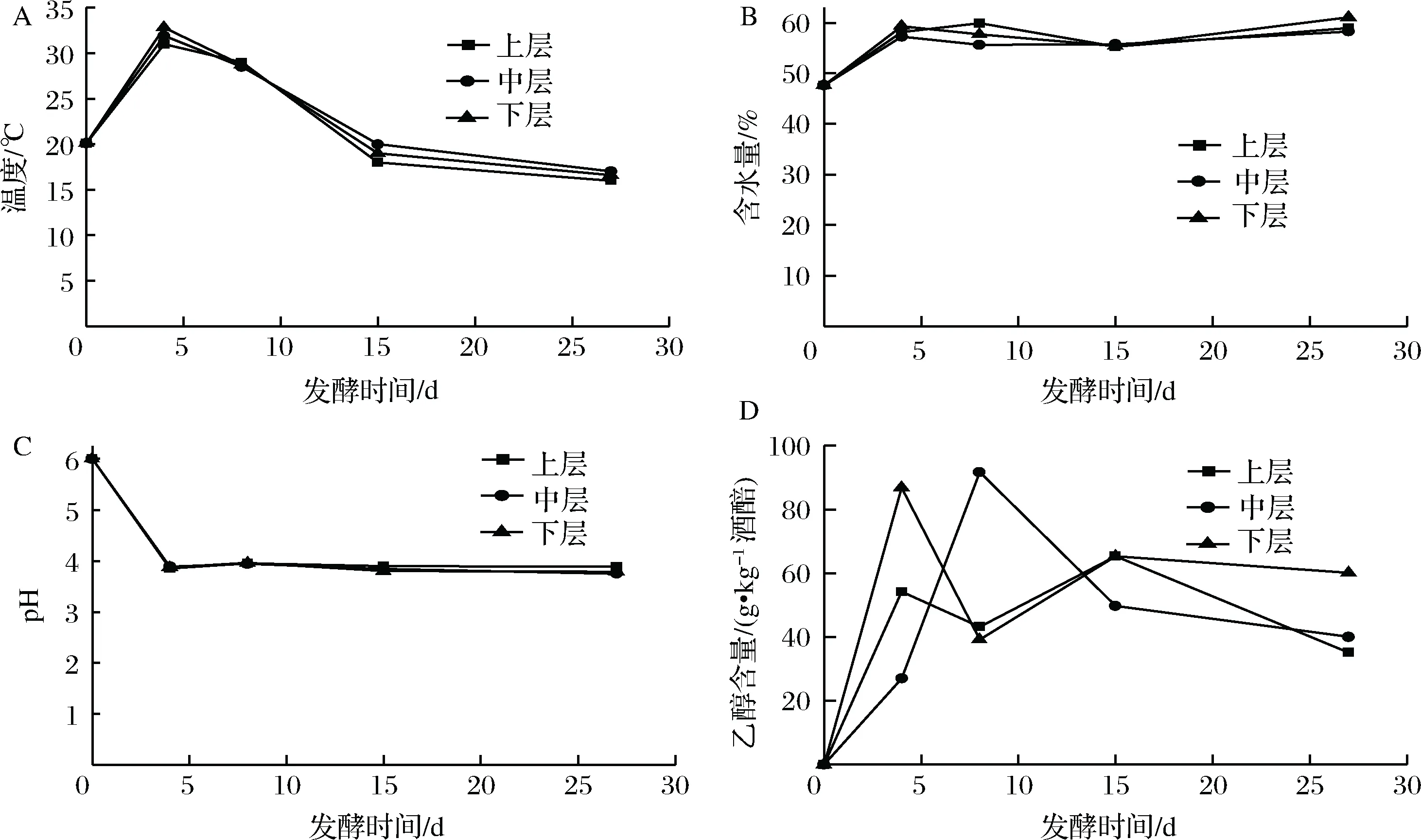
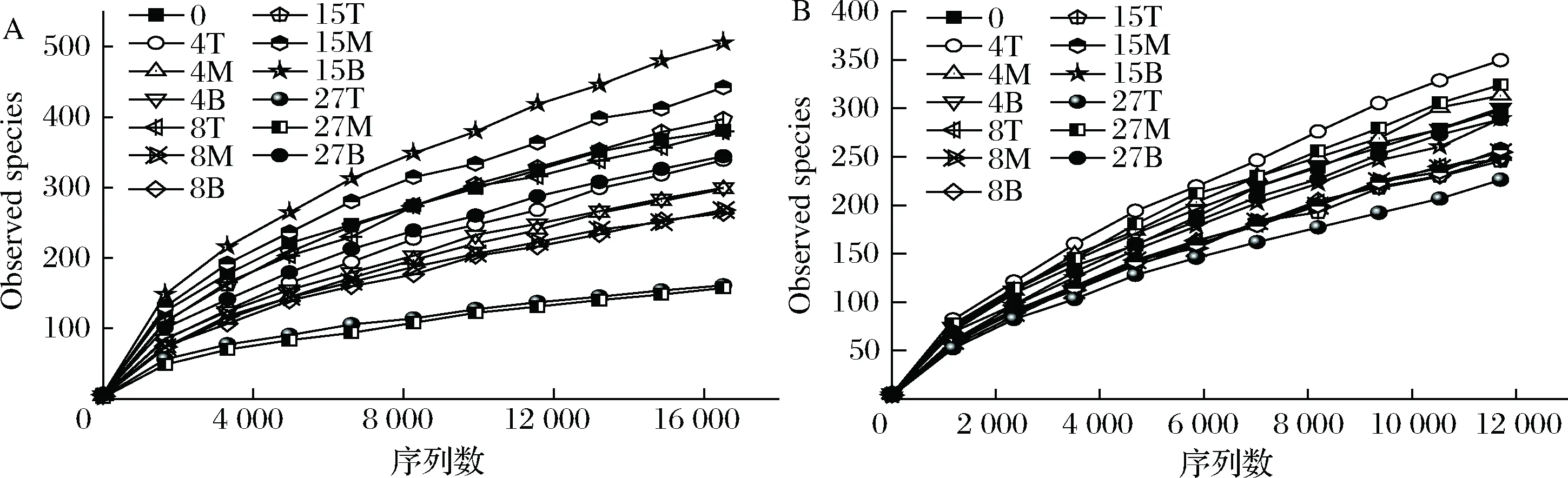
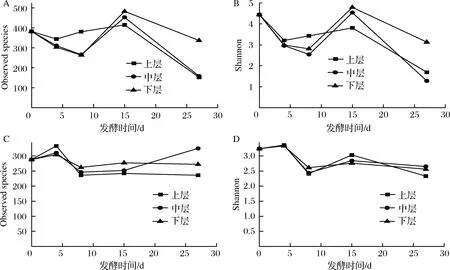
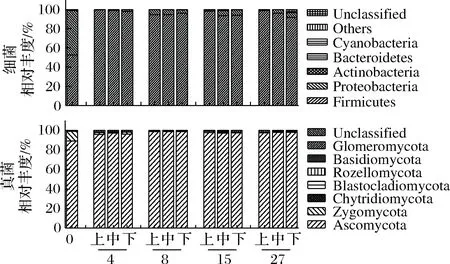
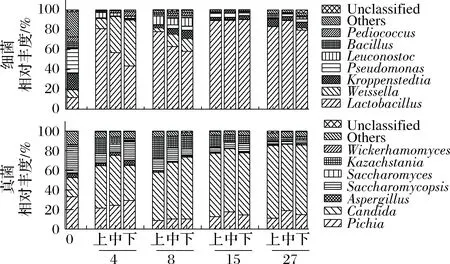
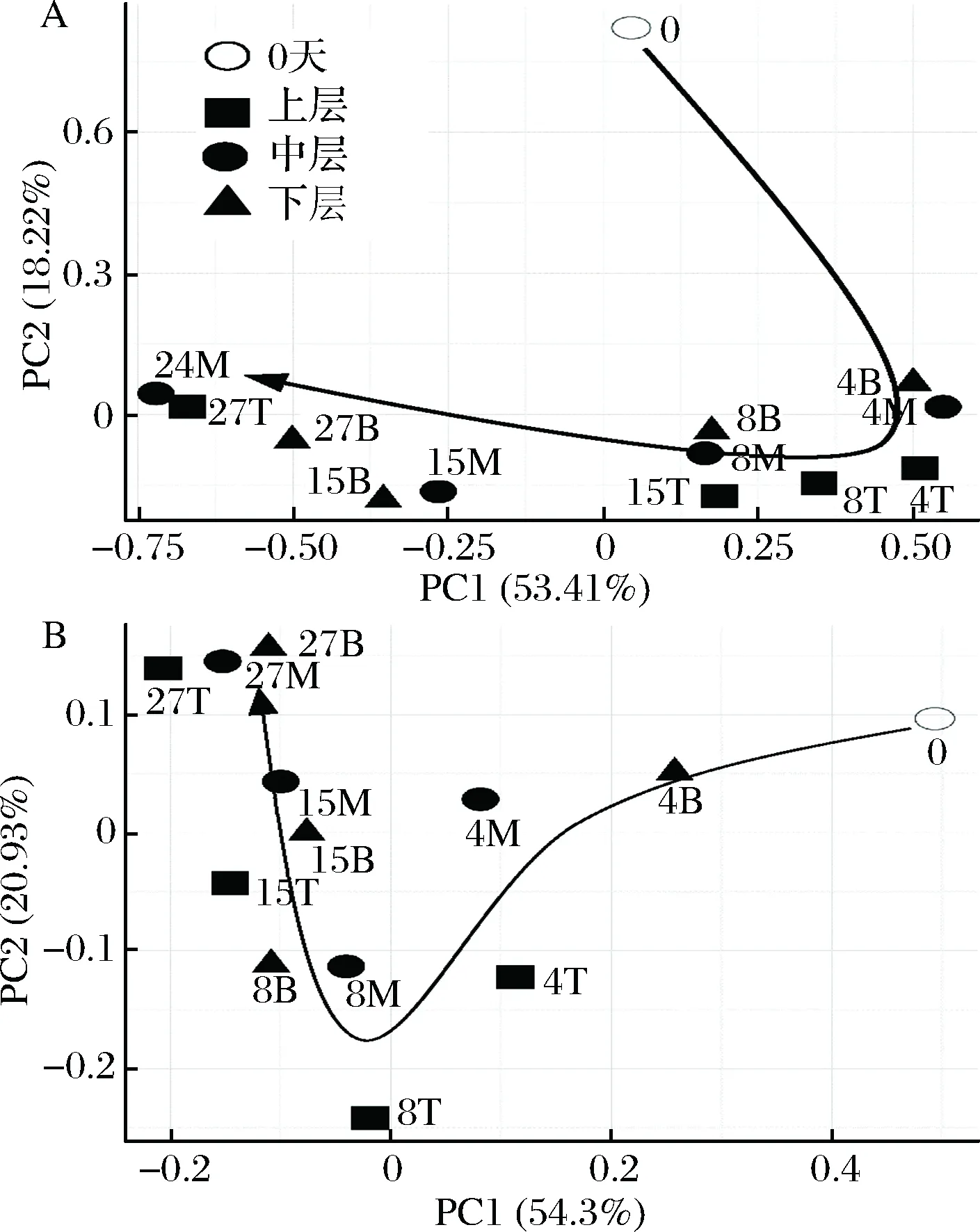
数据下机后,通过Qiime(v1.8.0)进行原始数据处理[15]。根据序列重叠区域序列拼接,根据Barcode将不同样品序列进行归类。去除序列中接头、标签及引物序列,通过split分析去除低质量序列(长度<150 bp、含有模糊碱基N、序列质量得分 酒醅发酵理化指标对分析酒醅发酵状态至关重要[21-23]。由图1可知,不同位置酒醅发酵初始温度为20.1 ℃,初始含水量为47.63%,初始pH为6.0,符合正常发酵工艺参数[8, 24]。另外,发酵4 d时,酒醅温度达到顶点,说明此时酒醅中微生物代谢速率最快,随后微生物代谢逐渐减缓。发酵27 d时酒醅温度仅16.6~17.0 ℃,说明此时发酵基本结束。不同位置酒醅在发酵过程中温度、含水量及pH变化规律基本一致,然而乙醇代谢有较大差异。下层酒醅发酵4 d时,乙醇含量达到顶点86.84 g/kg酒醅,发酵8 d时降低,然后发酵结束时含量为60.15 g/kg酒醅。中层酒醅发酵8 d时乙醇产量达到顶峰91.67 g/kg酒醅,随后含量下降至40.00 g/kg酒醅。然而上层酒醅发酵15 d时乙醇产量才达到顶峰65.42 g/kg酒醅。这表明上层酒醅乙醇产生速率低于中、下层酒醅。 图1 酒醅发酵过程中理化指标变化规律Fig.1 Changes of physicochemical indexes in fermented grains during fermentation 通过基于Miseq平台的扩增子测序技术,共检测13个酒醅样品。稀释曲线是表征样品测序结果是否能够反映样品实际生物信息的分析方式[25-26]。本研究稀释曲线分析表明所有样品细菌16S rRNA基因和真菌ITS基因测序都达到或接近平台期,说明本次测序可覆盖样本中绝大多数微生物种群信息(图2)。 图2 酒醅发酵过程中细菌(A)和真菌(B)测序稀释曲线Fig.2 Rarefaction curves of bacterial (A) and fungal (B) community in fermented grains during fermentation(注:0、4、8、15、27为发酵时间(天);T、M、B为上、中、下位置酒醅。) 本研究通过Shannon指数和物种数目(observed species)表征样品微生物α多样性[27]。结果表明酒醅发酵前15 d,不同层次酒醅细菌种群多样性均高于真菌种群多样性,这一点与以往研究结论一致[8-9]。发酵0~4 d时,不同层次酒醅细菌多样性均呈现下降趋势,发酵4~8 d时上层酒醅细菌多样性高于中层和下层酒醅。上层酒醅细菌种群多样性高于中、下层的现象在胡峰等对酱香型白酒的研究中同样有过报道[4]。这个现象与图1-D中酒醅乙醇浓度变化规律相符,发酵4~8 d时中、下层酒醅乙醇浓度高于上层酒醅,而酒醅中高浓度的乙醇会抑制酒醅中不耐醇的微生物生长,造成中、下层酒醅中细菌多样性低于上层酒醅。随着发酵进行,发酵15 d之后,上、中、下3个层次酒醅细菌种群多样性全部降低(图3-A和B),这可能是发酵后期酒醅中高醇、高酸的环境抑制了酒醅中大部分细菌种群的生长。然而真菌多样性在发酵0~8 d时呈现先上升后下降的趋势,不同层次酒醅真菌多样性差别没有明显规律(图3-C和D)。 图3 酒醅发酵过程中细菌(A、B)和真菌(C、D)多样性分析Fig.3 Diversity of bacterial (A, B) and fungal (C, D) community in fermented grains during fermentation 高通量测序显示所有酒醅中的细菌种群可归属于17个门,其中平均相对丰度>0.1%的仅有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)及蓝细菌门(Cyanobacteria)。所有酒醅中的真菌种群可归属于7个门,分别为子囊菌门(Ascomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)、芽枝霉门(Blastocladiomycota)、担子菌门(Basidiomycota)及球囊霉门(图4)。 图4 酒醅发酵过程中细菌和真菌种群结构(门水平)Fig.4 Bacterial and fungal community structure in fermented grains during fermentation (at phylum level) 然而,图4表明门水平酒醅细菌及真菌种群在空间位置上没有明显差异,仅存在演替变化。发酵开始时期,厚壁菌门(相对丰度52.75%)和变形菌门(46.02%)在酒醅中占主导地位。LI等通过焦磷酸测序分析汾酒酒醅发酵过程中同样认为这两个门是酒醅中主要的细菌种群[8]。同时,这两个门的微生物同样是浓香[10, 28-29]、酱香[30]及芝麻香[29]白酒发酵过程中的主要细菌种群,说明这些细菌种群是中国白酒发酵过程中的关键微生物。此外,图4表明发酵4 d之后,酒醅中厚壁菌门(91.73%~99.58%)占绝对主导地位,这种现象与其他香型白酒相关研究都是一致的[8, 10, 28-30]。这个现象表明,白酒发酵过程中由多菌种演替为单一的厚壁菌门为主导的发酵模式是白酒固态发酵的典型模式。 真菌种群中子囊菌门在所有酒醅中占主导地位(相对丰度89.04%~98.72%)(图4)。接合菌门仅发酵0天时丰度较高(9.99%),发酵4天之后丰度逐渐降低。以往研究表明,子囊菌门不仅是清香型酒醅中优势真菌种群[8],同样也是浓香[31]、酱香型白酒[11]及食醋[32]、面包[33]等多种发酵食品中的主要真菌种群。 属水平共检测到161个细菌属,其中仅18个属在所有样品中都能检测到(图5)。酒醅中优势细菌属(平均相对丰度>1%)为7个,包括乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、Kroppenstedtia、假单胞菌属(Pseudomonas)、明串珠菌属(Leuconostoc)、芽孢杆菌属(Bacillus)及片球菌属(Pediococcus)。发酵开始时(0天),酒醅中假单胞菌属相对丰度最高(25.00%),其次是Kroppenstedtia(16.29%)、乳杆菌属(11.61%)、魏斯氏菌属(8.03%)、芽孢杆菌属(6.50%)及片球菌属(4.95%)。假单胞菌属一般情况属于条件致病菌,一般仅在大曲和发酵初期酒醅中能检测到,不利于白酒酿造[34]。芽孢菌属则可以代谢蛋白酶、淀粉酶等多种水解酶类,同时可代谢产乙偶姻、4-甲基吡嗪等风味物质[35]。发酵4 d时,酒醅中假单胞菌属、Kroppenstedtia及芽孢杆菌属相对丰度均下降至低于1%,而乳杆菌属、魏斯氏菌属和明串珠菌属相对丰度均上升。而乳杆菌属、魏斯氏菌属和明串珠菌属可代谢产生乳酸、乙酸等有机酸类物质,是造成白酒发酵前4 d pH下降的主要原因(图1-C)。酒醅中低的pH和高浓度的乙醇一方面可以抑制酒醅中假单胞菌属等不耐酸的杂菌,另一方面乳酸、乙酸等物质也为白酒中风味物质提供合成前体[8, 28]。而随着发酵继续进行,酒醅中乳杆菌属成为主要细菌种群,相对丰度为58.02%~90.08%,而魏斯氏菌属及明串珠菌属在发酵15 d后相对丰度降至低于1%。魏斯氏菌属及明串珠菌属均属于明串珠菌科细菌,雷振河关于汾酒酒醅微生物种群分析中同样表明明串珠菌科细菌是发酵10 d酒醅时的优势细菌种群(相对丰度5.5%~8.6%)[9]。然而LI等在夏季汾酒酒醅的研究中表明,明串珠菌科细菌丰度<1%,发酵5 d后酒醅中细菌种群已经演替为乳杆菌科为主导菌群的细菌种群结构[8]。产生这种差异的原因可能是取样季节不同,本研究取样季节为冬季,而不同季节对酒醅中微生物种群结构有较大影响。但是以上研究也都表明,即使发酵前期不同酒醅细菌种群结构有一定差异,然而发酵后期酒醅中优势细菌种群都是乳杆菌属。 图5 酒醅发酵过程中细菌和真菌种群结构(属水平)Fig.5 Bacterial and fungal community structure in fermented grains during fermentation (at genus level) 真菌ITS测序同样检测到161个真菌属,其中34个属在所有样品中都能检测到(图5)。酒醅中优势真菌属(平均相对丰度>1%)为5个,包括毕赤酵母属(Pichia)、假丝酵母属(Candida)、曲霉属(Aspergillus)、复膜酵母属(Saccharomycopsis)和Kazachstania。而以往研究中[37]认为对清香型白酒酿造比较重要的酵母属(Saccharomyces)和维克汉姆酵母属(Wickerhamomyces)平均相对丰度仅为0.76%和0.19%。发酵开始时酒醅中毕赤酵母属丰度最高(32.96%),其次是复膜酵母属(27.53%)、假丝酵母属(19.53%)、曲霉属(4.00%)和Kazachstania(1.85%)。以往研究同样表明假丝酵母属和毕赤酵母属清香型白酒发酵过程中的优势种群,同时也是清香型白酒中代谢产乙醇和产酯的主要功能微生物[9]。曲霉属和复膜酵母属代谢产生多种蛋白酶、水解酶类[36],其中复膜酵母属在夏季汾酒酒醅中同样是优势种群[8]。发酵4 d之后,酒醅中低的pH和高浓度的乙醇使酒醅中曲霉属及复膜酵母属相对丰度降低,而假丝酵母属与Kazachstania相对丰度升高。发酵终点(27 d)时,曲霉属相对丰度降低至0.67%~1.83%,复膜酵母属相对丰度降低至2.19%~3.21%,而酒醅中耐醇耐酸的毕赤酵母属(11.08%~18.60%)和假丝酵母属(67.79%~74.13%)成为酒醅中优势真菌种群。此外,酒醅中Kazachstania相对丰度发酵8 d时升至最高(11.41%~21.89%),随后降低至2.06%~3.53%。本研究中假丝酵母相对丰度与雷振河关于汾酒酒醅研究比较接近[9],显著高于LI研究中报道的丰度[8],这进一步说明不同季节对酒醅中细菌、真菌种群结构都有较大影响。 同时从图5可看出,发酵4~8 d时上层酒醅细菌和真菌种群结构与中、下层都有较大差异。其中上层酒醅中魏斯氏菌属和毕赤酵母属相对丰度均低于中、下层酒醅,而乳杆菌属和Kazachstania相对丰度均高于中、下层酒醅。魏斯氏菌属属于异型发酵乳酸菌,可以代谢产生D型乳酸、乙酸、乙醇等[38],毕赤酵母属可以代谢产生乙醇、多种酯类和芳香族化合物[8, 37]。因此不同层次酒醅中的微生物种群结构差异势必会造成不同层次酒醅风味代谢的差异。 本研究通过PCA分析进一步说明不同层次酒醅之间微生物演替差异,结果显示不同层次酒醅细菌(图6-A)和真菌(图6-B)种群演替都存在一定差异。图6-A显示,发酵4~15 d时,上层酒醅细菌种群与中、下层都存在明显差异,中、下层酒醅细菌种群演替规律较接近。上层酒醅发酵15 d时,其细菌种群与中、下层酒醅发酵8 d的比较接近,这表明上层酒醅发酵速率要慢于中、下层酒醅。而不同层次酒醅真菌种群也呈现类似的规律,即上层酒醅真菌种群与中、下层有较大差异。同时,图6显示发酵结束时不同层次酒醅细菌、真菌种群趋于一致,这也解释了清香型白酒发酵27 d左右的合理性。这种现象与酒醅中乙醇产生速率相吻合,同样是上层酒醅乙醇产生速率低于中、下层酒醅。这表明不同层次酒醅微生物种群结构及演替差异会对酒醅中物质代谢产生较大影响。 图6 酒醅细菌(A)和真菌(B)种群主成分分析Fig.6 Principal component analysis (PCA) of bacterial(A) and fungal (B) community in fermented grains[注:0、4、8、15、27为发酵时间(d);T、M、B为上、中、下位置酒醅] 本研究利用高通量测序技术分析不同层次清香型白酒酒醅中微生物种群结构及演替规律,共检测到161个细菌属和161个真菌属,其中乳杆菌属、毕赤酵母属和假丝酵母属是酒醅中的绝对优势微生物。不同层次酒醅微生物多样性变化规律不同,而且微生物种群结构及演替规律存在明显差异,微生物种群演替差异最终影响到酒醅中乙醇代谢的效率。 由于酒醅固态发酵过程中微生物分布不均一性较强,通过高通量测序技术高效的解析不同层次酒醅中微生物种群结构对判断酒醅发酵阶段有重要价值。然而本研究仅针对酒醅微生物种群结构差异分析,后续需要进一步结合代谢组学方法分析不同层次微生物结构差异对酒醅风味代谢的影响。2 结果与分析
2.1 不同位置酒醅发酵过程中理化指标差异
2.2 不同位置酒醅发酵过程中微生物多样性差异
2.3 不同位置酒醅微生物种群结构差异
2.4 不同位置酒醅发酵过程中微生物种群演替规律差异
3 结论

