高通量测序研究李氏禾生态浮床净化污水的微生物群落结构变化
李 杨,王 芳,杨海滟,潘 珉 ,杜劲松*
(1.昆明市滇池生态研究所,云南 昆明 650228;2.西南林业大学林学院 国家林业局西南地区生物多样性保育重点实验室,云南 昆明 650224;3.西南林业大学 云南省高校生物质化学炼制与合成重点实验室,云南 昆明 650224)
【研究意义】中国许多湖泊存在水质污染和生态退化等突出问题,水体富营养化与难降解有机物污染是水污染治理的难题。据报道,中国大约75 %的地表水体不同程度的受到氮、磷、重金属、有机污染物等污染,严重危害水生态系统的健康,威胁经济发展与人民健康。因此,解决湖泊的污染、恢复水体的良好生态是可持续发展亟待解决的关键任务之一。【前人研究进展】湖泊污染治理是政府和学界关注的热点,目前污水治理的技术主要有3方面,一是截污减排,通过截污、节水与污水回用技术减少污水入湖总量;二是提高水体自净能力,包括水系疏通、生态护坡、生态修复技术等恢复水生态提高自净能力;三是底泥治理,包括物理方法、化学方法、生物方法等。每种技术各有其优缺点,而针对中国湖泊目前存在的问题,迫切需要迅速改善污染水质,修复受损的湖泊生态系统,提高水体自净能力,促进生态系统良性循环。随着生物技术和生物科学的不断进步,生物修复的优势逐渐被人们所认知,水体和污染底泥生态系统的生物修复已成为湖泊修复的热点,具有广阔的市场发展前景。针对不同区域水污染特征,选择廉价、高效且无二次污染的水污染修复技术,对于水体的修复净化具有重要的意义。李氏禾(LeersiahexandraSwartz)又名秕壳草,在热带及亚热带地区广泛分布,为多年生禾本科草本植物,具发达匍匐茎和细瘦根状茎,有顽强的生命力,已有研究表明可生长于河道边、湖边,对重金属、富营养化水体有良好的净化作用,是修复湖泊、河流的优良植物[1-2]。本研究表明,在生物修复方法即种植李氏禾的同时,辅以物理修复如曝气或缺氧处理可提高李氏禾对污染水体COD或TP的去除率,对提高污水净化效果具有重要作用,同时在污染物的去除过程中微生物群落也发挥着至关重要的作用[3]。【本研究的切入点】关于在种植李氏禾+氧气处理条件下,污水中的微生物发生了怎样的变化?哪些微生物在污水净化过程中发挥着重要功能?是否随着污水处理时间发生动态变化?仍然是未知。在生物修复,联合物理修复过程中,开展污水中功能微生物群落的研究有助于深入揭示污水净化的生物学机理,为指导湖泊、河道的修复奠定理论与实践基础。【拟解决的关键问题】通过高通量基因测序Illumina Miseq技术研究修复污染水体的功能微生物群落,相比传统技术,可更全面地揭示污水净化中的功能微生物。此技术克服了传统分离方法只获得少量微生物的局限性,超越了DGGE、T-RFLP、克隆文库方法的通量。应用此技术比较分析静态污水、污水中设置李氏禾生态浮床、李氏禾生态浮床+曝气以及李氏禾生态浮床+缺氧处理几种污水净化体系中功能微生物群落的差异及其随时间的动态变化,揭示污水的生物净化机理,为将来的污水治理实践提供理论指导。
1 材料与方法
1.1 试验材料
试验植物为李氏禾,采自西南林业大学人工模拟湿地,污水由绿化中水加4 mg/L KNO3(氮源)与0.4 mg/L NaH2PO4(磷源)配制而成。共设4组生态浮床静态污水试验检测不同处理对模拟污水的净化效果,包括处理A,对照,模拟污水样本,未种植李氏禾;处理B,污水中种植李氏禾;处理C,污水中种植李氏禾+曝气(O2);处理D,污水中种植李氏禾+缺氧处理。生态浮床构置如下:体积30 L塑料整理箱,加入20 L模拟污水,在2 cm泡沫浮床上种植6株李氏禾、间距12 cm,每组样品3个重复。曝气处理用氧气泵每天上午、下午分别充氧1 h;缺氧处理将李氏禾根部采用保鲜膜包裹。静态水试验共进行14 d,分别于1、3、7、14 d取样,测定水体中总氮TN(Total Nitrogen)、总磷TP(Total Phosphorus)、化学耗氧量COD(Chemical Oxygen Demand)以及水体中微生物群落的变化,检测不同处理对模拟污水的净化效果。
1.2 研究方法
污水净化指标TN、TP、COD的测定依据传统方法进行[4],水体中的微生物群落通过微孔滤膜过滤污水获得后,采用环境样本DNA提取试剂盒(ZYMO Research 公司)进行基因组DNA抽提,使用0.8 %琼脂糖凝胶电泳检测基因组DNA的完整性。采用具有Barcode 标记的引物515F与806R对细菌16S rRNA V4区进行扩增。PCR扩增采用TOYOBO KOD-Plus-Neo DNA聚合酶,每个样本进行3次PCR重复,扩增后将样本混合并通过凝胶纯化试剂盒纯化(QIAGEN 公司),用2 %琼脂糖凝胶电泳检测纯化效果。用Qubit 2.0对纯化后的PCR产物进行定量,使用Illumina公司的试剂盒TruSeq DNA PCR-Free Sample Prep kit(FC-121-3001/3002)进行文库构建,应用高通量Illumina Miseq测序的方法,对不同处理水体中的微生物群落进行分析。
1.3 数据统计分析
微生物的多样性采用观测微生物的多样(OTU 数目)与Chao1、Shannon(香农-维纳指数))、Simpson(辛普森多样性指数)、PD(谱系多样性指数)分析方法进行评估。微生物的分类在97 %相似水平上,使用UPARSE算法进行OTU的分析。作图应用R3.2.1软件完成,不同处理对污染水体中功能微生物群落组成的影响采用主坐标分析(principal coordinate analysis,PCOA)以及聚类分析方法进行分析比较。基于Heatmap分析每个处理中优势的菌属,应用Boxpot图分析不同处理中的优势菌种。
2 结果与分析
2.1 不同处理对李氏禾净化污水效果的影响
模拟污水空白对照对COD、TN与TP的去除效率最低,种植李氏禾可明显提高污水的净化效果,COD、TN与TP去除率分别提高12.5 %、25.0 %与40.9 %(表1)。种植李氏禾、种植李氏禾+曝气、种植李氏禾+缺氧3个处理均对污水中TN去除达到理想的效果。种植李氏禾+曝气处理,对COD的去除率最高,可达到93.6 %;相比之下,种植李氏禾+缺氧处理,对TP的去除效果最好(表1)。李氏禾的生长,需要氮磷等营养物质,因此可提高去除污水中的氮磷。同时,李氏禾在生长过程中,根系分泌物刺激污水中微生物的生长,对污水中的微生物具有筛选和富集作用,微生物群落的变化可影响水中COD的去除。曝气处理,增加污水中的溶氧,有助于好氧微生物的生长,氧气的增加也会加速好氧的化学反应进程,因此种植李氏禾+曝气处理明显提高COD的去除能力。在缺氧处理中,李氏禾根系包裹保鲜膜,影响根系分泌物与污水中的微生物的接触,进而影响污水中微生物组成,这种根际微生态环境刺激了一些磷代谢相关微生物的繁殖,从而有利于污水中磷源的去除。由此可知,在污染湖泊或河道水体净化及修复过程中,可预先对湖泊中水体的污染物进行检测分析,若COD含量高,可采用种植李氏禾处理联合应用曝气装置系统,加速COD的去除;若水体中磷源含量高,则可在种植李氏禾的同时,适当进行缺氧处理,以增加磷的去除。
2.2 不同处理条件下,李氏禾根际水体中微生物多样性的变化
不同处理的多样性分析研究表明,观测微生物的多样性(OUT 数目)与Chao1、Shannon(香农-维纳指数)、Simpson(辛普森多样性指数)、PD(谱系多样性指数)分析的多样性结果基本一致(图 1)。污水空白对照(即第1 d的水样中未种植李氏禾)中微生物的多样性最高,对模拟污水试验处理,3 d后水样中未种植李氏禾(处理A)的微生物多样性急剧减少,处理时间延长到7或14 d,水样中的微生物多样性也没有明显增加。相比之下,种植李氏禾+曝气处理(处理C)在试验3 d时,李氏禾根际水体的微生物多样性最高,种植李氏禾(处理B)与种植李氏禾+缺氧(处理C)中微生物的多样性指标相似。处理时间延长到7或14 d时,单独种植李氏禾(处理B)的微生物多样性逐渐提高,可见随着曝气时间的增加曝气并未提高李氏禾根际水体微生物多样性;李氏禾缺氧处理(处理D)的根际微生物多样性呈现先降低后升高的趋势(图1)。研究表明,污水中的微生物多样性在处理的不同时间段,呈现动态的变化,可能受污水环境的多种因素影响,如营养盐、溶氧及植物等。新配制的模拟污水(处理A)中营养及氧气充足,在短时间内污水中会繁殖大量的微生物,因此在第1天,对照处理的微生物多样性最高;随着污水静态放置时间的延长,水中营养物质及氧气被微生物消耗降低,微生物之间产生竞争,因此微生物的多样性到第3天显著降低,随着时间的延长多样性增加不明显。污水中种植李氏禾(处理B),随着植物的生长,根系不断向水中分泌物质,提供了多样的营养物质类别,进而提高污水中微生物的多样性,微生物群落呈现出功能冗余现象,一类微生物因环境变化消失时,其功能可由其它微生物取代[4-6],因此种植李氏禾可提高污水中微生物抵御外界环境变化的能力,增加降解污水中污染物的潜力。污水中引种李氏禾联合曝气(处理C)时,李氏禾的根系分泌物以及曝气会缓解污水中营养物质的降低,有利于污水中的微生物生长,到第3天微生物的多样性最高;随着时间的延长多样性也逐渐降低,可能是由于曝气水中的溶氧选择富集了特异性好氧微生物群落。虽然种植李氏禾+曝气处理随着处理时间的延长,污水中的微生物多样性降低,但并未影响到TN及COD的去除能力,因此污水中微生物的多样性与TN和COD的去除无正相关性。
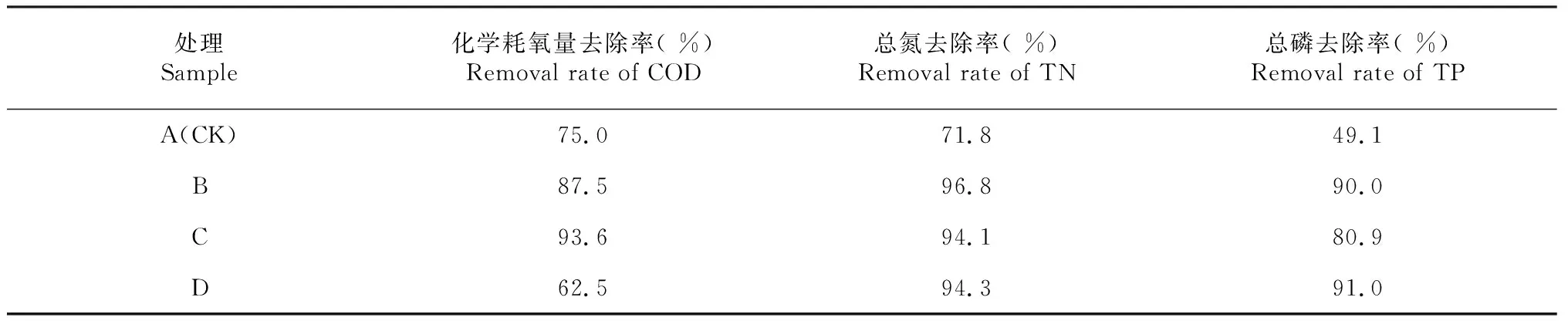
表1 不同处理李氏禾对污水的净化效果
注:处理时间为14 d。
Notes:The treatment time was 14 days.

图1 不同处理对李氏禾根际微生物多样性的作用及其随时间变化规律Fig.1 The effect of different treatments on the rhizosphere microbial diversity of Leersia hexandra Swartz and the microbial diversity changing with time
2.3 种植李氏禾、曝气及缺氧处理对水体中微生物群落的作用
比较种植李氏禾,李氏禾+曝气,李氏禾+缺氧3种处理对污染水体的净化作用,应用PCOA分析不同条件下水体中功能微生物群落组成的差异,PCOA的第一轴解释了微生物群落组成变化的20.5 %,第二轴解释了18 %。进一步分析结果表明模拟污水样品中第1天的微生物群落组成与其它的样品分开,说明处理时间、李氏禾种植及曝气、缺氧处理影响污染水体中微生物群落的分布。水体中的微生物群落随着处理时间的增加,呈现动态性变化,即3 d与7 d或14 d处理显著分开(图2),表明静态污水的处理时间对微生物群落的影响较大。但是无论在哪个处理时间段,未种植李氏禾与种植李氏禾+缺氧处理的微生物群落组成相似性较高;种植李氏禾与种植李氏禾+曝气处理的微生物组成更为相似(图2)。聚类分析图展示的结果与PCOA分析结果基本一致(图3)。种植李氏禾+缺氧处理与静态污水相比,虽然种植了李氏禾,但由于在李氏禾根际进行了包膜处理,一定程度上阻碍了根系与污水中微生物群落的接触,因此这两个处理中微生物群落的组成更为相似。相比之下,种植李氏禾与种植李氏禾+曝气处理,李氏禾的根系分泌物可以与污水中的微生物群落相互作用,且两种处理中均会增加污水中的溶氧,因此形成了相似的微生物群落组成。
2.4 不同处理条件下,水体中功能微生物群落的种属组成差异分析
试验模拟的污染水体中的微生物群落在门的水平上主要属于变形菌门(Proteobacteria),相对含量约占总微生物组成的50 %;其次是厚壁菌门(Fermicutes)与拟杆菌门(Bacteroidetes),分别约占35 %与10 %;其它的少量微生物属于放线菌门(Actinobacteria)及梭杆菌门(Fusobacteria)。种植李氏禾、李氏禾+曝气以及李氏禾+缺氧3种处理虽未显著改变水体中的优势微生物门类,但优势微生物的相对含量发生了明显的变化,新增了几种微生物门类,且随着处理时间的延长,呈现出一定的变化趋势(图4)。模拟的污水样品在静置3 d后,变形菌门(Proteobacteria)占绝大部分(约90 %),随着静置时间的延长放线菌门(Actinobacteria)的相对含量明显增加。缺氧处理对污染水体中微生物组成的影响与污染水体的静置处理变化趋势相似。对比之下,污水中种植李氏禾在3、7、14 d处理中拟杆菌门(Bacteroidetes)的相对含量明显增加,而厚壁菌门(Fermicutes)相对含量显著降低(图4)。种植李氏禾+曝气处理中拟杆菌门(Bacteroidetes)相对含量增加,厚壁菌门(Fermicutes)含量降低,同时曝气处理有利于疣微菌门(Verrucomicrobia)的生长繁殖(图4)。
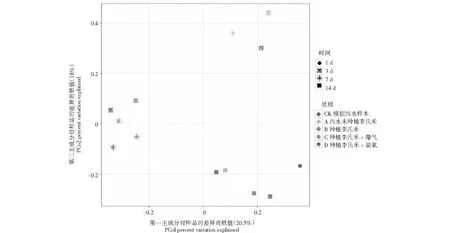
图2 PCOA 分析揭示不同处理对李氏禾根际微生物群落组成的影响以及微生物群落组成在不同处理时间的分布变化Fig.2 Effect of different treatments on Leersia hexandra Swartz rhizosphere microbial community composition and the dynamic variation of microbial composition with time displayed by PCOA analysis
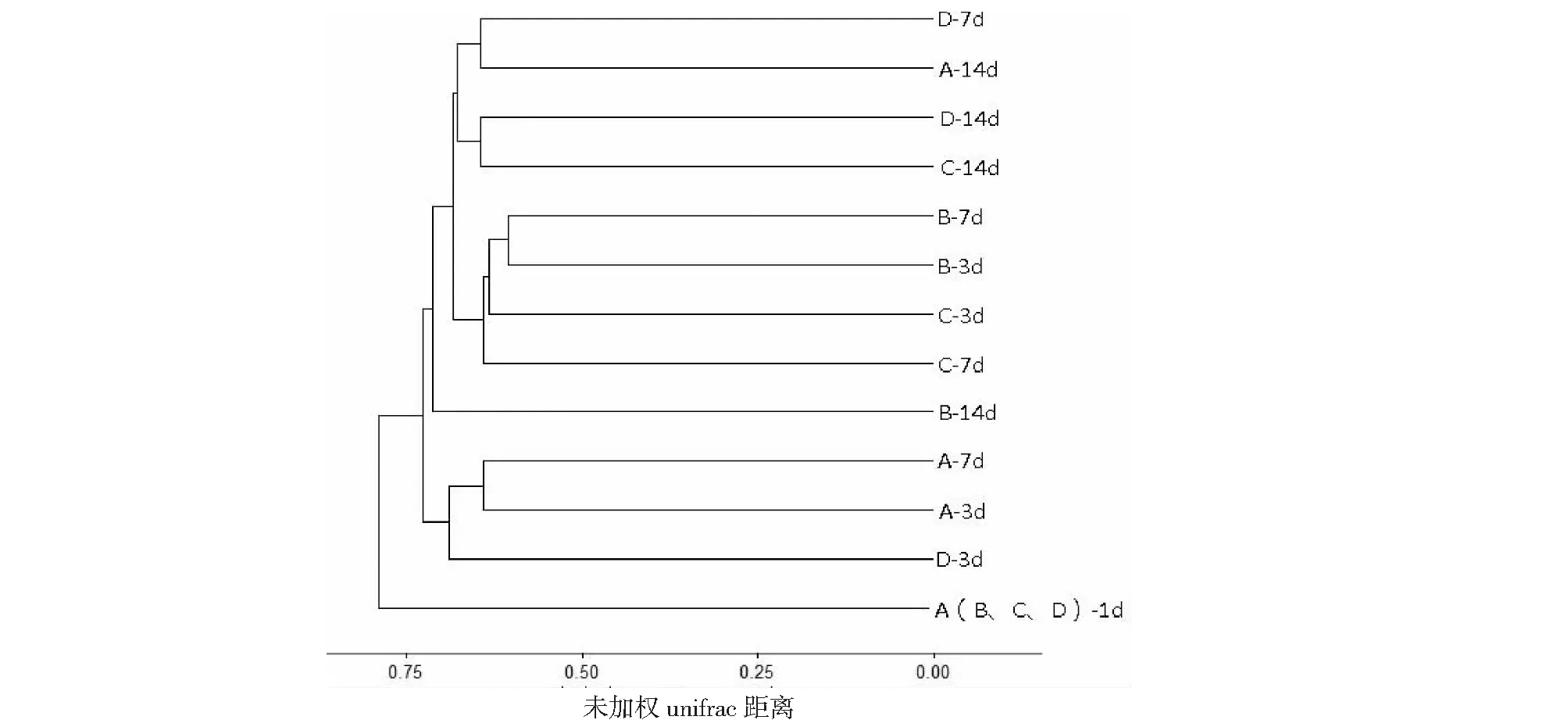
图右侧D-7d表示不同的处理-处理时间,下同The D-7d in the right of figure meant different treatments-different treatment time,the same was below图3 不同处理条件下李氏禾根际微生物群落聚类分析Fig.3 The cluster analysis of Leersia hexandra Swartz under different treatments
为揭示不同污水处理中发挥作用的功能微生物属,通过Heatmap图分析比较了种植李氏禾根际微生物的优势属,以及种植+曝气或缺氧处理条件下,李氏禾根际的功能微生物属差异(图5)。几个处理中的优势微生物菌属随污水处理时间的延长,均呈现出动态变化。在模拟污水样本中鞘氨醇单胞菌属(Sphingomonas)、乳酸杆菌属(Lactobacillus)、颤螺菌属(Oscillospira)、双歧杆菌属(Bifidobacterium)以及属于草酸杆菌科(Oxalobacteraceae)和根瘤菌目(Rhizobiales)的微生物菌属占优势地位。静置3 d后,污水样品中优势菌属变为假单胞菌属(Pseudomonas)、嗜甲基菌属(Methylotenera)、芽单胞菌属(Blastomonas)与莱茵海默氏菌属(Rheinheimera)。随着时间延长到7及14 d时,黄杆菌属(Flavobacterium)、噬氢菌属((Hydrogenophaga)与红杆菌属(Rhodobacter)成为最主要的微生物菌属。与污染水体对照相比,种植李氏禾的处理到第3天,黄杆菌属(Flavobacterium)、噬氢菌属(Hydrogenophaga)、假单胞菌属(Pseudomonas)与红杆菌属(Rhodobacter)即发展为优势菌属,此外海生杆菌属(Sediminibacterium)、Emticicia以及属于丛毛单胞菌科(Comamonadaceae)、赤杆菌科(Erythrobacteraceae)、醋酸杆菌科(Acetobacteraceace)与鞘脂杆菌目(Sphingobacteriales)的微生物发展为优势菌属(图5)。种植李氏禾+曝气处理中优势微生物菌属与单独种植李氏禾处理相似,曝气处理新增优势微生物为新鞘氨醇杆菌属(Novosphingobium)与苍黄杆菌属(Luteolibacter)的微生物。种植李氏禾+缺氧处理到3 d时,假单胞菌属(Pseudomonas)微生物为丰度最高的菌属;7或14 d时,黄杆菌属(Flavobacterium)与红杆菌属(Rhodobacter)均为优势菌属;此外,军团杆菌科(Legionellaceae)中的菌属为缺氧处理中特有的优势微生物。

图4 不同处理条件下李氏禾根际微生物群落组成差异(门水平)Fig.4 The microbial community composition differences (phylum level) of waterweed (Leersia hexandra Swartz) rhizosphere under different treatments
通过箱式图分析不同处理条件下,微生物在种水平上的差异及优势菌种。模拟污水的处理中,运动嗜甲基菌(Methyloteneramobilis)以及噬氢菌属(Hydrogenophaga)、鞘氨醇单胞菌属(Sphingomonas)与芽单胞菌属(Blastomonas)中不可培养的微生物为优势菌种。种植李氏禾的处理中,不可培养的微生物占优势,它们分属于噬氢菌属(Hydrogenophaga)、乳酸杆菌属(Lactobacillus)、红杆菌属(Rhodobacter)、海生杆菌属(Sediminibacterium)及赤杆菌科(Erythrobacteraceae);种植李氏禾+曝气与单独种植李氏禾处理的优势微生物菌种相似,丛毛单胞菌科(Comamonadaceae)与噬氢菌属(Hydrogenophaga)中不可培养微生物占优势地位。表明其他的未知的菌种在污水处理过程中也发挥着重要的功能。
3 讨 论
静态污水、种植李氏禾、种植李氏禾+曝气和种植李氏禾+缺氧处理中的微生物群落组成,在处理的不同时间段呈动态变化,这受环境的多种因素影响,如营养盐、溶氧和植物生长等。但各个处理均未显著改变水体中的优势微生物门类,通过高通量分析根际微生物群落组成在门水平上的组成显示,无论在哪个处理中变形菌门(Proteobacteria)的微生物均占绝对优势,是污水处理的优势菌种,这与污水处理厂中微生物群落的研究相似,通过功能基因芯片对污水处理厂中的功能基因及其与净水关系的研究发现变形菌门(Proteobacteria)的微生物是污水处理厂中最重要的功能微生物[8],还有研究表明属于鞘脂杆菌门(Sphingobacteria),黄杆菌门(Flavobacteria)和变形菌门(Proteobacteria)的微生物在污水净化中也起着重要作用[9]。种植李氏禾、种植李氏禾+曝气处理中,随着处理时间的延长,拟杆菌门(Bacteroidetes)相对含量增加,有研究显示在污水处理中检测到大量的放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)[10-11]的微生物。而几种处理中的优势微生物菌属随污水处理时间的延长,均呈现出动态变化。与污染水体对照相比,种植李氏禾处理中,赤杆菌科(Erythrobacteraceae)、醋酸杆菌科(Acetobacteraceace)与鞘脂杆菌目(Sphingobacteriales)的菌属发展为优势菌属。研究表明赤杆菌科(Erythrobacteraceae)中的微生物为好氧异养生长,普遍可利用葡萄糖、乙酸盐、丙酮酸盐以及谷氨酸盐为唯一碳源,具有降解烃类、芳香族以及卤化物等有机污染物的能力,因此可在水体生态系统的碳循环和能量代谢过程中发挥作用[12]。在脱氮的生物反应器以及低浓度氯处理的再生水中,发现海生杆菌属(Sediminibacterium)为优势菌属;而在高浓度氯处理的再生水中鞘脂杆菌目(Sphingobacteriales)的微生物为优势微生物,表明这两类菌具有一定的抗氯能力[13-14]。Emticicia在水体及土壤中均有存在,报道显示此菌属为严格好氧菌,其中个别菌种具有水解淀粉能力[15]。种植李氏禾+曝气处理中新增优势微生物为新鞘氨醇杆菌属(Novosphingobium)与苍黄杆菌属(Luteolibacter)的微生物。新鞘氨醇杆菌属(Novosphingobium)微生物参与有机污染物如多环芳烃、苯酚类、雌激素等的降解[16-18]。据报道苍黄杆菌属(Luteolibacter)微生物在护城河底泥中是丰度最高的微生物,此属的菌种可利用葡萄糖、麦芽糖、甘露糖等碳源生长,具有水解木聚糖能力[19-20]。表明种植李氏禾以及种植李氏禾+曝气处理有利于一些碳循环相关的微生物的生长繁殖,而且富集了一些具有有机污染物降解能力的微生物类群,因此种植李氏禾+曝气处理在实践应用中有望处理COD、有机污染物含量高的污水。种植李氏禾+缺氧处理到3 d时,假单胞菌属(Pseudomonas)微生物为丰度最高的菌属;7或14 d时,黄杆菌属(Flavobacterium)与红杆菌属(Rhodobacter)均为优势菌属;此外,军团杆菌科(Legionellaceae)中的菌属为缺氧处理中特有的优势微生物。有报道表明假单胞菌属(Pseudomonas)、黄杆菌属(Flavobacterium)中的微生物是极为重要的解磷菌,红杆菌属(Rhodobacter)中的微生物具有较强的摄磷能力[21-23],由此解释了在种植李氏禾+缺氧处理总磷去除能力较高的原因。

横坐标轴上表示不同的处理-处理时间,下同The A-1d of abscissa axis meant different treatments-different treatment time, the same as below图5 不同处理中李氏禾根际的优势微生物差异(属水平)Fig.5 The abundant genus differences with different treatments of Leersia hexandra Swartz rhizosphere(genus level)

图6 不同处理中李氏禾根际优势种相对含量的差异(种水平)Fig.6 The predominant species with different treatments of Leersia hexandra Swartz rhizosphere (species level)
4 结 论
高通量分析结果显示污水中的微生物多样性与污水的净化无明显正相关性,种植李氏禾+缺氧处理的微生物群落组成与静态污水对照相聚集在一起,相识度较高,而种植李氏禾与种植李氏禾+曝气处理相似度较高。种植李氏禾+曝气处理有利于碳循环相关的微生物生长如丛毛单胞菌科(Comamonadaceae)、赤杆菌科(Erythrobacteraceae)、海生杆菌属(Sediminibacterium)、Emticicia属、新鞘氨醇杆菌属(Novosphingobium)与苍黄杆菌属(Luteolibacter)的微生物,促进COD的去除。种植李氏禾+缺氧处理富集解磷功能菌属如假单胞菌属(Pseudomonas)、黄杆菌属(Flavobacterium)和红杆菌属(Rhodobacter)占绝对优势,有利于磷源的去除。

