鳕鱼皮胶原蛋白肽在Caco-2细胞单层模型中的吸收机制
陈 锐,丁国芳,,*,杨最素,余方苗,黄芳芳,唐云平,张小军,陈 思,梅光明
(1.浙江海洋大学食品与医药学院,浙江省海洋生物医用制品重点工程技术研究中心,浙江 舟山 316022;2.浙江省海洋水产研究所,浙江 舟山 316021)
目前,各种食物来源的活性肽已被报道具有抗肿瘤[1-2]、抗凝血和抗血栓[3-4]、抗病毒[5]、免疫调节[6]、抗高血压[7]等作用。因此,食用含有生物活性肽的功能性食品成为人们预防疾病和对疾病的辅助性治疗的一种新型策略。鳕鱼(Melanogrammus aeglefinus)属于鳕形目鳕鱼科黑线鳕属,是底层冷水性群聚鱼类,我国鳕鱼年加工量40万~50万 t,鱼皮作为下脚料,占加工量的8%左右。近年来的研究发现,鳕鱼皮中的活性肽在抗氧化、降血压和抗胃溃疡等方面表现出显著的功效[8-10]。鳕鱼皮中的蛋白主要为胶原蛋白,其含量最高可达到80%[11],因胶原蛋白和胶原蛋白肽具有广泛的生物活性,目前已被用作保健食品。本实验室前期研究表明,鳕鱼皮胶原蛋白肽(cod skin collagen peptide,CSCP)具有较好的抗氧化活性,能够作用于经脂多糖诱导后损伤的正常肝Chang liver细胞,使细胞内抗氧化酶活力显著升高、上清液中转氨酶活力下降,降低细胞早期凋亡率,对肝细胞损伤具有一定的修复能力;其对四氯化碳诱导的小鼠慢性和急性肝损伤也具有一定的预防和保护作用[12-13]。CSCP在细胞和动物实验中均表现出良好的生物活性,细胞实验表明完整的CSCP对肝细胞具有修复作用。然而,在动物实验中,CSCP经灌胃方式给药的体内消化吸收过程较为复杂,其在胃肠道的转运吸收机制尚不明确。因此,阐明CSCP在胃肠道的稳定性对于研究其在肠道中的吸收机制具有重要意义。Caco-2细胞单层模型是目前最成熟也是应用最多的体外吸收模型,广泛用于研究口服药物、肽类等营养物质在肠道的吸收机制[14-15]。为了有效地开发利用CSCP,本实验拟对其在胃肠道中的稳定性进行评价,并使用Caco-2细胞模型研究CSCP的跨膜转运特性,从细胞水平探究其在肠道的吸收机制,为深入研究CSCP的口服吸收机制及药物代谢动力学提供依据。
1 材料与方法
1.1 材料与试剂
Caco-2细胞株购于中国科学院细胞库,由浙江省海洋生物医用制品重点工程技术研究中心代培养。CSCP由浙江省海洋生物医用制品重点工程技术研究中心自制,分子质量为7 700 Da,N端前20 个氨基酸序列为:GEMGPAGAKGAQGKTGPVGE。
鳕鱼皮 大连鸿运海产品加工厂;MEM(minimum Eagle’s medium)粉末培养基、质量分数0.25%胰蛋白酶-乙二胺四乙酸 美国Gibco公司;胎牛血清 杭州四季青生物工程有限公司;CCK-8(cell counting kit-8)试剂盒日本同仁公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、三氟乙酸、维拉帕米、MK-571、氧化苯砷、去氧胆酸钠 美国Sigma公司;碱性磷酸酶(alkaline phosphatase,ALP)试剂盒 南京建成生物工程研究所;乙腈、甲醇(均为色谱纯) 德国Merck公司;Transwell培养板(聚碳酸酯膜直径24 mm,孔径0.4 μm,膜面积4.5 cm2) 美国Corning公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Forma3111型CO2培养箱 美国Thermo Scientif i c公司;多功能酶标仪 美国美谷分子仪器有限公司;倒置相差显微镜 日本OLYMPUS公司;Millicell ERS-2细胞电阻仪 美国Millipore公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent公司;透射电子显微镜 日本日立仪器有限公司。
1.3 方法
1.3.1 HPLC法测定CSCP含量
色谱条件:Z O R B A X S B-C18分析型色谱柱(9.6 mm×250 mm,5 μm);检测波长220 nm;流速2 mL/min;流动相A为超纯水(含体积分数0.05%三氟乙酸溶液),流动相B为乙腈(含体积分数0.05%三氟乙酸溶液),采用等度洗脱方式,流动相A与流动相B的体积比为85∶15;柱温25 ℃;自动进样,进样量20 μL。以CSCP的峰面积对鳕鱼皮胶原蛋白标准溶液的质量浓度进行线性回归得到回归方程进行定量。
1.3.2 CSCP在胃肠道稳定性的测定
1.3.2.1 CSCP在接近胃肠道环境的不同pH值中的稳定性
按戎晓娟等[16]的方法稍作修改。取0.9 mL不同pH值(1.2、2.5、5.0、6.5、7.4~8.0)的磷酸盐缓冲液,分别加入0.1 mL 10 mg/mL CSCP溶液,置于37 ℃水浴中,分别于0、10、30、60、120、180 min时取样,100 ℃灭酶15 min,利用HPLC标准曲线测定CSCP质量浓度,CSCP最终质量浓度与初始质量浓度的比值即为剩余百分率。
1.3.2.2 CSCP在人工胃液和人工肠液中的稳定性
将CSCP加入人工胃液和人工肠液中,使其质量浓度为1 mg/mL,漩涡振荡2 s,并于37 ℃孵育,分别于0、10、30、60、120、180 min时取样,100 ℃灭酶15 min,利用HPLC标准曲线测定CSCP质量浓度,CSCP最终质量浓度与初始质量浓度的比值即为剩余百分率。
1.3.3 细胞培养
Caco-2细胞在MEM培养液(含质量分数20%胎牛血清、青霉素G 100 IU/mL、链霉素100 IU/mL)中进行培养,置于37 ℃、5% CO2的培养箱中孵育,每天换液,待细胞长至80%以上时用质量分数0.25%胰蛋白酶溶液进行消化传代。取对数生长期的细胞进行实验。本实验所用的Caco-2细胞为25~35 代。
1.3.4 CSCP细胞毒性实验
使用CCK-8试剂盒检测给予不同质量浓度CSCP后Caco-2细胞的存活率。将Caco-2细胞以1×104个/mL接种于96 孔培养板中,每孔加入细胞悬液100 μL。常规条件下培养24 h后吸去培养液。将Caco-2细胞随机分为空白对照组(只加MEM培养液)和药物组(CSCP质量浓度分别为0.10、0.25、0.50、1.00 mg/mL),空白孔不接种细胞,加入等量磷酸盐缓冲液。在培养箱中孵育6 h后,吸去旧培养液,加入新鲜培养液100 μL,然后向每孔加10 μL CCK-8,在培养箱中继续培养4 h,使用酶标仪测定450 nm波长处OD值。按式(1)计算细胞存活率。
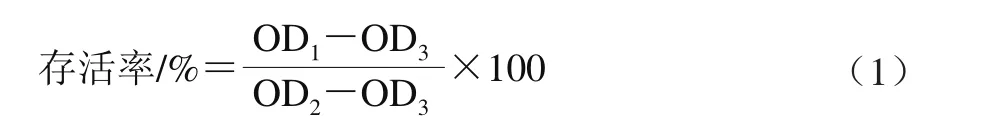
式中:OD1为药物组OD值;OD2为空白对照组OD值;OD3为空白孔OD值。
1.3.5 Caco-2细胞单层模型的建立与评价
1.3.5.1 Caco-2细胞单层模型的建立
取Caco-2细胞制成密度为1×105个/mL的单细胞悬液,先加入2 mL新鲜培养基于Transwell 6 孔板板底侧(basolateral side,BL),再加入2 mL细胞悬液于6 孔板顶侧(apical side,AP),接种后隔天换液,一周后每天换液。空白孔不接种细胞,加入等量磷酸盐缓冲液。培养至21 d,将细胞单层连同聚碳酸酯膜一同取下,透射电子显微镜观察细胞分化情况。
1.3.5.2 TEER的测定
用Millicell-ERS电阻仪测定各孔电阻值,细胞单层的跨膜电阻值(transepithelial electrical resistance,TEER)按照公式(2)计算。
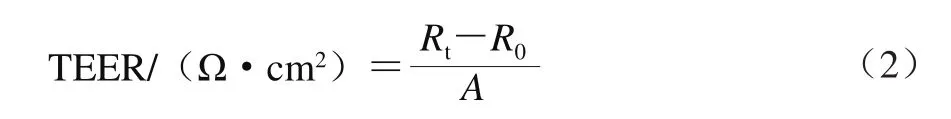
式中:Rt为细胞孔电阻值/Ω;R0为空白孔电阻值/Ω;A为Transwell小室有效膜面积/cm2。
1.3.5.3 ALP活力的测定
ALP是Caco-2细胞刷状缘的标志性酶,可以根据此酶的活力来分析肠上皮细胞的分化程度。使用ALP试剂盒分别测定Caco-2细胞内、6 孔板AP侧和BL侧的ALP活力。Caco-2细胞单层生长至7、14、21 d时,吸干小室内、外培养液,刮取细胞,用细胞裂解液破碎细胞使之释放出ALP,按试剂盒方法测定细胞培养液及细胞内ALP活力。
1.3.6 CSCP的细胞转运实验
1.3.6.1 CSCP在Caco-2细胞单层的双向转运
取出已建立好的Caco-2细胞单层模型,吸干内、外侧培养液,培养小室内、外侧各加入2 mL 37 ℃的HBSS(Hank’s balanced salt solution),漂洗3 次,清除细胞表面干扰物质。内侧加入2.5 mL HBSS,外侧加入3.0 mL HBSS,在37 ℃培养箱中平衡30 min。按1.3.5.2节方法计算TEER值,选择TEER大于400 Ω·cm2的细胞单层吸干HBSS继续实验。对于从AP向BL侧的转运,在AP侧加入2.0 mL质量浓度为0.25 mg/mL的CSCP溶液(溶解于HBSS)作为供给池,BL侧加入2.5 mL HBSS作为接收池。对于从BL向AL侧的转运,在BL侧加入2.5 mL质量浓度为0.25 mg/mL的CSCP溶液(溶解于HBSS)作为供给池,AP侧加入2.0 mL HBSS作为接收池。加样后立即将Transwell板置于恒温摇床中孵育(37 ℃、40 r/min),于0、30、60、90、120、150、180 min时分别在接收池取样150 μL,利用HPLC测定CSCP质量浓度。从AP向BL侧转运实验中,不同时间点BL侧吸收的药量(累积转运量)以QrBi表示;从BL向AP侧转运实验中,不同时间点AP侧室吸收的药量(累积转运量)以QrAi表示,分别按式(3)、(4)计算[17]。
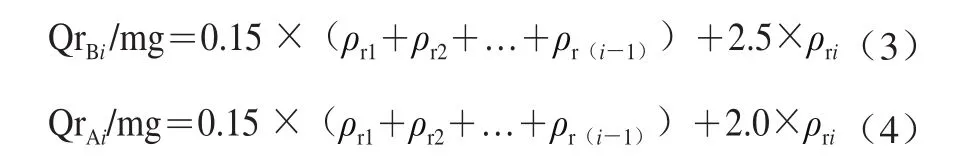
式中:0.15为取样体积/mL;2.5和2.0分别为接收池BL侧和AP侧缓冲液的总体积/mL;ρri为接收池第i个时间点的实际质量浓度/(mg/mL)。
1.3.6.2 质量浓度对CSCP转运的影响
细胞单层的前处理同1.3.6.1节方法,在AP侧分别加入2.0 mL质量浓度为为0.02、0.04、0.08、0.10、0.25 mg/mL的CSCP溶液,随后的转运实验同1.3.6.1节方法。180 min内累积转运量的计算如公式(3)。
1.3.6.3 不同药物对CSCP转运的影响
为了探究CSCP在Caco-2细胞的转运中的吸收途径及是否受到某些转运蛋白的介导,进行了进一步的研究。细胞单层的前处理同1.3.6.1节方法,随后在AP侧分别加入2.0 mL含有维拉帕米(100 μmol/L)、MK-571(50 μmol/L)、氧化苯砷(25 mmol/L)、去氧胆酸钠(100 mmol/L)和不加药物(空白对照组)的CSCP溶液(0.25 mg/mL),BL侧加入2.5 mL HBSS,随后的转运实验同1.3.6.1节方法。其中,维拉帕米和氧化苯砷溶解于含体积分数0.1% DMSO的HBSS中,MK-571和去氧胆酸钠溶解于不含DMSO的HBSS中。180 min内累积转运量的计算如公式(3)。CSCP透过Caco-2细胞单层的表观渗透系数Papp按式(5)计算[18]。

式中:ΔQ为时间Δt/s内的累积转运量/mg;A为聚碳酸脂膜的面积(4.5 cm2);ρ0为CSCP初始质量浓度/(mg/mL)。
外排比率(efflux ratio,ER)用Papp(B-A)(从BL向AP侧转运)与Papp(A-B)(从AP向BL侧转运)的比值表示[19]。
1.4 数据分析
2 结果与分析
2.1 CSCP在不同pH值中的稳定性分析

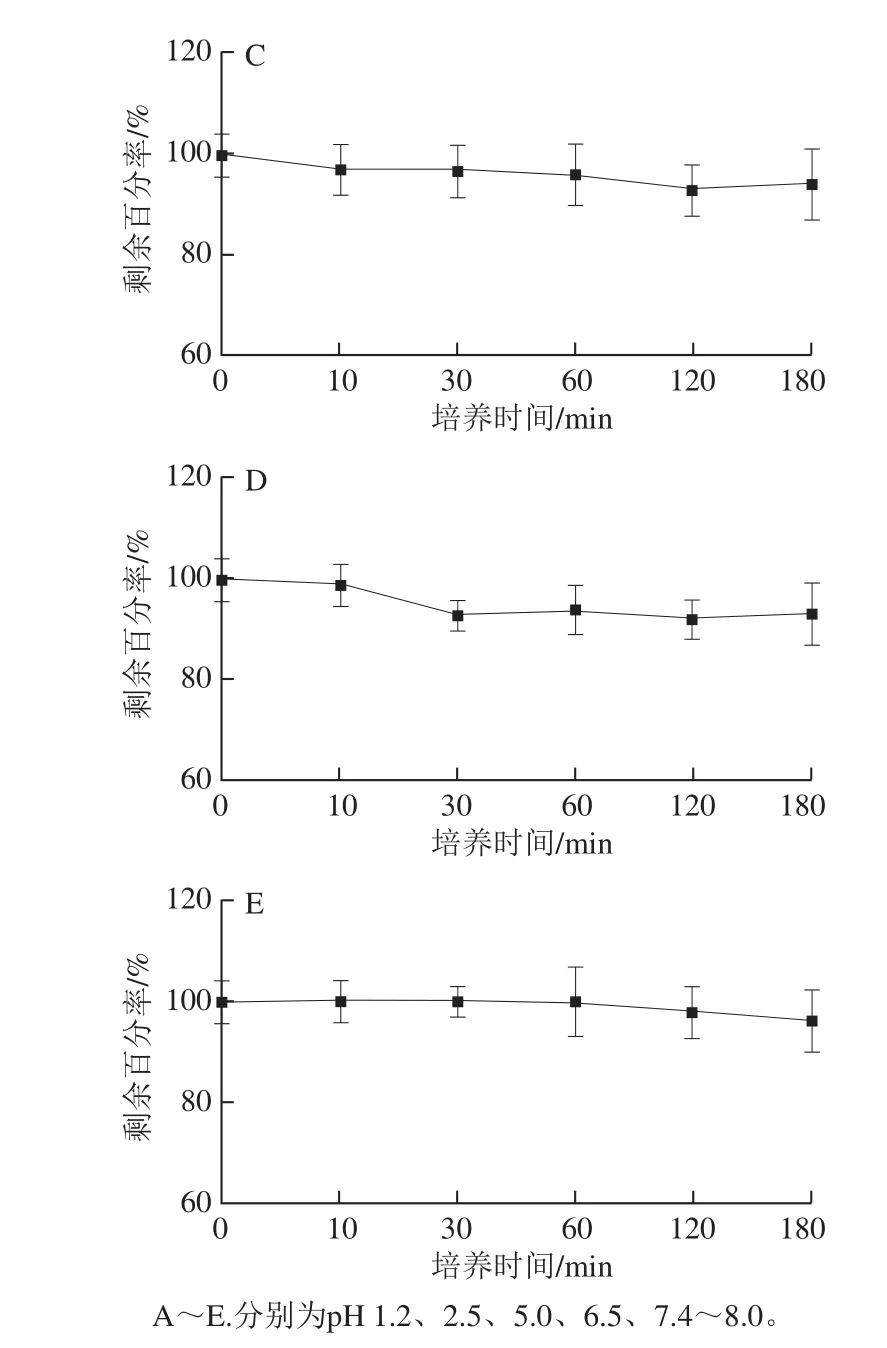
图 1 CSCP在不同pH值溶液中的稳定性结果Fig. 1 Stability of CSCP under different pH conditions
如图1所示,经HPLC分析可得,CSCP在接近胃肠道环境的各pH值中基本保持稳定,在180 min内降解缓慢,180 min时仍有90%以上保持原型。
2.2 CSCP在人工胃液和人工肠液中的稳定性分析

图 2 CSCP在人工胃液(A)和人工肠液(B)中的稳定性结果Fig. 2 Stability of CSCP in artif i cial gastric juice (A) and artif i cial intestinal juice (B)
如图2所示,在前10 min内,CSCP在人工胃液(图2A)和人工肠液(图2B)内均降解了6%左右;10 min后CSCP在两种溶液中均降解缓慢;180 min后,在人工胃液和人工肠液中最终分别剩余94.02%和94.46%。人工胃液和人工肠液对CSCP稳定性的影响并不大,可能是胃蛋白酶的水解位点为色氨酸、苯丙氨酸和苏氨酸的氨基端,而Edman自动降解法测得CSCP的氨基端为甘氨酸;而且CSCP是由鳕鱼皮胶原蛋白经胰蛋白酶酶解得到,所以肠液中的胰蛋白酶对CSCP几乎没有影响,该结果与接近肠道pH值时的稳定性基本一致。
2.3 不同质量浓度CSCP对Caco-2细胞存活率的影响
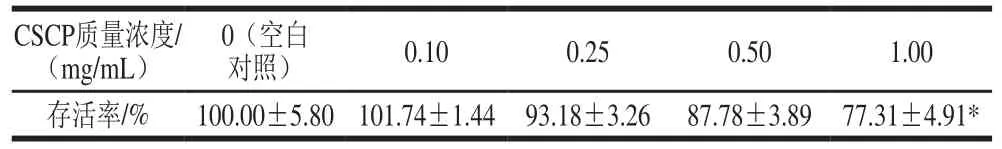
表 1 不同质量浓度CSCP对Caco-2细胞存活率的影响Table 1 Effect of CSCP at various concentrations on Caco-2 cell viability
CCK-8实验数据(表1)表明,随着CSCP质量浓度的增加,Caco-2细胞存活率逐渐降低。在CSCP质量浓度为0.10、0.25 mg/mL时,Caco-2细胞的存活率大于90%,在质量浓度为1.00 mg/mL时,细胞存活率降低,达到77.31%,与空白对照组相比具有显著性差异(P<0.05)。而且,转运实验在3 h内完成,远少于CCK-8实验的6 h。因此,选取细胞存活率大于90%时CSCP的质量浓度进行后续的转运实验,0.25 mg/mL为最高转运质量浓度。
2.4 Caco-2细胞单层模型的验证结果
在6 孔板上培养21 d后,倒置显微镜下观察到Caco-2细胞连接紧密,边界清晰,形成了一层致密的细胞单层(图3)。透射电子显微镜观察聚碳酸酯膜上的Caco-2细胞单层(图4),发现其微绒毛形成的刷状缘整齐致密,细胞间形成紧密连接和桥粒,说明Caco-2细胞已出现极化,呈不对称分布,具有小肠上皮细胞的某些结构特征。
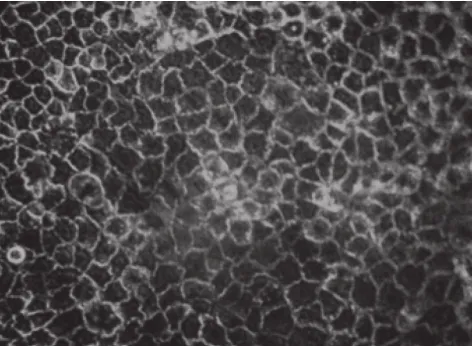
图 3 倒置显微镜下Caco-2细胞单层上皮表面观察结果(×200)Fig. 3 Epithelium monolayer surface under an inverted microscope (× 200)
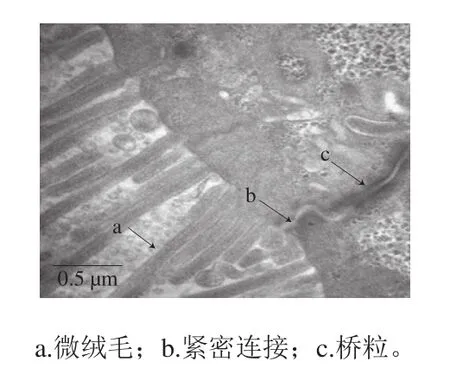
图 4 透射电子显微镜下Caco-2细胞侧面连接观察结果(×40 000)Fig. 4 Caco-2 cell connection under an transmission electron microscope (× 40 000)
2.5 Caco-2细胞单层模型的评价结果
2.5.1 Caco-2细胞单层TEER值分析
本实验中C a c o-2细胞单层T E E R值在(580.2±36.1)Ω·cm2之间变动。细胞TEER值超过400 Ω·cm2才能用于转运实验,得到可靠的结果[20],表明本实验条件下,Caco-2细胞成膜情况较好,致密性优良,可以用于CSCP的跨膜转运实验。
2.5.2 Caco-2生长过程中ALP活力的变化

表 2 Caco-2细胞单层ALP活力变化Table 2 Change in ALP activity of Caco-2 cell monolayer
由表2可见,细胞内ALP活力随着时间的延长迅速增加,14 d以后增长趋势稍缓,到第21天ALP活力比第7天增加了4 倍左右,说明Caco-2细胞逐渐分化成熟,AP侧与BL侧ALP活力比值的升高证明ALP的分布极不对称,细胞出现了非常明显的极化现象。
2.6 CSCP在Caco-2细胞单层的双向转运分析
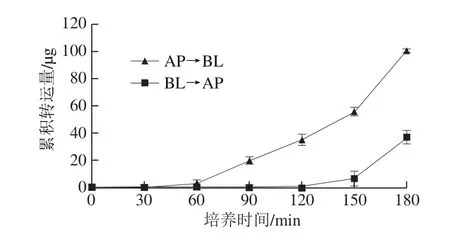
图 5 时间对CSCP跨Caco-2细胞单层转运的影响Fig. 5 Time-course curves of CSCP transport across Caco-2 cell monolayer
如图5所示,初始质量浓度一定时,转运量随时间的延长而增加,尤其是AP侧到BL侧的转运在1 h后呈近似线性增加,且3 h内未见饱和;而BL侧到AP侧的转运量在前2 h基本为0,2 h后缓慢增加。结果表明CSCP在Caco-2细胞单层的双向转运均存在明显的时间依赖性,且在60~150 min时,AP侧到BL侧的转运速率远大于反向转运速率,AP侧到BL侧3 h内转运量也明显高于BL侧到AP侧,提示CSCP的转运具有方向性,且受到某种转运蛋白的外排作用,从累积转运量来看,Caco-2细胞单层对CSCP的吸收作用大于外排作用。
2.7 质量浓度对CSCP跨膜转运的影响分析

图 6 质量浓度对CSCP跨Caco-2细胞单层转运的影响Fig. 6 Concentration-dependent CSCP transport across Caco-2 cell monolayer
由图6可以发现,在转运的3 h内,CSCP的累积转运量随质量浓度的升高而增加,说明CSCP的跨膜转运是浓度依赖型,且在实验的质量浓度范围内没有达到饱和,提示CSCP在Caco-2细胞单层的转运以被动转运为主。
2.8 药物种类对CSCP跨膜转运的影响

图 7 药物种类对CSCP转运的影响Fig. 7 Effects of drugs on CSCP transport
多肽和蛋白质药物的口服吸收途径主要包括载体转运、胞饮作用和细胞旁路途径[21]。如图7所示,与空白对照组相比,去氧胆酸钠明显增强了CSCP的跨膜转运(P<0.01),去氧胆酸钠是旁路转运促进剂,能打开细胞间的紧密连接[22],表明CSCP的主要跨膜机制是细胞旁路途径;MK-571为多药耐药蛋白抑制剂[23],也增加了CSCP的转运,且与空白对照组相比具有显著性差异(P<0.05);维拉帕米(P-糖蛋白抑制)和氧化苯砷(内吞抑制剂)对CSCP的转运没有显著影响,表明在CSCP的吸收过程中,内吞不是主要机制,多药耐药蛋白介导了CSCP的外排。不同转运条件下的Papp见表3。
由表3可知,比较Papp发现,Papp(B-A)/Papp(A-B)值小于1,即ER值小于1,提示CSCP的转运具有方向性,摄取作用大于外排作用。加入去氧胆酸钠后,Papp增加为空白对照的4 倍左右,差异极显著(P<0.01);加入MK-571后Papp也有所增加,约为空白对照组的1.4 倍,与空白对照组相比差异显著(P<0.05),其余药物对Papp没有显著影响。
3 讨 论
多年来人们一直认为蛋白质口服后,大多数在体内酶的作用下被完全水解为氨基酸再吸收入血[24]。近年来,一些以蛋白质为主的药物口服后可经胃肠道吸收进入血液循环。研究发现,口服重组水蛭素-2可部分以其原型活性形式被吸收入血并产生抗凝作用,回肠是其最佳吸收部位[25-26]。张倩等[27]发现鹿茸中分子质量小于45 kDa的蛋白可以透过肠壁吸收,口服给予大鼠异硫氰酸荧光素标记的鹿茸蛋白,在血清中能检测到荧光蛋白。关于胰岛素的研究表明,胰岛素在肠道引入后,被上皮细胞吸收并进入血液循环起到降低血糖作用,通过组织切片的免疫化学显示,胰岛素以内吞的形式被吸收[28]。大量研究表明一些具有生理活性的多肽和蛋白质可以被肠道上皮细胞吸收而进入血液循环,但生物利用度并不高。为了提高其生物利用度、开发蛋白质和多肽类药物的口服制剂,一些新的剂型和给药方法成为研究热点,目前主要有结肠定位释药系统、脂质体载体和微乳载药等[21]。
口服是最方便也是最容易让人接受的给药途径,但有些药物因在胃肠道不稳定、生物利用度低等原因而不能制成口服剂型。因此,在设计、优化、选择口服药物时,预测其肠道吸收是主要考虑因素之一。用于评估药物吸收的一系列临床前方法包括计算机、体内、体外、在体和离体等方法[29]。然而,当今社会和科学对动物的关爱以及制药行业对快速、经济和可靠模型的需求,使得人们极其迫切地寻求和建立与体内吸收具有良好相关性的模型。Caco-2细胞模型法最早由Hidalgo等[30]在1989年提出,一旦汇合成完整细胞单层,Caco-2细胞就会分化成在结构和功能上与成熟小肠细胞类似的细胞。在标准培养条件下,典型的微绒毛、一些分子的转运系统、代谢酶和细胞间的紧密连接都能表达[31]。而且Caco-2细胞来源于人,同源性较好,实验条件易受控制。基于以上特征,Caco-2细胞模型能从细胞水平评估药物的黏膜渗透率,从而阐明药物的肠吸收机制。
目前,胶原蛋白肽的保健功能主要在抗氧化、美容护肤、止血和免疫等方面[32],还鲜有关于胶原蛋白肽对肝损伤保护作用的研究。现有的肝病治疗主要依靠化学药物,但化学药物都具有一定的毒性。CSCP是本课题组从水产加工副产物鳕鱼皮中提取获得的胶原蛋白肽,其具有良好的护肝活性[12-13],无毒且安全,是理想的辅助治疗保健品。为有效地开发利用CSCP,本研究建立了Caco-2细胞单层模型并研究CSCP跨肠细胞的转运特性,评估CSCP的黏膜渗透率,探究CSCP的跨膜吸收机制。在进行转运实验前,首先对CSCP的细胞毒性进行评价,选择细胞存活率大于90%的质量浓度进行实验。若转运质量浓度对Caco-2细胞有毒性,则转运过程中TEER值可能下降到低于标准值,细胞间紧密连接变松散,计算得到的转运量和Papp会比实际值偏大。实验表明CSCP跨Caco-2细胞转运受到多种因素的影响,呈现明显的浓度依赖性和时间依赖性,Papp也随时间的延长逐渐增大。化合物的Papp与人体内的吸收率具有良好的相关性,Papp为1×10-6~10×10-6cm/s,表明体内吸收适中,相当于给药剂量的20%~70%[33]。本实验测得CSCP的Papp为(8.51±0.27)×10-6cm/s,说明CSCP吸收良好。由于Caco-2细胞单层的紧密连接比人和动物小肠的更紧密一些[31],通过细胞旁路转运的化合物在Caco-2细胞模型中的渗透率比体内吸收稍低。
4 结 论
CSCP在模拟胃肠道环境中较为稳定,其跨Caco-2细胞单层转运的机制为细胞旁路途径,其外排受到多药耐药蛋白的介导;CSCP的Papp为(8.51±0.27)×10-6cm/s,说明其在体内吸收适中。本研究从细胞水平探究了CSCP在肠道中的吸收机制,为深入研究CSCP的口服吸收机制及药物代谢动力学提供依据。

