蒙古黄芪AFLP分子标记反应体系的建立与优化
姜志艳, 杨慧楠, 邵学勤
(内蒙古科技大学生命科学与技术学院,内蒙古包头 014010)
蒙古黄芪[Astragalimembranaceus(Fisch.) Bge. var.Mongholicus(Bge.) Hsiao ]为豆科黄芪属,是内蒙古特色药用植物,具有很好的药用价值和经济价值。由于目前黄芪野生资源稀缺,大多进行人工栽培[1]。近些年来,对药用植物黄芪的研究主要集中在其药理活性成分分析、有效成分提取等[2],而有关黄芪的利用分子标记辅助育种、数量性状基因座(quantitative trait locus,简称QTL)定位、构建分子遗传连锁图谱和进行黄芪种质遗传多样性研究的相关信息较少。
扩增片段长度多态性(amplified fragment length polymorphism,简称AFLP)具有多态性高、DNA用量少、无需预知基因组序列信息、稳定性好等优点,该分子标记技术被广泛应用于植物遗传育种、种质资源研究[3]、遗传多样性分析[4-6]、构建遗传图谱(尤其是高密度分子图谱)[7]及基因定位[8]等方面。目前,已有研究者利用简单重复序列标记(simple sequence repeat,简称SSR)、随机扩增多态性DNA标记(random amplified polymorphic DNA,简称RAPD)、相关序列扩增多态性(sequence-related amplified polymorphism,简称SRAP)等分子标记技术对黄芪进行了遗传多样性研究,王敖利用SSR分子标记对蒙古黄芪进行了遗传多样性研究[9],钱丹等利用SRAP分子标记技术分析了蒙古黄芪的亲缘关系[10]。但目前尚少见有关药用植物黄芪AFLP分子标记分析及反应体系相关研究的报道。为此,本研究以蒙古黄芪为试验材料,对AFLP分析过程中的影响因子进行研究,建立优化黄芪AFLP分析体系。以期为从分子水平上对黄芪进行遗传多样性研究、遗传连锁图谱构建、分子标记辅助育种等研究奠定理论基础。
1 材料与方法
1.1 植物材料
供试材料为蒙古黄芪,黄芪幼叶于2017年7月采集于包头医学院内蒙古特色药用植物繁育种植基地。-80 ℃保存备用,黄芪组培苗于室内培养。
1.2 试验方法
1.2.1 基因组DNA提取及检测 对黄芪单株叶片进行DNA的提取,黄芪基因组DNA提取采用植物基因组DNA提取试剂盒[天根生化科技(北京)有限公司],用1%琼脂糖凝胶电泳检测所提取DNA的纯度和完整性,用紫外可见分光光度计测定DNA的浓度和纯度,保存于-20 ℃冰箱。
1.2.2 基因组DNA的酶切-连接 使用限制性内切酶EcoRⅠ与MseⅠ(购自NEB)对黄芪基因组DNA进行双酶切,同时加入EcoRⅠ/MseⅠ接头,用T4DNA连接酶进行连接作为预扩增模板,酶切-连接一步完成。反应总体积为 20.0 μL,含样品DNA 2 μL(50 ng/μL),EcoRⅠ 0.2 μL (15 U/μL),MseⅠ0.3 μL(10 U/μL),BSA 0.3 μL(10 mg/mL),EcoRⅠ/MseⅠ(5 μmol/μL)接头各0.4 μL,10×NEB reaction buffer 2.0 μL,10 mmol/L ATP 0.4 μL,T4连接酶(350 U/μL)0.8 μL,加ddH2O补足总体积至20.0 μL。分别设定酶切-连接时间为12、14、16 h,37 ℃温浴。取出后保存于-20 ℃冰箱。
1.2.3 AFLP模板DNA的预扩增 反应总体系为20.0 μL,包括酶切-连接产物4.0 μL,10×PCR-buffer 2.0 μL,MgCl2(25 mmol/L)1.0 μL,TaqDNA聚合酶(5 U/μL)0.2 μL,dNTPs(2 mmol/L)1.8 μL,引物E00(5′-GACTGCGTACCAAT TCA-3′)、M00(5′-GATGAGTCCTGAGTAA-3′)(各 50 μmol/L),用ddH2O补足总体积至20.0 μL,离心混匀进行PCR反应。PCR扩增程序:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,4 ℃保温。
1.2.4 AFLP模板DNA的选择性扩增 选择性扩增反应采用表1中E3/M3引物组合将预扩产物分别稀释10、20、30、40倍进行选择性扩增。反应总体系20.0 μL,包括稀释预扩增产物2.5 μL,10× buffer(含Mg2+)1.5 μL,dNTPs(2 mmol/L)2.0 μL,Taq酶(5 U/μL)0.15 μL,选择性引物(50 ng/μL) 各1.0 μL,用ddH2O补足总体积至20.0 μL。PCR扩增程序:94 ℃ 5 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 1 min,13个循环,每个循环的退火温度下降0.7 ℃;然后 94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,26个循环;每个循环增加1 s,最后 72 ℃ 10 min。

表1 筛选AFLP分子标记的引物序列
1.2.5 变性聚丙烯酰胺凝胶电泳及银染 在PCR产物中加入1/3体积的变性剂,95 ℃变性5 min,于6%变性聚丙烯酰胺凝胶中,恒定功率70 W,预电泳30 min,上样量为6 μL,电泳2 h后,进行显色、扫描胶板。
2 结果与分析
2.1 黄芪基因组DNA提取质量的检测
中药植物高质量基因组DNA的提取对其后续试验的进行发挥着极为重要的作用。植物基因组DNA的提取受植物的组织材料、部位、形态特征等影响,例如有的中药植物中含有多糖、酚等次生代谢物会直接影响DNA提取的纯度,所以需要根据试验材料的实际情况,科学、合理地采用DNA提取方法。本研究采用改良的十六烷基三甲基溴化铵(CTAB)法[5],从含多糖、酚的蒙古黄芪中简便、快速地提取DNA,为分子遗传标记应用于黄芪的种质资源研究提供基础[2]。
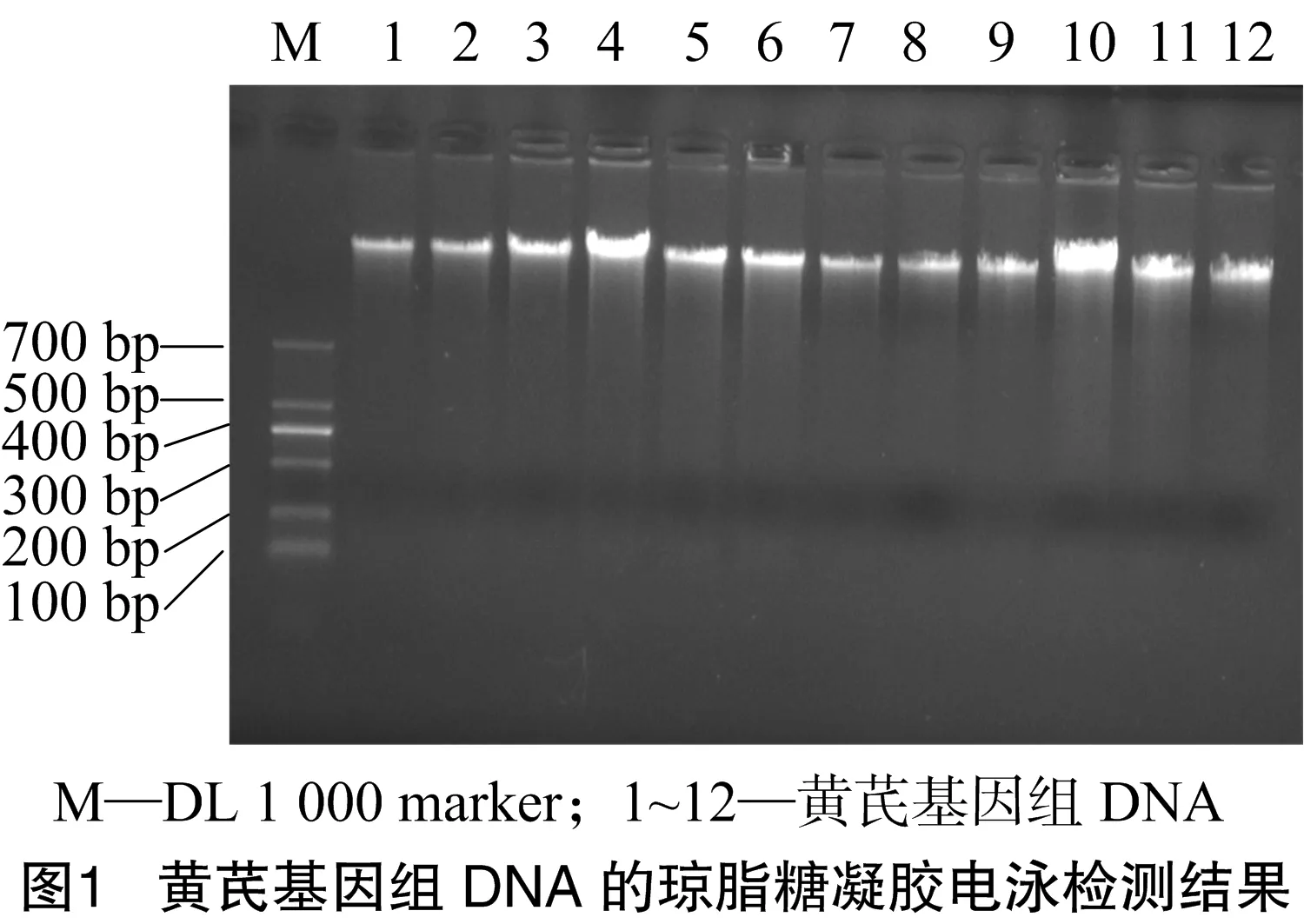
由图1可见,提取的黄芪基因组DNA经1%琼脂糖凝胶电泳检测,条带明亮,无脱尾弥散现象,无RNA条带,提取的基因组比较完整,用紫外可见分光光度计检测D260 nm/D280 nm值都在1.8~2.0,可用于黄芪AFLP分析。
2.2 酶切、连接体系的优化
本研究对黄芪基因组进行酶切连接采用了多种试验方法,关于限制性核酸内切酶组合EcoRⅠ/MseⅠ、PstⅠ/MseⅠ的选择与酶切、酶连分步法和一步法均有报道[11]。经多次试验比较,最终确立本试验中AFLP体系的建立采用EcoRⅠ/MseⅠ双酶切,酶切-连接一步完成,试验对酶切连接时间作了不同设置,处理时间为12、14、16 h(图2)。得出最佳的酶切-连接时间为16 h。1%琼脂糖凝胶电泳检测酶切-连接时间为16 h的产物在100~1 500 bp范围内出现均匀、清晰的弥散带,证明酶切彻底,可以为AFLP研究提供理想的模板,试验时间得到了缩减,试验效率得到了提高。

2.3 预扩增产物的稀释倍数
预扩增反应是以酶切-连接产物作为模板,用引物 E0/P0 进行预扩增,在进行选择性扩增之前,预扩增产物需要进行一定量的稀释,本研究中将预扩增产物稀释倍数分别设为5、10、15、20、25、30、40倍,经琼脂糖凝胶电泳检测可知,不同稀释倍数的模板即模板浓度对扩增效果并无明显影响(图3),经过后续选择性扩增试验也证实了这一点,为保证选扩产物量的充分,最终确定将预扩产物稀释20倍。

2.4 AFLP引物的设计与筛选
根据接头序列互补原则设计选择性扩增引物,选择性扩增引物是在预扩增引物3′端随机增加2个或3个选择性碱基来进行设计的,在AFLP分子标记中的引物是随机组合的,不同的引物组合成不同的引物对,用于选择性扩增。本试验中黄芪AFLP分析所用36对引物分别采用E/M引物“2+2”“2+3”“3+3”(数字2、3表示引物最后的碱基数)组合进行筛选得到。其中5对引物组合(E-AG/M-CGT、E-AT/M-CTG、E-GA/M-CAA、E-TC/M-CAA、E-GT/M-CTG)表现出多态性,多态性比率80.5%,详见图4、图5。


2.5 银染体系的优化
AFLP分子标记中需要进行大量的凝胶电泳试验,凝胶电泳后胶板的显色费时、费力,同时还会受到诸多因素的影响,如电泳电压的高低、显影液的温度、银染的时间、配制胶板的质量、试剂尿素质量的好坏等,都会对银染结果产生影响。本试验参考多种银染方法,进行多次尝试与改进,最终得到优化的银染方法,用6%变性聚丙烯酰胺凝胶电泳、恒定功率为70 W,预电泳时间为30 min,预电泳时间不易过短,电泳时间为120 min。具体步骤如下:(1)固定。将玻璃板从电泳槽中取出,拔出梳子,轻轻将长板取下,放入2 L蒸馏水+20 mL冰乙酸+200 mL无水乙醇溶液中,轻轻摇动15~20 min。(2)漂洗。在2 L蒸馏水中漂洗2次,每次2~3 min。(3)染色。在2 L蒸馏水中加入4 g硝酸银,染色15 min。(4)显影。在2 L蒸馏水中加入60 g氢氧化钠、10 mL甲醛显影至条带清晰为止。(5)中止。当条带不再清晰时,将板取出放入最初配好的固定液中,中止2 min。(6)漂洗。在2 L蒸馏水中漂洗2 min,自然风干,拍照。
3 讨论
黄芪作为内蒙古的特色药用经济植物,被广泛应用在医药中,但目前野生黄芪资源稀缺,所以大多采用人工栽培的方法培育黄芪。近年来,国内外对黄芪的研究除药理活性成分、有效成分提取外,开始从DNA分子水平上研究蒙古黄芪的道地性等并取得了一些进展,而对黄芪分子标记辅助育种、QTL定位、构建遗传图谱的研究则鲜有报道。本研究所探讨的AFLP分子标记在黄芪上的应用,将会为蒙古黄芪遗传多样性研究、图谱构建等奠定基础。
本研究采用AFLP分子标记技术对蒙古黄芪进行分析,结果表明有一定的可行性,扩增条带多、重复性好,为降低试验成本、缩短试验周期、提高试验效率,在体系优化过程中,采用EcoRⅠ/MseⅠ对黄芪基因组DNA进行双酶切,且酶切-连接采用一步法完成,AFLP分子标记虽然操作复杂、对试验技术要求高,但目前仍是一种十分理想、有效的分子标记方法[11]。
对于某一种具体的试验材料药用植物黄芪来说,并不是所有引物对组合都是适宜的,所以大量的试验工作是必须筛选出适合某种具体药用植物的引物对。在进行大量的引物筛选过程中发现,不同引物对组合之间对于选择性扩增反应结果差异很大,有的引物对扩增出的主带多而清晰,差异条带也多,而有的引物对扩增出的条带数较少,有的引物对扩增出的差异条带也很少等。本研究中应用选出的扩增条带信号强、重复性好的5对引物组合对部分黄芪植株进行了分析。试验结果表明,AFLP是标记效率最高的分子标记之一,但其技术操作复杂,影响因素很多,尤其是对该植物基因组信息了解得不是很清楚的情况下,一般选用该植物的同科近缘植物的AFLP引物进行筛选,是一种快速、有效的引物筛选方法。本试验中所筛选的引物来自黄芪同科不同属植物大豆。

