CaCl2和pH值对水酶法提取大豆油形成乳状液破乳效果影响
吴海波,江连洲
CaCl2和pH值对水酶法提取大豆油形成乳状液破乳效果影响
吴海波1,江连洲2※
(1. 钦州学院食品工程学院,钦州 535011;2. 东北农业大学食品学院,哈尔滨 150030)
为探明粗酶水相提取大豆油所产乳状液的破乳机制,通过破乳率、Zeta电位、黏度、粒径分布和平均粒径指标分别考察无机盐和pH值对乳状液稳定性的影响。为了比较无机盐的破乳效果,该文在乳状液中分别添加浓度均为0.06 mol/L的CaSO4、CaCl2、MgCl2、NaCl,80 ℃条件下反应10 min,结果显示4种无机盐均可显著降低乳状液稳定性,其中CaCl2破乳率最高,然后依次为CaSO4、MgCl2、NaCl。尽管CaCl2在60、70、80 ℃时均可实现彻底破乳,但破乳率随CaCl2浓度(0.02~0.08 mol/L)、反应时间(0~90 min)、反应温度(60~80 ℃)的增加而提升。CaCl2实现彻底破乳后,破乳率随反应时间延长而下降。添加CaCl2后乳状液的电位绝对值和黏度降低,油滴发生聚合,平均粒径增加,使乳状液稳定性下降。CaCl2浓度和反应温度的提升均可导致电位绝对值和黏度下降程度增强,破乳率进一步上升。在50 ℃、pH为值3~9时,降低pH值可使乳状液电位绝对值和黏度显著下降,导致油滴平均粒径增加,乳状液稳定性下降。pH值为3~4时乳状液的电位绝对值最低,接近0,此时乳状液稳定性最低,破乳率最高。但当pH值小于3时,乳状液电位绝对值和黏度再次升高,致使油滴平均粒径和破乳率降低。光镜照片显示破乳后乳状液中油珠直径明显增大。该研究可为水酶法提取大豆油破乳技术提供理论依据。
水解;乳状液;稳定性;水酶法;破乳
0 引 言
水相酶法提油工艺是一项以水为提取介质,利用酶解破坏植物油料细胞壁或脂蛋白从而将油释放出来的生物制油技术,具有环境污染小、操作安全、无溶剂残留、油和蛋白同时获得等优点[1-4],被广泛应用于大豆[5]、花生[6]、葵花籽[7], 菜籽[8]、玉米[9]等作物提油工艺中。在水酶法大豆油提取过程中,伴随豆粉的水解,油和蛋白同时解离[10-11],由于蛋白具有良好的乳化性能[12],可迅速吸附于油水之间,形成界面膜包裹在油滴外部,从而形成由多个油滴组成的O/W乳化体系[4]。因此水酶法提取大豆油工艺直接得到的游离油非常有限,仅占总油提取率的10%~25%,而大部分(约75%~90%)油都存在于水油界面之间的乳化层中[12-13],因此若要提高水酶法工艺的经济效益、实现水酶法制油技术的产业化,必须采取适当的破乳方法回收乳状液中的油。
多项研究表明蛋白和磷脂是乳状液中主要的乳化物质[14],特别是蛋白,是维持乳状液稳定的主要贡献者[12-16]。因此许多学者利用破坏蛋白乳化性能进行破乳,例如Zhang等[17-19]利用蛋白酶水解乳状液的生物酶法破乳,Li等[20]使用乙醇、Chabrand[21]采用冷冻解冻方式使蛋白变性,达到破乳目的。但这些研究有的增加了酶的使用,有的使用了有机溶剂,有的能耗较高,造成成本的提高和操作的复杂。
由于蛋白可以解离,因此乳状液油-水界面通常存在着电荷和电位[22],导致各油体间存在静电排斥力,抑制了油滴聚合。无机盐能解离出带电离子,可与蛋白中带相反电荷的基团发生离子反应,产生电中和效应,减弱蛋白电荷[23-25];适宜降低体系pH值,也可中和蛋白所带电荷[14],因此无机盐和降低pH值均可导致乳状液稳定性下降。较于上述破乳方法,无机盐和调节pH值破乳具有成本低、操作简单易行的显著优点。但目前无机盐和pH值破乳研究主要集中于工艺条件的优化[26-27],而无机盐和pH值变化在破乳过程中对大豆乳状液的电位、黏度、粒径影响的系统性研究较少,而这些性质与乳状液的稳定性密切相关[6,15]。Yi等[28]研究证实乳状液的电位绝对值越低,油滴间静电排斥力越弱,乳状液越不稳定。刘丽娅等[29]研究酪蛋白酸钠乳状液时发现乳状液黏度越低,油滴运动所受阻力越小,更易于油滴聚集。而乳状液中油珠平均粒径越大,乳状液稳定性越差[13]。本研究在先前粗酶水相制取大豆油取得较高总油提取率基础上[30],针对其过程中产生的乳状液,分别考察无机盐浓度(0.02~0.08 mol/L)、反应温度(60~80 ℃)和体系pH值(2~9)对乳状液性质(电位、黏度、油滴粒径分布及平均粒径)和破乳率的影响,解析破乳过程中电位、黏度、油滴平均粒径变化与破乳率间的联系,为2种破乳方法提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验原料
大豆(垦农22号),含油率为22.3%,蛋白质量分数为32.7%,贮存于4 ℃冰箱中。
1.1.2 试验菌种与培养基
枯草芽孢杆菌ATCC 20524,购自中国工业微生物菌种保藏中心。
发酵培养基:0.57%低温脱脂豆粕,1.48%葡萄糖,0.05%KH2PO4,0.5%吐温80,pH值9,121℃灭菌20 min。
1.1.3 试验仪器
Master2000型激光粒度仪、ZEM 5003型Zeta电位仪,英国马尔文公司;RS-150型流变仪,德国哈克公司; Z36HK型高速恒温离心机,德国Hermle Labortechnik GmbH公司;PHS-3C 型酸度计,上海盛磁仪器有限公司。
1.2 试验设计及指标测定方法
1.2.1 粗酶液的制备
按吴海波等[30]的方法进行粗酶液的制备,主要步骤为:活化后的枯草芽孢杆菌接入发酵培养基中35 ℃培养42 h,5 000 r/min离心20 min,所得上清液采用硫酸铵盐析沉淀,4 ℃过夜,离心所得沉淀物装入透析袋中,置于Tris-HCl缓冲液中透析,得到去盐的同时含有碱性蛋白酶和中性蛋白酶的粗酶液。
1.2.2 大豆乳状液的制备
在先前粗酶提取大豆油最佳工艺条件下进行乳状液的制备[30]。主要工艺如下
1)将清理去杂后的大豆进行挤压膨化,所得膨化物料粉碎后过100目筛备用。
2)在粗酶液中加入磷酸一氢钠和磷酸二氢钠配制成0.2 mol/L的缓冲酶液,调节粗酶液中的碱性蛋白酶活至(2 000±200) U/mL,中性蛋白酶活至(1 500±200) U/mL,将膨化豆粉接入酶液中,使大豆粉﹕酶液比为1∶8(质量体积比),在55 ℃,起始pH值为10时酶解6 h,90 ℃加热10 min灭酶,4 500 r/min离心20 min后,将乳状液从离心管中分离出来,并置于4 ℃冰箱贮存24 h,去除沉析水分后备用。
1.2.3 不同无机盐对乳状液稳定性影响试验
依据预试验结果将乳状液加热至80 ℃,分别加入CaCl2、CaSO4、MgCl2、NaCl,使各盐浓度均达0.06 mol/L,80 ℃搅拌(300 r/min)反应10 min后,3 000 r/min离心15 min,测其破乳率,破乳率按公式(1)计算。

1.2.4 CaCl2对乳状液稳定性影响试验
将含有不同浓度CaCl2(0.02、0.04、0.06、0.08 mol/L)的乳状液分别在60、70、80 ℃条件下搅拌(300 r/min)反应,同时设置各加热条件下不加CaCl2的空白样,测各样品不同反应时间的破乳率,离心条件为3 000 r/min离心15 min。
乳状液中油的质量依据GB 5009.6-2016中的碱水解法测定。
1.2.5 pH值对乳状液稳定性影响试验
将加热至50 ℃的乳状液,用2 mol/L的HCl和2 mol/L的NaOH将pH值分别调节至2、3、4、4.5、5、6、7、8、9,恒温保持 30 min后,3 000 r/min离心15 min,测各条件下的破乳率。
1.2.6 CaCl2对乳状液表观黏度影响试验
按Jung等[31]方法并稍作修改,具体为:室温条件下,采用流变仪在剪切速率0.01~1 000 s–1范围内对添加CaCl2的乳状液进行黏度测定,其中模具为直径60 mm的平板,间隙为0.5 mm。
1.2.7 CaCl2对乳状液Zeta电位影响试验
将添加CaCl2的乳状液样品用去离子水稀释至0.01%浓度,充分混匀后,装入测量皿,放入Zeta电位仪中测电位电势[32]。
1.2.8 CaCl2对乳状液油脂粒径分布、平均粒径(4, 3)影响试验
将添加CaCl2的乳状液样品用去离子水稀释至11%~14%,室温下采用激光粒径分析仪测定粒径分布曲线和平均粒径(4, 3),其中油滴折光指数为1.47,驱散相折光指数1.333[32]。
1.2.9 pH值对乳状液表观黏度、Zeta电位、油脂粒径分布以及平均粒径(4, 3)影响试验
将pH值分别为2、3、4、4.5、5、6、7、8、9的乳状液于50 ℃加热30 min后,分别按1.2.6、1.2.7、1.2.8的操作方法进行表观黏度、Zeta电位、油脂粒径分布以及平均粒径(4, 3)的测定。
1.2.10 乳状液的微观结构
利用考马斯亮蓝对蛋白质染色,苏丹红Ⅲ对脂肪球染色的原理,将苏丹红Ⅲ和考马斯亮蓝先后加入乳状液中混匀染色,并置于光学显微镜下观察破乳前后乳状液的微观结构。
1.2.11 数据处理系统
所有试验数据均为3个平行样品的均值,采用Statistix8.1软件进行统计分析,判断彼此间的差异显著性(<0.05)。
2 结果与分析
2.1 无机盐对乳状液稳定性的影响
2.1.1 不同无机盐的破乳效果
图1为不同无机盐对乳状液破乳率的影响。由图1可知, 所有样品中,未加盐的样品破乳率最低,而加盐的乳状液破乳率显著增加,说明无机盐可降低乳状液的稳定性。其中CaCl2破乳率最高,然后依次是CaSO4、MgCl2、NaCl。乳状液中油滴外部被以蛋白为主要成分的界面膜所包裹[14-16],由于蛋白可以解离,因此各油体带有电荷,彼此间存在的静电排斥力使乳状液保持一定的稳定性[14, 22]。Arakawa等[33-34]研究证实各盐与蛋白结合能力的强弱排序为Ca2+>Mg2+>Na+。Na+与水的结合能力强于与蛋白的结合能力,Ca2+和Mg2+等二价阳离子更易与蛋白负电基团发生离子反应而与蛋白结合,从而使蛋白电荷下降,油体间排斥力减弱,导致油滴发生聚合[22-23, 25]。其中Ca2+与蛋白的结合能力强于Mg2+[33],导致更大程度的电中和效应,使蛋白聚集程度增强,即油体聚合程度增强,因此含Ca2+的乳状液稳定性更低。
由于CaCl2破乳率最高,因此下面选择CaCl2为破乳剂。
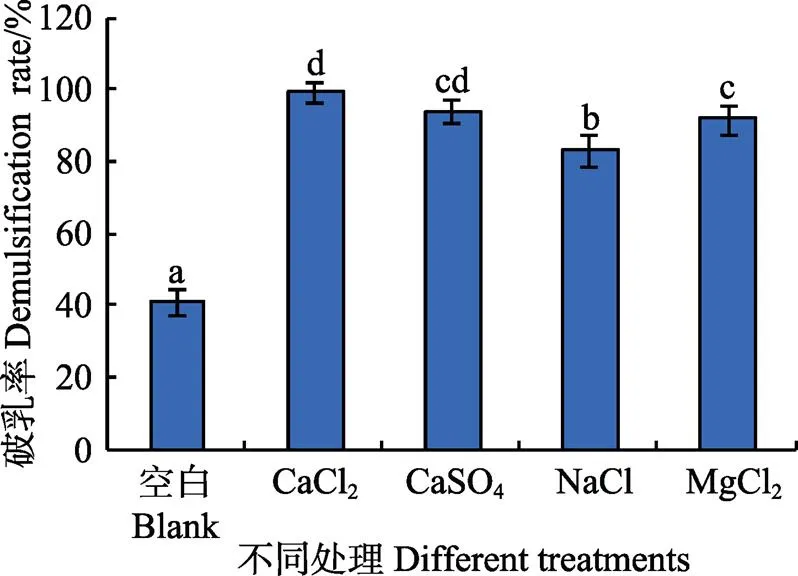
注:图中不同小写字母表示数值间差异显著(P<0.05),下同。
2.1.2 CaCl2对乳状液稳定性的影响
图2为不同温度下CaCl2对破乳率的影响。图2显示在各反应温度下(60、70、80 ℃),添加CaCl2的乳状液破乳率均高于未添加的空白样,特别是在较低CaCl2浓度时,也实现了较好的破乳效果,说明CaCl2有效降低了乳状液的稳定性。
CaCl2浓度和反应时间的增加均会导致破乳率的上升,各浓度CaCl2破乳率变化曲线显示反应初始10 min时,破乳率提升最明显,但实现彻底破乳(破乳率100%)后,破乳率变化曲线随反应时间的延长出现下降趋势,这种破乳率受反应时间影响的变化规律也出现在Jung等[35]的研究结果中。另外,CaCl2破乳效果受反应温度的影响较大,随反应温度升高,破乳率相应增加,实现彻底破乳的时间缩短,这与空白样随温度变化趋势一致。
本试验中含0.02 mol/L CaCl2的乳状液在70、80 ℃分别反应90、30 min时实现彻底破乳,含0.04 mol/L CaCl2的乳状液在60、70、80 ℃分别反应90、50、30 min,实现彻底破乳,而含更高浓度CaCl2的乳状液在各反应温度下实现彻底破乳的时间更短,本着节约能源和降低无机盐使用量的原则,CaCl2破乳条件适宜选择70 ℃时较低浓度的CaCl2。因此下面CaCl2浓度对乳状液相关性质的影响仅在70 ℃条件下进行,而反应温度对乳状液的影响仅在CaCl2添加量为0.02 mol/L时研究。
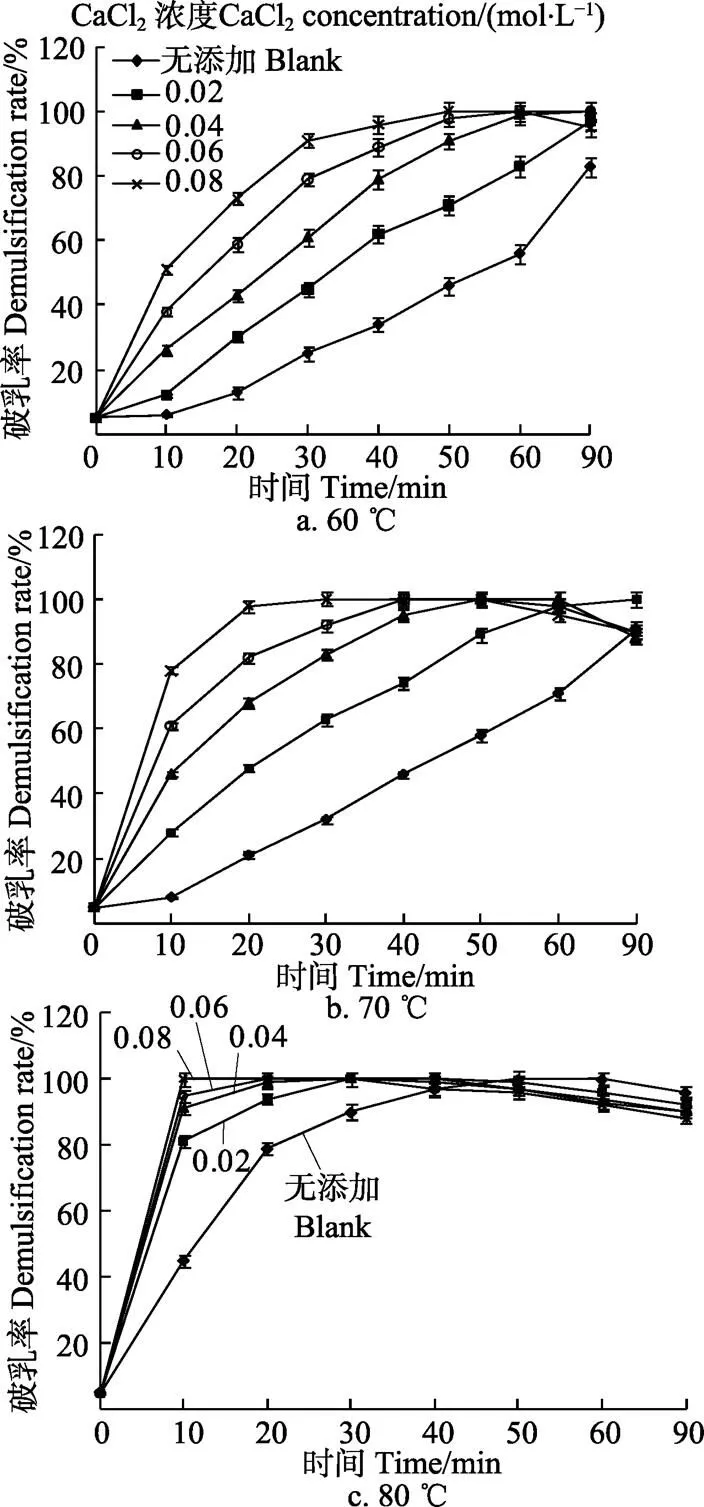
图2 不同温度下CaCl2对破乳率的影响
2.2 pH值对乳状液稳定性的影响
图3为不同pH值条件下的破乳率。图3显示在pH值9时,乳状液最稳定,破乳率最低。随pH值的降低,破乳率逐渐上升,特别当乳状液pH值降至3~4时,破乳率最高,达100%,但随pH值的进一步降低,破乳率出现下降趋势。
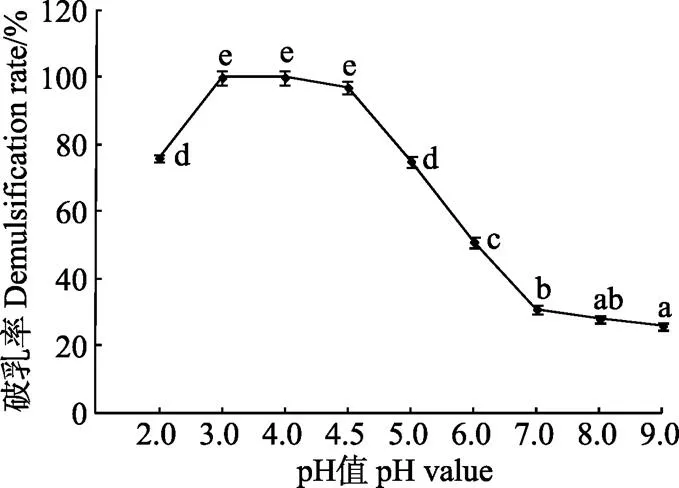
注:反应温度:50 ℃;反应时间:30 min。
Chabrand等[36]采用水酶法提取大豆油,产生的乳状液在50 ℃等电点处反应3 h,破乳率达最高,为83%。同是利用蛋白等电点降低乳状液稳定性,但破乳效果却存在差异,主要原因在于物料前处理方式和水酶法提油阶段酶种类的不同。不同于本试验粗酶液中含有碱性蛋白酶,Chabrand水酶法提油仅采用中性蛋白酶,中性蛋白酶水解蛋白生成乳化性差的短肽能力较弱,因此乳状液具有较强的稳定性[37]。另外,本试验豆粉采用挤压膨化预处理工艺,膨化后的物料更有利于酶对蛋白的充分水解,产生稳定性较低的乳状液[38],而Chabrand采用普通粉碎,所得乳状液稳定性较高,导致pH值对乳状液稳定性影响不显著。因此水酶法提油工艺条件的不同会使所得乳状液稳定性存在差异,导致相同破乳方法破乳效果不同。
2.3 CaCl2和pH值对乳状液黏度的影响
图4为CaCl2和pH值对乳状液黏度的影响。图4a显示在60~80 ℃时,添加CaCl2的乳状液黏度明显低于未添加的空白样,说明CaCl2促进了乳状液黏度的下降;随温度上升,添加CaCl2的样品黏度相应降低。CaCl2浓度的增加也会导致乳状液黏度进一步降低(图4b)。乳状液黏度越低意味着油珠运动所受黏滞阻力越小,油滴更易于聚集[12],因此更高反应温度或含更高浓度CaCl2的乳状液稳定性较低,破乳率较高。
图4c显示乳状液黏度随pH值的降低而下降。pH值在7和9时,乳状液黏度最高,在pH值3~4.5附近乳状液黏度较低,此时油滴运动所受黏滞阻力较弱,油滴运动速度和聚合机率增加,导致乳状液稳定性变差,因此破乳率较高,达97%以上。
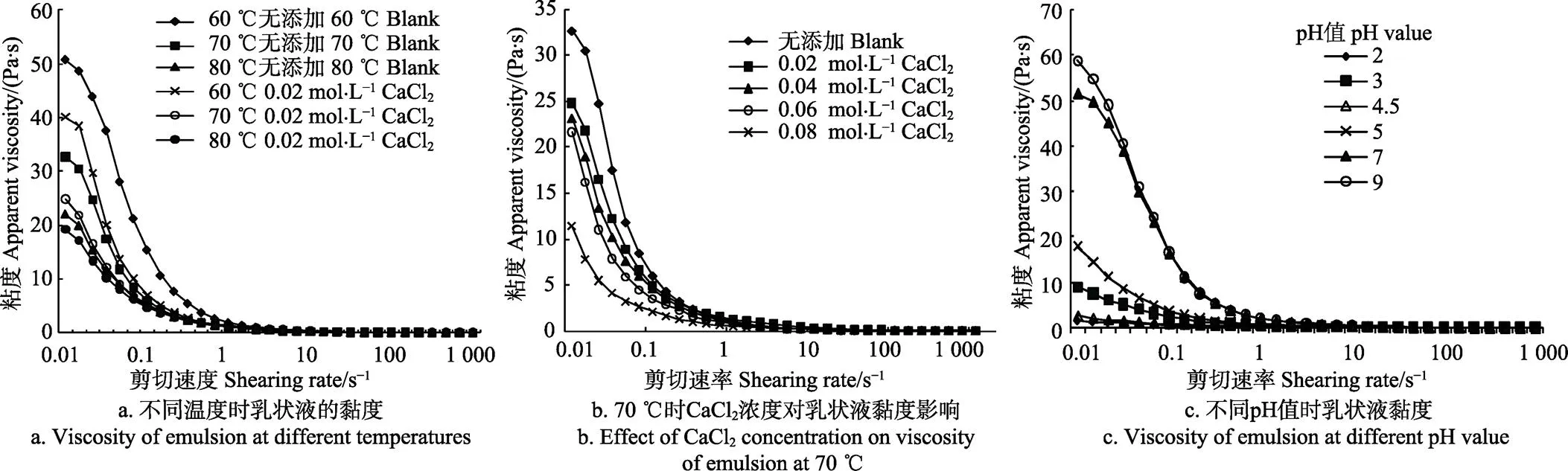
注:图4a与4b中反应时间:20 min;图4c中反应温度:50 ℃,反应时间:30 min。pH值分别为4、6、8时的乳状液粘度分别与pH值为3、7、9的乳状液相似(重叠),故图4c中没有显示。
2.4 CaCl2 和pH值对乳状液Zeta电位的影响
图5为CaCl2和pH值对乳状液电位的影响。由图5a~5b可知未加CaCl2的空白样所带负电荷最高,添加CaCl2后乳状液所带负电荷量明显减少,而且CaCl2浓度和反应温度的增加均会导致乳状液负电荷的进一步降低。值得注意的是,随温度上升,未加CaCl2的空白样电位变化不显著(<0.05),但是添加CaCl2的乳状液电位受温度影响较大。

注:图5a与5b中反应时间:20 min;图5c中反应温度:50 ℃,反应时间:30 min。图5c中pH值分别为6和8时的乳状液电位分别相似于pH值为7和9时,故图中没有显示。
蛋白中的负电荷主要来自于蛋白链中酸性氨基酸解离的COO-,受热时蛋白结构伸展并暴露出这些带电基团[26],当pH值远离蛋白等电点时,二价阳离子,诸如Ca2+,Zn2+,Mg2+均会与带负电荷的COO-反应[22],产生电中和效应,降低负电量。由于本试验所得乳状液pH值不在等电点处,因此受热时CaCl2解离的Ca2+与蛋白负电基团反应,导致蛋白所带负电荷降低,这种现象也出现在Jia等[22-23]的研究中。这种Ca2+与负电基团之间的离子反应降低了蛋白电位,减弱了蛋白间静电排斥力,易于油滴聚集[24],导致乳状液稳定性下降。而提高受热温度可加速Ca2+的解离,并为蛋白结构伸展提供更多的能量,使带电基团充分暴露,更易于Ca2+与带电基团反应[22,25],导致Zeta电位进一步降低,因此增加反应温度或CaCl2浓度均会使乳状液破乳率提升。
由图5c可知乳状液在不同pH值时的电位值差异显著。在pH值为7和pH值为9时,乳状液所带负电荷最高,随pH值降低,乳状液所带负电荷逐渐减少,特别在pH值为3和pH值为4时,所带电荷最低,接近0,说明此时为乳状液蛋白等电点。但当pH值继续降低至2时,Zeta绝对值再次升高,此时蛋白带正电荷。这种乳状液电位值受pH值影响的变化趋势与前人研究结果相似[14, 26]。
由于乳状液中包裹在油体外围的蛋白带有电荷,使油体间存在静电排斥力,抑制了油体聚合,因此乳状液具有一定的稳定性。在pH值为7和pH值为9时乳状液电位绝对值最大,此时油体间存在较大排斥力,乳状液具有良好的稳定性,因此破乳率最低。当乳状液pH值处于3~4时,此时电位绝对值最小,油体间静电排斥力几乎消失,油体发生聚集[39],导致乳状液稳定性下降,破乳率达到最高。
本试验中水酶法提油阶段酶将蛋白水解成小分子的短肽[12],造成表面电荷改变,导致所得乳状液中蛋白等电点不在pH值4.5处,而偏移至pH值3~4。
2.5 CaCl2 和pH值对乳状液粒径分布与平均粒径的影响
图6为CaCl2和pH值对乳状液粒径分布与平均粒径的影响。由图6a~图6d可知,在各反应温度下,添加CaCl2的乳状液油滴粒径分布曲线均位于空白样右侧,油滴平均粒径增加显著,说明CaCl2有效促进了乳状液中油滴的聚合。随反应温度的提升,含CaCl2的乳状液油滴粒径分布曲线相应右移(图6a),平均粒径增加显著(图6b);而CaCl2浓度的增加也会导致更大程度的油脂聚集和油滴平均粒径的增加(图6c~图6d)。
由于Ca2+与蛋白中负电基团的电中和作用,使油体间静电排斥力减弱,同时Ca2+还可在蛋白间形成盐桥,促使蛋白发生交联,导致油滴聚合[22]。提升温度不仅可增强Ca2+与蛋白的反应,进一步减弱油体间静电排斥力(图5a),而且空白样粒径分布曲线显示提升温度还可加速油体运动速率,促进油滴聚集(图6a与图6b),因此提高温度可使含CaCl2乳状液油滴聚集程度增强;更高浓度的CaCl2会导致更大程度的电位绝对值下降(图5b),使油滴更易于聚集。
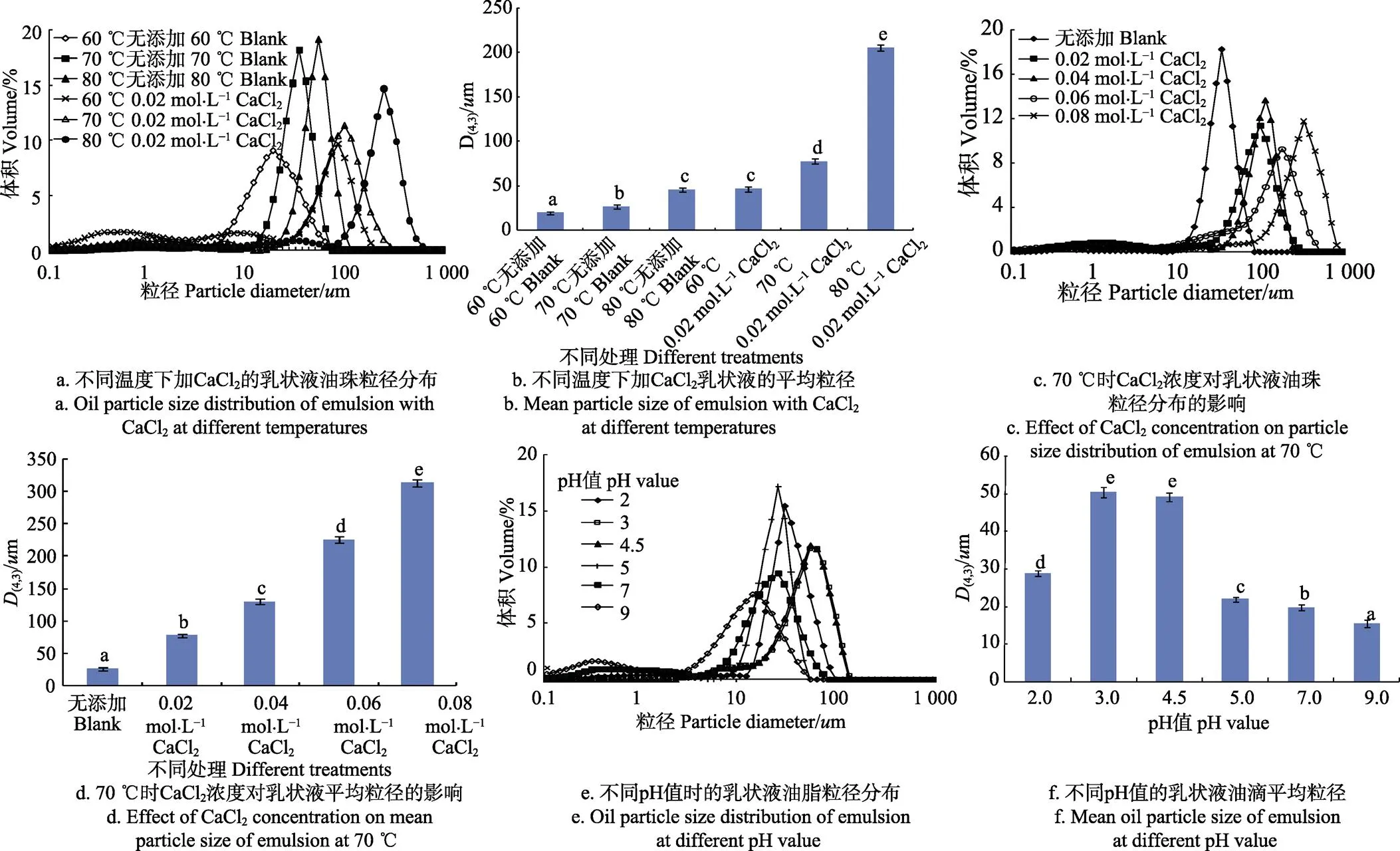
注:图6a~ 6d中反应时间:20 min;图6e、6f中反应温度50 ℃,反应时间30 min。图6e~6f中pH值分别为4、6、8时的乳状液粒径分布与平均粒径分别相似于pH值为3、7、9时的乳状液,故图中没有显示。
图6e~6f显示pH值的降低有效促进了乳状液中油滴的聚集,导致油滴平均粒径增大。乳状液pH值为9时油滴粒径分布曲线呈现2个明显的峰,且均处于较小直径范围内(图6e),说明此时油滴粒径分布不均,乳状液较稳定;随pH值的降低,乳状液油滴粒径分布曲线相应右移,且仅有一个明显可见峰,油珠平均粒径增加显著(<0.05),说明油滴发生聚合,乳状液稳定性下降。特别是当乳状液pH值在3和4.5时,由于油滴间静电排斥力较低(图5c),油滴易于聚合,因此pH值为3和pH值为4.5时的油滴粒径分布曲线处于粒径分布图的最右侧,二者几乎重合,油滴平均粒径也达到最大值,此时乳状液稳定性最差,破乳率最高,分别为100%,97%。
2.6 破乳前后乳状液微结构变化
经苏丹红Ⅲ和考马斯亮兰染色后的乳状液光镜图片显示未破乳的乳状液中油珠粒径普遍较小,且油珠外面包裹着一层明显的蓝色膜(图7a),由考马斯亮兰可将蛋白染成蓝色的特性可知这层蓝色膜即为由蛋白组成的油水界面膜。当添加CaCl2后或者将乳状液pH值调至4.5时,由于油珠间静电排斥力减弱,油滴发生聚合,此时乳状液中油滴粒径比破乳前明显增大(图7b~图7c)。图7b和图7c中深色部分为由于电荷降低导致凝集的蛋白。
未完全破乳的乳状液离心后油相与水相之间存在着较厚的乳状层(图7e),还有部分油残存其中未释放;而彻底破乳的乳状液离心后,油、水相之间无乳状层存在,油脂全部释放,乳状液中的蛋白沉淀在管的底部(图7d)。
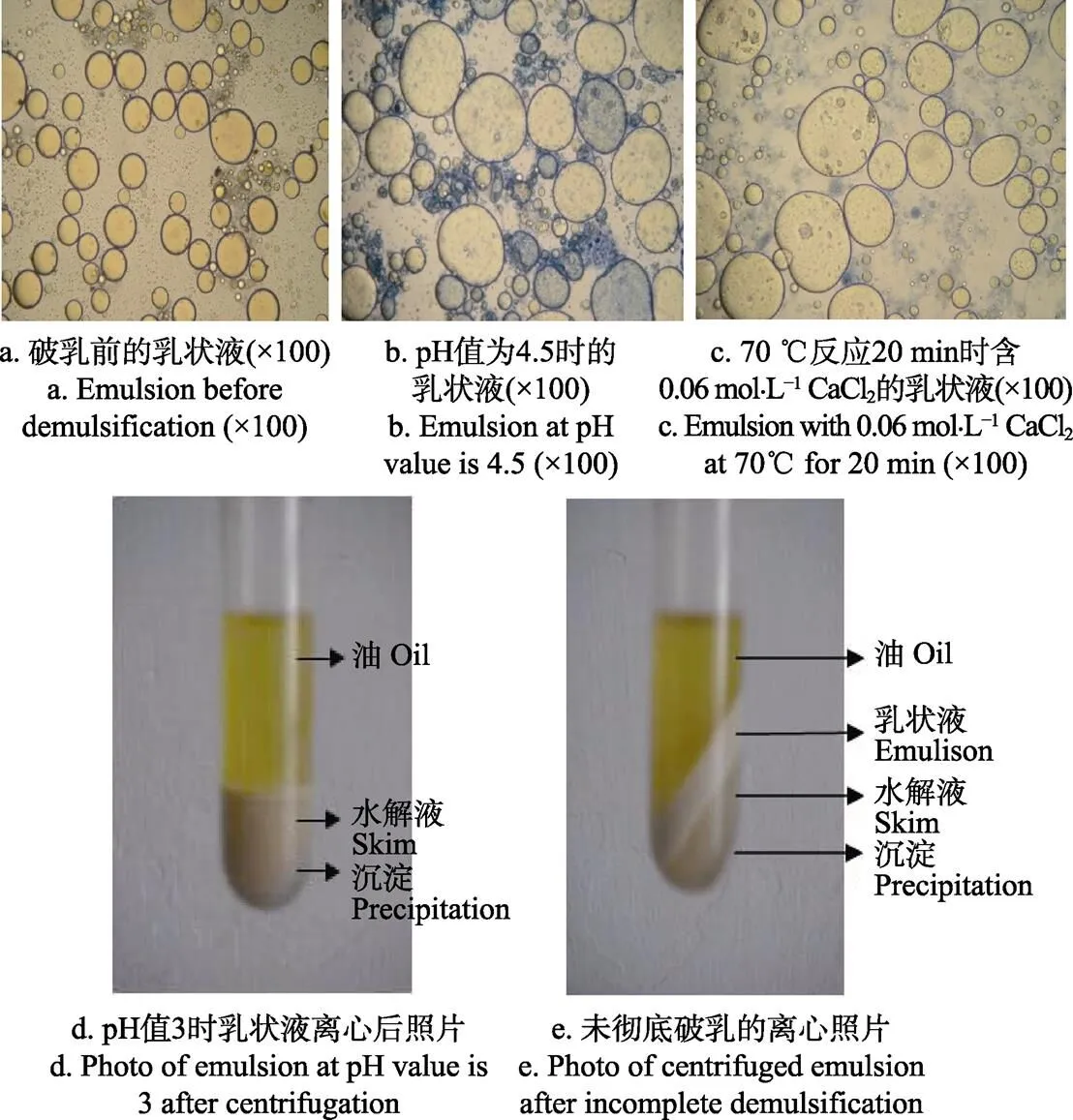
图7 破乳前后乳状液的微结构及破乳离心后的乳状液图片
3 结 论
针对粗酶水相提取大豆油过程中所形成的乳状液,采用添加无机盐和调节pH值的方式进行破乳。试验结果显示添加CaCl2(0.02~0.08 mol/L)或者降低乳状液pH值(3~9)均可降低乳状液的稳定性,其机理为CaCl2的添加或体系pH值的降低均使乳状液电位绝对值和黏度下降,促使油滴发生聚合,油滴平均粒径增大,导致乳状液稳定性降低。CaCl2浓度和反应温度的增加,促使乳状液电位绝对值和黏度下降程度增强,导致乳状液稳定性进一步降低。添加0.04 mol/L CaCl2的乳状液在60、70、80 ℃分别反应90、50、30 min均可实现彻底破乳;而调节乳状液pH值至3~4,50 ℃作用30 min时破乳率达100%。光镜图片显示破乳前后乳状液微观结构存在明显差异。本研究为CaCl2和pH值破乳技术提供了试验参考和理论依据,有益于水酶法提油技术的应用与推广。
[1] Liu Junjun, Gasmalla M A A, Li Pengfei, et al. Enzyme-assisted extraction processing from oilseeds: Principle, processing and application[J]. Innovative Food Science and Emerging Technologies, 2016, 35: 184-193.
[2] Teixeira C B, Macedo G A, Macedo J A. Simultaneous extraction of oil and antioxidant compounds from oil palm fruit (Elaeis guineensis) by an aqueous enzymatic process[J]. Bioresource Technology, 2013, 12: 575-581.
[3] Tabtabaei S, Diosady L L. Aqueous and enzymatic extraction processes for the production of food-grade proteins and industrial oil from dehulled yellow mustard flour[J]. Food Research International, 2013, 52: 547-556.
[4] Moura J M L N D, Maurer D, Yao L, et al. Characteristics of oil and skim in enzyme-assisted aqueous extraction of soybeans[J]. Journal of the American Oil Chemists' Society, 2013, 90: 1079-1088.
[5] 吴海波,齐宝坤,江连洲,等. 挤压膨化联合粗酶添加对水相制取大豆油和蛋白质的影响[J]. 中国食品学报,2017,17(10):71-79.Wu Haibo, Qi Baokun, Jiang Lianzhou, et al. Effect of extrusion pretreatment and crude on oil and protein from aqueous extraction processing of soybean[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(10): 71-79.
[6] Zhang S B, Lu Q Y. Characterizing the structural and surface properties of proteins isolated before and after enzymatic demulsification of the aqueous extract emulsion of peanut seeds[J]. Food Hydrocolloids, 2015, 47: 51-60.
[7] Campbell K A, Vaca-Medina, G, Glatz C E, et al. Parameters affecting enzyme-assisted aqueous extraction of extruded sunflower meal[J]. Food Chemistry, 2016, (208): 245-251.
[8] Yusoff M M, Gordon M H, Niranjan K. Aqueous enzyme assisted oil extraction from oilseeds and emulsion de- emulsifying methods: A review[J]. Trends in Food Science & Technology, 2015, 41(1): 60-82.
[9] Shende D, Sidhu G K. Response surface methodology to optimize enzyme-assisted aqueous extraction of maize germ oil[J]. Journal of Food Science and Technology-mysore, 2016, 53: 3282-3295.
[10] Rovarisa A A, Diasa C O, de Cunhab I P. Chemical composition of solid waste and effect of enzymatic oil extraction on the microstructure of soybean (Glycine max) [J]. Industrial Crops and Products, 2012, 36: 405-414.
[11] Campbell K A, Glatz C E, Johnson L A. Advances in aqueous extraction processing of soybeans[J]. Journal of the American Oil Chemists' Society, 2011, 88 (4): 449-465.
[12] Wu J, Johnson L A, Jung S. Demulsification of oil-rich emulsion from enzyme-assisted aqueous extraction of extruded soybean flakes[J]. Bioresource Technology, 2009, 100: 527-533.
[13] Lamsal B P, Johnson L A. Separating oil from aqueous extraction fractions of soybean[J]. Journal of the American Oil Chemists' Society, 2007, 84(8): 785-792.
[14] Li Pengfei, Gasmalla M A A, Liu Junjun, et al. Characterization and demusification of cream emulsion from aqueous extraction of peanut[J]. Journal of Food Engineering, 2016, 185: 62-71.
[15] Zhang S B, Wang T. Destabilization of emulsion formed during aqueous extraction of peanut oil: Synergistic effect of tween 20 and pH[J]. Journal of the American Oil Chemists' Society, 2016, 93(11): 1551-1561.
[16] Fang X, Moreau R A. Extraction and demulsification of oil from wheat germ, barley germ, and rice bran using an aqueous enzymatic method[J]. Journal of the American Oil Chemists' Society, 2014, 91(7): 1261-1268.
[17] Zhang S, Liu X, Lu Q, et al. Enzymatic demulsification of the oil-rich emulsion obtained by aqueous extraction of peanut seeds[J]. Journal of the American Oil Chemists' Society, 2013, 90(8): 1261-1270.
[18] Bagnasco L, Pappalardo V M, Meregaglia A, et al. Use of food-grade proteases to recover umami protein–peptide mixtures from rice middlings[J]. Food Research International, 2013, 50: 420-427.
[19] Towa L T, Kapchie V N, Wang G, et al. Quantity and quality of free oil recovered from enzymatically disrupted soybean oleosomes[J]. Journal of the American Oil Chemists' Society, 2011, 88: 1581-1591.
[20] Li Yang, Sui Xiaonan, Qi Baokun et al. Optimization of ethanol-ultrasound-assisted destabilization of a cream recovered from enzymatic extraction of soybean oil[J]. Journal of the American Oil Chemists' Society, 2014, 91(1): 159-168.
[21] Chabrand R M, Kim H, Zhang C, etal. Destabilization of the Emulsion Formed during Aqueous Extraction of Soybean Oil[J]. Journal of the American Oil Chemists' Society, 2008, 85(4): 383-390.
[22] Jia D, You J, Hu Y, et al. Effect of CaCl2on denaturation and aggregation of silver carp myosin during setting[J]. Food Chemistry, 2015, 185: 212-218.
[23] Ding Y, Liu Y, Yang H, et al. Effects of CaCl2on chemical interactions and gel properties of surimi gels from two species of carps[J]. European Food Research and Technology, 2011, 233: 569-576.
[24] Chantarasuwan C, Benjakul S, Visessanguan W. The effects of sodium bicarbonate on conformational changes of natural actomyosin from Pacific white shrimp (Litopenaeus vannamei) [J]. Food Chemistry, 2011, 129(4): 1636-1643.
[25] Arfat Y A, Benjakul S. Impact of zinc salts on heat-induced aggregation of natural actomyosin from yellow stripe trevally[J]. Food Chemistry, 2012, 135(4): 2721-2727.
[26] 韩宗元,李晓静,江连洲,等. 响应面优化等电点法破乳工艺[J]. 中国粮油学报,2016,31(1):43-47. Han Zongyuan, Li Xiaojing, Jiang Lianzhou, etal. The response surface optimization of demulsification processing by isoelectric point method[J]. Journal of the Chinese Cereals and Oils Association, 2016, 31(1): 43-47.
[27] 何秋实响应面优化无机盐破乳工艺研究[J]. 食品工业科技,2012,33(24): 304-306. He Qiushi Response surface optimization of inorganic salts demulsification process[J]. Science and Technology of Food Industry, 2012, 33(24): 304-306.
[28] Yi J H, Zhu Z B, Mcclements D J, et al. Influence of aqueous phase emulsifiers on lipid oxidation in water-in-walnut oil emulsions[J]. Journal of Agriculture & Food Chemistry, 2014, 62(9): 2104-2111.
[29] 刘丽娅,赵强忠,孔静,等. 黄原胶对酪蛋白酸钠乳状液稳定性的影响[J]. 食品工业科技,2012,5(33):83-86. Liu LiYa, Zhao Qiangzhong, Kong Jing, et al. Effect of xanthan gum on the stability of sodium caseinate emulsion[J]. Science and Technology of Food Industry, 2012, 5(33): 83-86.
[30] 吴海波,江连洲,程建军,等. 粗酶水解全脂豆粉提取油脂与蛋白[J]. 农业工程学报,2011,4(27):376-382. Wu Haibo, Jiang Lianzhou, Cheng JianJun, et al. Oil and protein simultaneously extracted from soybean using crude enzyme produced by microbial fermentation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 4(27): 376-382.
[31] Jung S, Mahfuz A A. Low temperature dry extrusion and high-pressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J]. Food Chemistry, 2009, 114(3): 947-954.
[32] Nikiforidis C V, Kiosseoglou V. Aqueous extraction of oil bodies from maize germ () and characterization of the resulting natural oil-in-water emulsion[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 5591-5596.
[33] Arakawa T, Timasheff S N. Mechanism of protein salting in and salting out by divalent cation salts: balance between hydration and salt binding[J]. The Journal of biochemistry, 1984, 25: 5912–5923.
[34] Lertwittayanon K, Benjakul S, Maqsood S, et al. Effect of different salts on dewatering and properties of yellowtail barracuda surimi[J]. International Aquatic Research, 2013, 5(1): 1-12.
[35] Jung S, Maurer D, Johnson L A. Factors affecting emulsion stability and quality of oil recovered from enzyme-assisted aqueous extraction of soybeans[J]. Bioresource Technology, 2009, 100: 5340-5347.
[36] Chabrand R M, Glatz C E. Destabilization of the emulsion formed during the enzyme-assisted aqueous extraction of oil from soybean flour[J]. Enzyme and Microbial Technology, 2009, 45(1): 28-35.
[37] Yin S W, Tang C H, Cao J S, et al. Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp (Cannabis sativa L.) protein isolate[J]. Food Chemistry, 2008, 106: 1004-1013.
[38] Moura J M L N D, Almeida N M D, Jung S, et al. Flaking as a pretreatment for enzyme-assisted aqueous extraction processing of soybeans[J]. Journal of the American Oil Chemists' Society, 2010, 87 (12): 1507-1515.
[39] Mcclements D J. Food Emulsions: Principles, Practice, and Techniques[M]. (2nd edition). Boca Raton: CRC Press, 2005.
Effect of CaCl2and pH value on demulsification of emulsion from enzyme-assisted aqueous extraction processing of soybean oil
Wu Haibo1, Jiang Lianzhou2※
(1.535011,; 2.150030,)
To explore the demulsification mechanism of emulsion recovered from crude enzyme-assisted aqueous extraction processing of extruded full fat soybean flour,the effect of salt and pH value on the emulsion stability was investigated respectively by demulsification rate, Zeta potential, apparent viscosity, particle size distribution and mean oil particle size. For evaluating the efficiency of salt demulsifying the emulsion, CaSO4, CaCl2, MgCl2, NaCl were separately added into the emulsion at concentration 0.06 mol/L, reaction time 10 min, and temperature 80 ℃. The experiment results showed 4 salts significantly destabilized the emulsion, but the highest free oil yield was recoveried from the emulsion added with CaCl2,followed by CaSO4, MgCl2,NaCl. Although the emulsion added with CaCl2was completely broken (100% free oil recovery) at 60, 70, 80 ℃respectively, demulsification effect was impacted by CaCl2concentration, reaction time, reaction temperature. Demulsification rate progressively rose with CaCl2concentrations increasing from 0.02 to 0.08 mol/L, reaction times from 0 to 90 min, reaction temperatures from 60 to 80 ℃. However, demulsification rate decreased with the increase of reaction time after the emulsion was completely broken. As Ca2+neutralised the negative charge of the protein during heating, apparent viscosity and the absolute value of Zeta potential of the emulsion added with CaCl2declined significantly compared with the control (without CaCl2addition), which induced oil droplets aggregate and mean oil droplet size increase so that the stability of the emulsion decreased.Due to the greater screening effect of the higher Ca2+concentration and reaction temperature on the negatively charged groups of proteins, the increase of CaCl2concentrations ranging from 0.02 to 0.08 mol/L and reaction temperatures from 60 to 80 ℃further reduced the absolute value of Zeta potential and apparent viscosity of the emulsion, and promoted the oil droplets aggregation. This resulted the higher free oil recovery. With pH value decreasing from 9 to 3 at 50 ℃, the absolute value of Zeta potential and apparent viscosity of the emulsion declined significantly, the average oil particle size increased so that the stability of the emulsion reduced, and the free oil recovery increased. Specially, the stability of the emulsion was the lowest and free oil recovery achieved the highest (100% free oil recovery) at pH value 3-4 because the absolute value of Zeta potential reached the lowest level (closed to 0), which meant the electrostatic repulsion forces between protein molecules of the emulsion nearly disappeared. When pH value dropped below 3, however, the absolute value of Zeta potential and apparent viscosity of the emulsion increased again so that the mean oil droplet size and demulsification rate decreased. Light micrographs showed that there were significant differences in the microstructure and oil recovery of the emulsion before and after demulsification. Oil drop diameter of the emulsion apparently enlarged, and more free oil was released after demulsification and centrifugation. This research can provide the theory foundation of destabilization strategies for the emulsion formed during enzyme-assisted aqueous extraction processing of soy oil.
hydrolysis; emulsions; stability; enzyme-assisted aqueous extraction; demulsification
吴海波,江连洲.CaCl2和pH值对水酶法提取大豆油形成乳状液破乳效果影响[J]. 农业工程学报,2018,34(23):299-306. doi:10.11975/j.issn.1002-6819.2018.23.038 http://www.tcsae.org
Wu Haibo, Jiang Lianzhou.Effect of CaCl2and pH value on demulsification of emulsion from enzyme-assisted aqueous extraction processing of soybean oil[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(23): 299-306. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.23.038 http://www.tcsae.org
2018-7-21
2018-10-18
国家自然科学基金重点项目(3143000560)
吴海波,副研究员,博士,研究方向为粮食、油脂及植物蛋白工程。Email:haibowu2004@sina.com
江连洲,教授,博士,研究方向为粮食、油脂及植物蛋白工程。Email:lzjname@163.com
10.11975/j.issn.1002-6819.2018.23.038
TS224.2
A
1002-6819(2018)-23-0299-08

