ORAI1基因rs3741596单核苷酸多态性与川崎病的关系
巴爽,张宏艳
川崎病(Kawasaki disease,KD)是儿童时期获得性心脏病的重要诱因,在世界范围均有报道,其中亚裔儿童发病率最高,且呈逐年增多趋势。多年来,各国学者对KD病因学及发病机制进行了不断探索,发现KD可能并发严重的冠状动脉病变(coronary artery lesions,CALs),后者包括冠状动脉扩张、冠状动脉瘤、冠状动脉重塑、冠状动脉狭窄及闭塞、冠状动脉瘘;其严重程度差别很大,轻者短期可恢复正常,重者持续异常,是KD的主要死亡原因[1-2]。经规范应用静脉输注丙种球蛋白(IVIG)治疗后,仍有5%左右的KD患者发生CALs[1]。但是临床上尚无在早期识别这些患者的可靠指标。
多项研究表明,钙释放激活钙调节蛋白1(ORAI1)基因单核苷酸多态性(SNPs)与炎症性疾病的发生相关[3-4]。ORAI1基因SNP与KD相关性的研究存在不同的结论。Kuo等[5]研究表明ORAI1基因SNP与中国台湾儿童KD发病无关。而Onouchi等[6]研究证实,该基因SNP与日本儿童KD发病有关。研究结果的差异可能与种族差异及遗传异质性有关。而ORAI1rs3741596 SNP与KD及并发CALs的相关性研究在国内尚鲜见报道。本研究通过PCR技术扩增目的基因,联合基因直接测序技术检测所有研究对象基因组DNAORAI1基因rs3741596位点SNP,旨在探讨该基因位点基因型分布及等位基因频率与KD发病及合并CALs是否存在相关性,为早期确诊CALs人群和寻求新的治疗方法提供可靠的分子生物学指标。
1 对象与方法
1.1 研究对象 本研究选取2016年2月—6月在天津市儿童医院确诊KD并住院治疗的46例患儿纳入病例组,其中男30例,女16例,年龄2个月~8岁,平均(3.39±1.77)岁。所有病例均符合KD诊断标准,所有患儿均在应用IVIG治疗前行超声心动检查,根据是否合并CALs[8],将病例组分为CAL组(男15例,女5例)和NCAL组(男15例,女11例)2个亚组。收集同期天津市儿童医院门诊行健康体检的儿童25例纳入对照组,男17例,女8例,年龄6个月~7岁,平均(3.72±1.65)岁,均排除近期川崎病、感染性疾病及其他免疫系统疾病等病史。所有研究对象均为汉族,病例组和对照组年龄(t=1.270,P=0.206)及性别比例(χ2=0.056,P=0.813)差异无统计学意义,相互之间无血缘关系。本研究获医院伦理委员会批准并征得所有研究对象的法定监护人同意。
1.2 方法
1.2.1 标本采集 使用一次性真空采血管(EDTA抗凝)空腹采集研究对象2 mL外周静脉血,置于-80℃冰箱保存用于提取DNA。
1.2.2 基因组DNA提取 应用CWBIO公司生产的血液基因组柱式小量提取试剂盒(Blood Genomic DNA mini kit)提取基因组DNA,严格按照试剂盒说明书进行操作,所得DNA样本置于-20℃冰箱保存。
1.2.3 PCR扩增、测序和分析 本实验根据美国国立生物技术信息中心(National Center For Biotechnology Information,NCBI)(http://www.ncbi.nlm.nlh.gov)公布的ORAI1基因序列rs3741596位点设计引物。引物:上游5′-CAGGTGGCAATG⁃GTGGAG-3′,下游5′-TGTCGGTCAGTCTTATGGCT-3′。引物由生工生物工程(上海)股份有限公司合成,最终浓度为10µmol/L。PCR反应体系为30µL,包括基因组DNA 1µL,上、下游引物各0.8µL(10µmol/L),2×MIX混合液15µL,ddH2O 12.4µL。应用德国Eppendorf公司生产的PCR扩增仪进行反应。PCR反应条件:95℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,共进行35个循环;最后72℃延伸5 min。取3µL PCR产物行1.5%琼脂糖凝胶电泳,并采用凝胶成像系统照相和图像分析。取506 bp处扩增条带阳性标本的PCR产物25µL,委托生工生物工程(上海)股份有限公司进行直接测序。应用Chromas软件分析直接测序结果,利用NCBI网站在线BLAST对所获得序列进行在线检测。
1.3 统计学方法 采用SPSS 20.0软件进行统计学分析。应用拟合优度检验判断全部研究对象基因型频率是否符合Hardy-Weinberg平衡;采用χ2检验比较KD病例组与对照组及CAL组与NCAL组之间基因型频率及等位基因频率分布差异;通过计算优势比(odds radio,OR)及其95%置信区间(95%CI)分析KD的发生及并发CALs与ORAI1rs3741596位点SNP的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 PCR扩增结果 按前述PCR反应体系及条件扩增,经1.5%琼脂糖凝胶电泳,ORAI1基因rs3741596位点扩增产物目标片段长度为506 bp。以MarkerⅠ为核酸分子质量参照标准,以ddH2O作为空白对照,PCR产物条带位于500~600 bp之间,扩增产物为目标片段,符合实验要求。条带荧光亮度较强,且附近没有其他条带,表明其浓度与纯度可达直接测序的要求。结果见图1。
2.2 PCR产物测序结果 测序所得ORAI1基因rs3741596位点序列与NCBI网站基因库数据(http://www.ncbi.nlm.nlh.gov/BLAST)进行对比。对比结果显示,PCR产物测序的基因序列和NCBI网站公布的ORAI1基因rs3741596位点的基因序列相符,一致性达99%。
所有研究对象基因组DNA均检测到ORAI1基因SNP rs3741596位点,该位点基因型为AA、AG和GG 3种,如图2所示。其中病例组AA基因型35例,AG基因型9例,GG基因型2例;对照组AA基因型21例,AG基因型3例,GG基因型1例。
2.3 Hardy-Weinberg平衡检验ORAI1基因SNP rs3741596 AA、AG及GG 3种基因型在KD病例组的分布(χ2=1.727,P=0.189)及在对照组的分布(χ2=2.778,P=0.096),均符合Hardy-Weinberg平衡定律,达到遗传平衡,具有群体代表性。

Fig.1 A electrophoresis of PCR products图1 PCR产物电泳图

Fig.2 Sequence diagram of ORAI1 gene rs3741596图2 ORAI1基因rs3741596位点测序图
2.4ORAI1基因rs3741596位点基因型和等位基因频率分布的比较 KD病例组和对照组间ORAI1基因rs3741596位点AA、AG及GG基因型频率分布及等位基因频率分布差异无统计学意义(P>0.05),见表1。CAL组和NCAL组间ORAI1基因rs3741596位点AA、AG和GG基因型频率分布及等位基因频率分布差异有统计学意义(P<0.05),见表2。G等位基因可能增加KD患儿并发CALs的危险性(OR=5.444,95%CI:1.386~21.380)。

Tab.1 Comparison of genotype frequency and allele frequency of ORAI1 gene rs3741596 between KD case group and control group表1 ORAI1基因rs3741596位点KD病例组和对照组基因型及等位基因频率比较 例(%)
3 讨论
由于KD并发的CALs可能引起的严重后果,预防CALs的发生和早期识别CALs的高危人群是众多科学家研究的课题。目前临床上将CALs严重程度分为Ⅰ~Ⅴ级,其中Ⅲ~Ⅴ级冠状动脉病变较重,预后较差[8]。国内外多项临床研究表明,低龄(<1岁或<6个月)、男性、低白蛋白血症、血小板增多等可能是CALs发生的危险因素[8-10]。目前关于CALs的早期识别在临床表现及化验检查方面寻找评价指标的研究多缺乏特异性,对于一些化验指标很难确定其节点。韩国一项回顾性研究显示,近几年确诊的KD患者临床表现较10年前的患者相对不典型,不完全KD发病率增高;另外,实验室检查中严重(明显异常)的结果较前减少,与10年前的KD患者相比,C反应蛋白(CRP)及血小板计数下降、白蛋白水平增高[11]。本研究从分子生物学层面,寻找CALs的易感基因,旨在从病因学角度阐明CALs的高危因素,为进一步病因治疗提供理论依据。
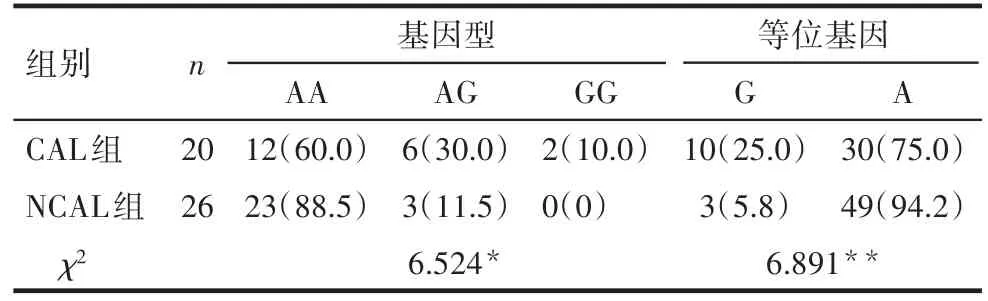
Tab.2 Comparison of genotype frequency and allele frequency of ORAI1 gene rs3741596 between CAL group and NCAL group表2 ORAI1基因rs3741596位点CAL组和NCAL组基因型及等位基因频率分布 例(%)
3.1ORAI1分子结构及生理功能ORAI1基因定位于12q24,后者已被证实与KD的易感连锁关系最密切[最大 LOD 值(MLS)=2.69][12]。本研究选择了ORAI1基因rs3741596位点SNP,该位点A突变为G,引起非同义突变,使相应密码子编码的氨基酸由丝氨酸变为甘氨酸。每个ORAI1单体在细胞膜上共跨越4次,在细胞外形成两个环,在胞浆内形成一个环,并且包括N-末端及C-末端。位于细胞膜上的ORAI1亚基以六聚体形式组成了钙激活钙释放通道(Ca2+release-activated Ca2+channel,CRAC)[13],被定位在内质网膜上的基质相互作用分子(stormal interaction molecule,STIM)所激活,介导钙库操控的钙内流(store-operated Ca2+entry,SOCE),使位于胞浆中的活化T细胞核因子(NFAT)去磷酸化,并促进后者向细胞核转移,参与转录调控,引起免疫细胞活化[14]。而具备遗传易感性的个体对病原体感染发生过度的免疫应答,引起多种免疫细胞活化并产生大量细胞因子,启动细胞因子瀑布反应,造成血管内皮细胞、平滑肌细胞等损伤,最终引起血管壁结构破坏,是目前比较认可的KD发病机制假说[15]。
3.2ORAI1基因与血管损伤的关系 本研究发现,ORAI1基因rs3741596位点SNP与KD的易感性无关,而可能与KD并发CALs有关,且携带G等位基因可能使KD患儿发生CALs的危险性增高。有研究证实,SOCE失调与血管疾病(血管内皮细胞及平滑肌细胞损伤)相关,ORAI1分子功能改变将直接影响SOCE功能[16]。Yu等[17]研究表明,敲低ORAI1将阻止肿瘤坏死因子(TNF)-α介导的NFATc4核易位,降低细胞间黏附分子-1(ICAM-1)及血管细胞黏附分子-1(VCAM-1)在人脐静脉内皮细胞(HUVEC)中的表达及血浆中前炎症因子水平,继而抑制单核细胞与HUVEC的黏附,从而抑制血管内皮活化及血管炎症。另有研究发现,显性失活CRAC亚基的过度表达抑制HUVEC中组胺激发、STIM1及ORAI1介导的钙内流;反之,STIM1及ORAI1联合表达将增强钙内流,从而证实ORAI1和STIM1在内皮细胞炎症信号中发挥重要作用[18]。众所周知,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是构成血管壁的主要成分,参与维持血管正常生理功能。Bisaillon等[19]通过动物实验证实,STIM1和ORAI1是血管源性生长因子(PDGF)介导的钙内流及VSMCs迁移过程中的重要组成部分,两者在体内血管损伤及新生内膜形成过程中上调。Avila-Medina等[20]提出,SOCE与许多生理过程相关,如血管张力调节、血管再生、VSMC增殖等;抑制ORAI1会很大程度减弱SOCE,从而抑制激动剂诱导的冠状动脉收缩。在药物治疗领域,通过抑制ORAI1介导的钙内流可起到预防冠状平滑肌细胞增生的作用,药物洗脱支架上所用的雷帕霉素就是基于此原理[21]。
综上,本研究结果表明,ORAI1基因rs3741596位点SNP可能与KD并发CALs易感性有关,携带G等位基因可能使KD患儿发生CALs的危险性增高。其机制可能为该位点非同义突变致ORAI1蛋白功能改变,引起SOCE增强,使细胞内钙超载,最终导致血管内皮细胞和其他细胞损伤而形成CALs。推测通过检测ORAI1基因rs3741596 SNP位点可能会成为筛查KD并发CALs高危因素的临床应用指标,ORAI1可能成为治疗炎症性疾病的新靶标,对于制定个体化治疗方案及预后的预测有重要意义。

