牙鲆原代肾细胞培养及其对牙鲆弹状病毒的易感性研究❋
张家林, 唐小千, 绳秀珍, 邢 婧, 战文斌
(中国海洋大学水产学院水产动物病害与免疫实验室,山东 青岛 266003)
牙鲆原代肾细胞培养及其对牙鲆弹状病毒的易感性研究❋
张家林, 唐小千**, 绳秀珍, 邢 婧, 战文斌
(中国海洋大学水产学院水产动物病害与免疫实验室,山东 青岛 266003)
为探索牙鲆弹状病毒(HIRRV)对敏感宿主牙鲆肾脏原代细胞的敏感性,本研究分别采用组织块移植法和胰酶消化法对牙鲆(Paralichthysolivaceus)肾脏细胞进行分离和原代培养。研究显示,采用组织块移植法进行培养后,会出现较多的成纤维样细胞,而采用胰酶消化法进行培养后,细胞呈现上皮细胞样且形态完整,7天后细胞的汇合率可达80%。采用胰酶消化法对牙鲆肾细胞进行原代培养,传代后进行病毒敏感性实验,实验表明牙鲆肾细胞接种HIRRV后,第3天出现了明显的CPE,病毒滴度达1×105.8TCID50/mL;RT-PCR可从感染3天的细胞培养物中检测到HIRRV的特异性mRNA;利用抗HIRRV单克隆抗体结合免疫荧光试验可从感染24 h的细胞中检测到特异性荧光信号,信号分布在细胞膜和细胞质中。研究结果表明,基于胰酶消化法建立的牙鲆肾脏原代细胞对HIRRV较敏感,HIRRV可成功侵染该细胞并在细胞内实现快速增殖。本研究为牙鲆弹状病毒的致病机制研究提供了材料和实验基础。
牙鲆;原代细胞培养;胰酶消化法;牙鲆弹状病毒;敏感性
牙鲆弹状病毒(Hirame rhabdovirus, HIRRV)是一种重要的鱼类弹状病毒,主要感染牙鲆(Paralichthysolivaceus)、香鱼(Plecoglossusaltivelis)、石鲽(Kareiusbicoloratus)、黑鲷(Myliomacrocephalus)、茴鱼(Thymallusthymallus)、花鲈(Lateolabraxmacu-latus)等鱼类[1-5],给水产养殖业造成了巨大的经济损失。感染鱼的症状主要表现为鳍基充血,肌肉组织及内部器官出血,造血器官坏死,死亡率高达60%[6]。该病毒主要在中国、日本和韩国等冬季冷水区域流行,欧洲的波兰等地也有该病毒的分离报道[4]。该病毒具有传染性强、死亡率高的特点,严重威胁我国鲆鲽鱼类的健康养殖。然而,目前市场上缺少有效的治疗药物和预防性疫苗。因此,亟需对该病毒的毒力特性及其致病机理等方面进行深入的研究。
牙鲆隶属于硬骨鱼纲(Osteichthyes) 鲽型目(Pleuronetiformes) 鲆科(Bothidea),具有经济价值好、营养价值高的特点,迅速成为我国黄、渤海地区的主要经济性鱼类。随着集约化养殖程度的不断提高,养殖环境越来越恶劣,养殖鱼类的病害问题也日渐突出,这成为了限制我国牙鲆养殖产业发展的难题。细胞培养分离技术是病毒生物学研究中应用最为广泛的技术之一,但来源于牙鲆的细胞资源较少,已知的细胞系只有牙鲆胚胎细胞系(HINAE)和牙鲆鳃细胞系(FG)[7]。然而HIRRV在这2种细胞系上的滴度较低,在HIRRV的致病机理研究中存在一定的局限性。此外,研究表明多种弹状病毒通过血液循环扩散到全身各组织中[8],且肾脏是鱼类的造血器官,推测肾脏可能是一种良好的细胞来源。结合国外的研究工作,本文进行了牙鲆肾脏细胞的分离、原代培养和对HIRRV的敏感性研究,为进一步研究牙鲆弹状病毒的致病机理提供细胞模型和材料。
1 材料与方法
1.1 实验用鱼与毒株
健康牙鲆((20±5) g)购自日照顺源水产育苗有限公司,游动正常,无临床症状。 蓄养于40 cm×40 cm×40 cm室内水槽内,水温(15 ± 1)℃,期间不间断充气。暂养7天后对可能存在的细菌、寄生虫进行常规检测,参考Sun等[10],采用PCR法进行HIRRV的检测,确认实验用鱼不携带病原体后用于后续实验。牙鲆弹状病毒CNPo2015株为本实验室保存。
1.2 组织块移植法原代培养
牙鲆原代细胞培养参照付思思等[9]采用组织块移植法进行并适当改进。将健康牙鲆浸于含有0.5 mg/kg的高锰酸钾溶液的水槽中消毒30 min,使用80 mg/L的MS-222进行麻醉,75%酒精浸泡鱼体数分钟进行消毒,将鱼体置于Ⅱ级生物安全柜内,用眼科剪将中肾剪成约1 mm3的组织块,用含高浓度抗生素的PBS缓冲液(500 U/mL青霉素、500 μg/mL链霉素、12.5 μg/mL 两性霉素B) 清洗3次,然后将组织块转移到25 cm2细胞培养瓶 (Corning,USA) 中,使其均匀平铺于培养瓶底面,倒置平放于20 ℃的CO2培养箱中贴附3 h。加入含有20%胎牛血清 (FBS, Gibco)的L15培养基中(含200 U/mL青霉素、200 μg/mL链霉素、5 μg/mL两性霉素B),置于20 ℃的CO2培养箱培养,72 h后更换新鲜培养基以去除残余红细胞和其它未贴壁细胞。倒置显微镜下每天观察细胞生长情况及形态变化。
1.3 胰酶消化法原代培养
胰酶消化法原代培养参考王光祥等[10]的方法加以改进。将牙鲆进行消毒后,无菌条件下取出肾脏。用眼科剪将中肾剪成约1 mm3的组织块,加入1 mL的已预热的胰蛋白酶中,37 ℃水浴轻摇消化,每隔2 min后将细胞悬液转移至1 mL的 L15培养基中,组织块继续加入新鲜胰酶进行消化,直至没有较大组织块为止,收集消化产物,1 000 r/min离心10 min后,弃上清,用新鲜的含20% FBS的L15培养基轻微吹打,至没有细胞结块为止。然后将细胞悬液转移到25 cm2细胞培养瓶中,置于20 ℃的CO2培养箱培养,倒置显微镜下观察细胞的生长状况。
1.4 传代培养
当细胞迁出汇合率可达80%后,小心弃去旧培养基,用含有0.1 mol/L的PBS缓冲液清洗3次,加入1 mL 0.25% EDTA-胰蛋白酶进行消化,待80%细胞收缩变圆时,加入5 mL培养基终止消化,小心吹打使细胞脱落后,将细胞悬液转移到离心管中,1 000 r/min离心5 min,加入含有10% FBS的L15培养基后,置于20 ℃的CO2培养箱中继续培养。
1.5 HIRRV感染实验
当连续传代5次后,选择生长良好的牙鲆肾细胞单层,按5%的比例接种HIRRV CNPo2015株。室温下吸附2 h,期间每间隔30 min轻微晃动培养瓶1次以便均匀吸附。弃去毒液,加入含4% FBS的L15细胞维持液,15 ℃培养观察。待细胞病变75%以上时,收获病毒液,将上述细胞病毒液用L15细胞培养液按10倍系列稀释至10-8, 在96孔细胞培养板(Corning)中微量法测定病毒的滴度, 用Reed-Muench法计算TCID50。
1.6 PCR实验
收集HIRRV感染后第4天的细胞培养物,Trizol法抽提总RNA,采用PrimeScript RT Reagent Kit (Takara)进行反转录,以获得的cDNA为模板,根据GenBank上已发表的牙鲆弹状病毒CNPo2015株G基因序列(登录号: KY363350),使用Sun等[10]的HIRRV特异性引物进行RT-PCR扩增,HIRRV毒种作为阳性对照。PCR反应条件为:95 ℃预变性5 min;94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min。PCR产物于1%琼脂糖凝胶电泳进行检测,并送至生工(上海)进行测序。
1.7 免疫荧光检测
取1×106个细胞接种在24孔细胞爬片(Solarbio)上培养,待细胞贴壁后接种0.1 mol的HIRRV,24 h后小心地取出爬片,PBS清洗2次后,加入丙酮中4 ℃固定30 min,自然风干后,加入PBS(含0.5%的Tween 20) 洗涤3次,加入本实验室制备的抗HIRRV-G蛋白的单克隆抗体,37 ℃孵育1 h,洗涤3次后加入碱性磷酸酶标记的羊抗鼠Ig G (Sigma),37 ℃孵育45 min。洗涤3次后加入DAPI染核5 min,洗涤3次后用抗荧光衰减淬灭剂(Solarbio)封片,在荧光显微镜下镜检。同时,收集感染24 h后的肾脏细胞,吸取30 μL细胞悬液滴于干净的载玻片上,丙酮固定15 min后风干,免疫荧光法确定感染细胞的比例。
2 结果
2.1 牙鲆肾脏原代细胞的培养和生长特性
采用组织块移植法培养牙鲆肾脏细胞1天后,一部分梭形的肾脏细胞开始迁出,少数细胞游离,无细胞集结成团的现象(见图1a),贴壁细胞缓慢生长至第7天后汇合率达到60%以上,大部分细胞铺展呈成纤维样,少数细胞呈上皮细胞样(见图1b),传代后上皮细胞样细胞渐渐消失。采用胰酶消化法培养牙鲆肾脏细胞1天后,细胞形态完整,较多细胞开始贴壁,细胞体积变大,拉长,呈上皮细胞样(见图1c)。培养7天后,单层细胞约占瓶底面积80%以上(见图1d)。
2.2 牙鲆肾脏细胞感染HIRRV后的形态学变化
用HIRRV CNPo2015株感染牙鲆肾细胞。当感染2天后,肾脏细胞未出现明显变化。当感染3天后,与感染前(见图2a)相比,细胞开始收缩变圆、折光度增加,细胞脱落,单层细胞呈拉网状,出现典型细胞病变效应(见图2b),采用微量板细胞病变法测定病毒滴度为1×105.8TCID50/mL。

(A.组织块移植法培养1天后的肾脏细胞,100×;b.组织块移植法培养7天后的肾脏细胞,200×;c.胰酶消化法培养1天后的肾脏细胞,200×;d.胰酶消化法培养7天后的肾脏细胞,200×。a.Flounder kidney cells at 1 day post-culture by tissue transplantation, 100×; b.Flounder kidney cells at 7 days post-culture by tissue transplantation, 200×; c.Flounder kidney cells at 1 day post-culture by trypsinization, 200×; d.Flounder kidney cells at 7 days post-culture by trypsinization, 200×.)
图1 牙鲆肾脏细胞的原代培养
Fig.1 Primary culture of Japanese flounder kidney cells
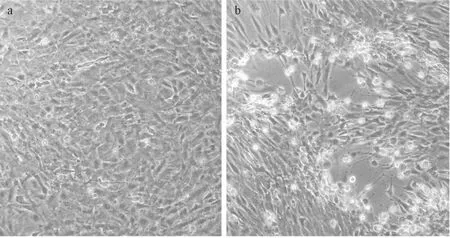
(A.HIRRV感染前的肾脏细胞, 200×;b.HIRRV感染后的肾脏细胞, 200×。a.Kidney cells before HIRRV inoculation, 200×; b.Kidney cells after HIRRV inoculation, 200×.)
图2 接种HIRRV前、后肾细胞的变化
Fig.2 The changes in flounder kidney cells before or after being inoculated with HIRRV
2.3 HIRRV G基因在牙鲆肾脏细胞中的检测
HIRRV感染肾脏细胞3天后,使用HIRRV-G特异性引物进行PCR扩增,产物经1%琼脂糖电泳后获得了大小约为515 bp的片段,与阳性对照的大小一致(见图3)。产物经测序后提交到BLAST进行比对后,与HIRRV G基因的核酸序列相似性为100%。

(1.DNA标准DL2000; 2.扩增产物; 3.阳性对照。1. DNA marker DL2000; 2. PCR product of HIRRV in kidney cells; 3. Positive control.)
图3 RT-PCR检测结果
Fig.3 RT-PCR amplified results
2.4 间接免疫荧光检测
采用抗HIRRV-G蛋白的单克隆抗体进行间接荧光染色。病毒接种24 h后,检测到 HIRRV在牙鲆肾细胞上增殖。荧光信号分布在细胞膜和细胞质中,且细胞膜上出现的荧光信号更加强烈(见图4 a和b)。通过对10个视野的计数统计,约有30%的肾细胞出现了较强荧光信号(见图4c和d)。
3 讨论
近年来,HIRRV的爆发越来越频繁,给全球的水产养殖业造成了严重的经济损失。自2010年我国首次分离和鉴定到HIRRV病毒以来,尚没有流行爆发的报道,但不排除这种可能[12]。由于该病毒具有持续感染的特性,了解病毒的致病机制是进行病毒防控的关键。研究表明用体外细胞模型进行病毒感染试验时,试验过程更容易重复,可获得更加准确的实验结果[13]。同时,体外培养的组织细胞能够保持其在体内原有的许多结构和功能,并排除了神经、体液等因素的干扰[14], 因此体外培养在牙鲆弹状病毒的致病机制研究中具有重要意义。
鱼类细胞原代培养的方法主要由组织块迁移法和胰酶消化法[15]。组织块迁移法适用于各种组织的原代培养。本实验中,采用组织块迁移法对牙鲆肾脏细胞进行培养,发现肾细胞的迁出速度较慢,形成较多的成纤维样细胞,推测是由于牙鲆肾脏的组织结构较松散,含有许多疏松结缔组织,其中含有大量成纤维细胞[16]。

(a,b.肾脏细胞爬片的FITC和DAPI染色结果,1000×;c,d.肾脏细胞滴片的FITC和DAPI染色结果,1000×。a,b.FITC and DAPI stainings on kidney cell climing slices, 1000×.; c,d.FITC and DAPI stainings on kidney cell slices, 1000×.)
图4 HIRRV感染牙鲆肾脏细胞后的免疫荧光结果
Fig.4 Results of immunofluorescence in HIRRV-infected flounder kidney cells
在原代培养过程中由于成纤维样细胞比上皮样细胞的贴壁能力更强,最终导致了上皮样细胞死亡。但成纤维样细胞增殖能力较弱,不适合进行长期传代。采用胰酶消化法进行原代细胞培养时,常采用0.05%~0.25%浓度的胰酶。浓度过低,会造成组织消化不足,细胞难以贴壁,而浓度过高,会使细胞死亡率增加或丧失贴壁能力[17]。我们通过进行优化,每消化2 min后吸出解离的细胞,尽可能地减少胰酶对细胞的损伤。传统的胰酶消化法是将组织块消化成细胞悬液,我们发现随着消化时间的延长,细胞活力呈下降趋势,且单个细胞贴壁能力较弱。因此,我们将组织块消化成一些小细胞团,这些小细胞团的贴壁能力比单个细胞更强,细胞产量和细胞活力也较理想。目前,肾细胞已经连续传代10次,但原代培养的细胞在传代后贴壁能力和增殖速度都有所降低,这可能是由于细胞在传代后分泌的粘附因子较少,又不能充分利用血清中的贴壁因子。因此,我们考虑加入生长因子和促有丝分裂原等药物进行优化。
在前期的HIRRV致病性研究中,结果发现HIRRV在肾脏、脾脏等组织中含量较高,因此我们着重探讨原代肾细胞对HIRRV的易感性。结果表明牙鲆肾细胞感染HIRRV后3天出现了明显的CPE,病毒滴度最终稳定在1×105.8TCID50/mL,证明此细胞系对HIRRV较敏感,RT-PCR也检测到了HIRRV的特异性mRNA。同时,应用抗HIRRV-G蛋白的单抗进行间接免疫荧光试验后,HIRRV感染24 h后细胞中出现了特异性的荧光信号,信号分布在细胞膜和细胞质中。通常,病毒蛋白的合成和加工主要是在细胞质中利用细胞资源进行,所以在感染细胞的细胞质中出现了荧光信号。此外,我们发现在细胞膜上出现了一些强烈的信号。研究表明G蛋白是病毒囊膜上的主要糖蛋白,可与细胞表面的受体结合,从而介导病毒吸附和入胞[18]。细胞膜上出现了零散的强烈信号,这些位点可能是G蛋白和细胞膜上受体结合的部位,说明牙鲆肾细胞膜上含有较多的HIRRV受体,进一步表明了该细胞对HIRRV具有较强的敏感性。
4 结论
本文建立了牙鲆原代肾细胞的培养方法,并证明了牙鲆原代肾细胞对HIRRV具有较强的敏感性,为进一步研究HIRRV的致病机制提供了较理想的细胞模型和实验基础。
[1] Oh M J, Choi T J. A new rhabdovirus (HRV-like) isolated in Korea from cultured Japanese flounderParalichthysolivaceus[J]. Fish Pathology, 1998, 11: 129-136.
[2] 孙颖杰, 江育林, 刘荭, 等. 石鲽鱼鱼苗中一种弹状病毒的分离与鉴定[J]. 中国兽医学报, 2009(3): 277-282.
Sun Y J, Jiang Y L, Liu H, et al. The isolation and characterization of a rhabdovirus from stone flounder,Kareiusbicoloratus[J]. Chinese Journal of Veterinary Science, 2009(3): 277-282.
[3] Kim W S, Oh M J. Hirame rhabdovirus (HIRRV) as the cause of a natural disease outbreak in cultured black seabream (Acanthopagrusschlegeli) in Korea[J]. Archives of Virology, 2015, 160(12): 1-4.
[4] Borzym E, Matras M, Maj-Paluch J, et al. First isolation of hirame rhabdovirus from freshwater fish in Europe[J]. Journal of Fish Diseases, 2014, 37(5): 423-430.
[5] Seo H, Do J W, Jung S H, et al. Outbreak of hirame rhabdovirus infection in cultured spotted sea bassLateolabraxmaculatuson the western coast of Korea[J]. Journal of Fish Diseases, 2016, 39(10): 1239-1246.
[6] Kimura T, Yoshimizu M, Gorie S. A new rhabdovirus isolated in Japan from cultured hirame (Japanese flounder)Paralichthysolivaceusand ayuPlecoglossusaltivelis[J]. Diseases of Aquatic Organisms, 1986, 1(3): 209-217.
[7] 殷立成, 郭华荣, 张士璀, 等. 利用牙鲆和牙鲆鳃细胞(FG)检测除草剂丁草胺的急性毒性和遗传毒性[J]. 中国海洋大学学报(自然科学版), 2007, 37(S1): 167-171.
Yin L C, Guo H R, Zhang S C. Study on the acute toxicity and genotoxicity of herbicide butachlor in flounder,Paralichthysolivaceusand flounder gill(FG) Cells[J]. Periodical of Ocean University of China, 2007, 37(S1): 167-171.
[8] 康雁君, 张永振. 弹状病毒的分类和进化[J]. 中国媒介生物学及控制杂志, 2014, 4: 374-377.
Kang Y J, Zhang Y Z. Taxonomy and evolution of Rhabdoviruses[J]. Chinese Journal of Vector Biology and Control, 2014, 4: 374-377.
[9] 付思思, 吴志新, 王敏, 等. 锦鲤组织细胞体外培养的初步研究[J]. 中国海洋大学学报(自然科学版), 2012, 42(3): 44-49.
Fu S S, Zhi-Xin W U, Wang M, et al. Study on the in vitro primary culture of tissue cells from ornamental carp,Cyprinuscarpio[J]. Periodical of Ocean University of China, 2012, 42(3): 44-49.
[10] Sun Y J, Yue Z, Liu H, et al. Development and evaluation of a sensitive and quantitative assay for hirame rhabdovirus based on quantitative RT-PCR[J]. Journal of Virological Methods, 2010, 169(2): 391-396.
[11] 王光祥, 尚佑军, 陈江涛, 等. 仔猪心肌原代细胞培养及其对口蹄疫病毒敏感性研究[J]. 中国人兽共患病学报, 2010, 10: 912-915.
Wang G X, Shang Y J, Chen J T, et al. Culture of piglet primary cardiomycytes and its sensitivity to FMDV[J]. Chinese Journal of Zoonoses, 2010, 10: 912-915.
[12] Sun Y J, Min Z, Liu H, et al. Analysis and characterization of the complete genomic sequence of the Chinese strain of hirame rhabdovirus[J]. Journal of Fish Diseases, 2011, 34(2): 167-171.
[13] 徐晓刚, 季有华. 丙型肝炎病毒体外感染HepG2细胞模型的建立[J]. 诊断学理论与实践, 2003, 2(1): 50-52.
Xu X G, Ji Y H. Establishment of hepatitis C virus infection model in vitro by using human hepatoma cells[J]. Journal of Diagnostics, 2003, 2(1): 50-52.
[14] 王利果, 李树青. 灯盏细辛对大鼠心肌缺血再灌注心律失常和细胞凋亡的影响[J]. 中西医结合心脑血管病杂志, 2009, 7(1): 52-54.
Wang L G, Li S J. Effect of breviscapine on arrhythmia and myocyte apoptosis induced by ischemia/reperfusion[J]. Chinese Journal of Integrated Traditional Chinese and Western Medicine, 2009, 7(1): 52-54.
[15] 张雪萍, 曾令兵, 陈倩, 等. 青鱼鳍条组织细胞系的建立及其生物学特性[J]. 淡水渔业, 2016(2): 3-9.
Zhang X P, Zeng L B, Chen Q, et al. Establishment and characterization of a cell line derived from fin ofMylopharyngodonpiceus[J]. Freshwater Fisheries, 2016(2): 3-9.
[16] 王妍, 季延滨, 高金伟, 等. 饥饿对漠斑牙鲆消化道组织结构的影响[J]. 天津农学院学报, 2015(1): 10-14.
Wang Y, Ji Y B, Gao J W, et al. Effects of starvation on histological structure of digestive tract ofParalichthyslethostigma[J]. Journal of Tianjin Agricultural University, 2015(1): 10-14.
[17] 蒋才丽, 农晓琳. 人瘢痕角质形成细胞原代培养中胰酶配方及浓度的探讨[J]. 中国美容医学, 2012, 5: 762-763.
Jiang C L, Nong X L. Effect of different digestion methods on the hypertrophic scar derived keratinocytes culture[J]. Chinese Journal of Aesthetic Medicine, 2012, 5: 762-763.
[18] Takano T, Iwahori A, Hirono I, et al. Development of a DNA vaccine against hirame rhabdovirus and analysis of the expression of immune-related genes after vaccination[J]. Fish amp; Shellfish Immunology, 2004, 17(4): 367-374.
责任编辑 朱宝象
研究简报
PrimaryCellCultureofJapaneseFlounder(Paralichthysolivaceus)KidneyandDeterminationofTheirSusceptibilitytoHirameRhabdovirus
ZHANG Jia-Lin, TANG Xiao-Qian, SHENG Xiu-Zhen, XING Jing, ZHAN Wen-Bin
(Laboratory of Pathology and Immunology of Aquatic Animals, College of Fisheries, Ocean University of China, Qingdao 266003, China)
To explore the susceptibility of the cultured primary kidney cells of Japanese flounder (Paralichthysolivaceus) to hirame rhabdovirus (HIRRV), the primary kidney cells of Japanese flounder were isolated and cultured using tissue transplantation and trypsinization techniques, respectively. The results showed that the morphology of the kidney cells was mainly fibroblast-like as were observed with tissue transplantation method, while they were epithelial-like as were observed with trypsinization method. The cell confluence rate was 80% at 7 days post-culture. The virus susceptibility tests were carried out after cell passage. Viral-induced cytopathic effect was observed, and the viral titer reached about 105.8TCID50/mL at 3 days post HIRRV infection. RT-PCR detected the mRNA of HIRRV in infected cells. Using monoclonal antibody against HIRRV and indirect immune fluorescent techniques, specific fluorescence signal was detected in the infected cells at 24 h post infection. The signal located in cell membrane and cytoplasm. Our findings suggested that the kidney cells were susceptible to HIRRV; the virus could successfully infect and proliferate rapidly in the cells. The primary kidney cell culture of Japanese flounder was established in this study, which will provide useful materials for the pathogenic mechanism studies of HIRRV.
Paralichthysolivaceus; primary cell culture; trypsinization; HIRRV; susceptibility
S91
A
1672-5174(2018)01-019-06
10.16441/j.cnki.hdxb. 20170038
张家林, 唐小千, 绳秀珍, 等. 牙鲆原代肾细胞培养及其对牙鲆弹状病毒的易感性研究[J].中国海洋大学学报(自然科学版),2018, 48(1): 19-24.
ZHANG Jia-Lin, TANG Xiao-Qian, SHENG Xiu-Zhen, et al. Primary cell culture of Japanese flounder (Paralichthysolivaceus) kidney and determination of their susceptibility to hirame rhabdovirus [J].Periodical of Ocean University of China, 2018, 48(1): 19-24.
国家自然科学基金项目(31672685; 31672684; 3142295);海洋渔业科学与食物产出过程功能实验室开放基金项目资助
Supported by National Natural Science Foundation of China (31672685; 31672684; 3142295);The Open Foundation of Functional Laboratory for Marine Fisheries Science and Food Production Processes
2017-01-20;
2017-03-21
张家林(1988-),男,博士生,主要从事水产动物病害与免疫学研究。
❋❋ 通讯作者:E-mail:tangxq@ouc.edu.cn

