酱香高温大曲微生物菌群演化规律研究
蒋英丽,邓皖玉,王亚军,邓小波,李 娟,聂正东,张剑南,甘浪飞
(1.四川省古蔺郎酒厂有限公司,四川古蔺646523; 2.四川大学生命科学学院,四川成都610064)
高温制曲为开放式过程,各种环境微生物均参与到该过程中。随着发酵温度升高,酱香功能嗜热菌就占据优势地位。当曲块温度达到较高温度时,翻曲、降温换气,为优势功能菌的继续生长、繁殖、代谢以及酱香味产生创造有利条件。推测在郎酒等酱香型白酒的高温制曲过程中,其多个工艺步骤,包括升温、翻曲以及换气等,定向培养、筛选形成了一个相对稳定的微生物菌群,确立了优势菌群。
通过高通量测序技术、重点针对郎酒高温制曲过程中的6个阶段,研究高温制曲过程中“酱香功能菌群(细菌与真核微生物)”的组成与演化规律。该项研究结果对解析郎酒高温制曲机制奠定基础,同时亦为优化制曲工艺、监测曲块品质、提升酱香型酒产量以及品质,提供理论指导。

表1 郎酒高温制曲进程中曲块样本信息

表2 PCR扩增所用引物序列信息
1 材料与方法
1.1 材料、试剂及仪器
曲块样品收集:采集高温制曲过程中6个关键阶段曲块,采样从制曲最佳的端午时节开始,取样时间跨度5个月,前后共计收集30块曲块(表1)。
试剂及耗材:美国MO Bio公司生产的Power-Soil DNA Isolation Kit、百迈克微生物高通量测序建库试剂盒、美国BioLabs公司Phusion HF MM高保真PCR酶、德国Qiagen公司MinElute®PCR Purification Kit、美国Illumina公司Sample Preparation Kit、全式金Taq DNA Polymerase、北京华大公司的合成引物、西班牙琼脂糖Agarose、全式金Marker DL5000、Goldview Nucleic Acid Gel Stain等。
仪器设备:高通量测序平台(美国Illumina HiSeq 2500)、PCR仪(美国Bio-Rad S1000)、荧光定量PCR仪(美国Bio-Rad CFX96)、凝胶成像系统(美国Bio-Rad Gel Doc™XR+)、低温冷冻离心机(德国Beckman Allegra X-22R)。
1.2 试验方法
1.2.1 曲块菌群基因组DNA的提取
本实验曲块菌群总DNA提取按照PowerSoil DNA Isolation Kit说明进行。
1.2.2 曲块菌群DNA文库建立与测序分析
曲块菌群DNA质量经检测合格后,通过针对V3+V4区域或者ITS区域的特异性引物(表2)分别进行PCR扩增。PCR产物纯化后利用Illumina公司的 Tru-Seq®DNA PCR-Free Sample Preparation Kit制备测序文库并添加接头序列,文库经过Thermo NanoDrop 2000测定质量后,利用Illumina HiSeq 2500进行高通量测序。
1.2.3 数据分析
对于测序得到的序列信息,首先根据PE reads之间的Overlap关系,将Hiseq测序得到的双端序列数据进行拼接以获得完整的一条序列Tags,同时对Reads的质量和拼接的效果进行质控过滤。之后利用不同软件进行数据分析,如QIIME软件进行OTU划分,基于Silva和UNITE分类学数据库对OTU进行分类学注释分析、利用MEGAN软件分析样品中所有微生物的进化关系和丰度差异,利用Mothur软件对样品进行Alpha多样性指数评估等。
2 结果与分析
2.1 曲块菌群基因组DNA的提取及质量检测
采用PowerSoil DNA Isolation Kit试剂盒,本研究提取了30个曲块菌群的总DNA。采用超微量分光光度计(Thermo NanoDrop 2000),检测了菌群总DNA的OD260/OD280比值,发现该比值介于1.80~1.90之间,同时,琼脂糖凝胶(0.8%)电泳结果也显示出清晰的DNA条带。结果表明,样本基因组DNA质量较好(图1)。
以提取菌群总DNA为模板,针对细菌16S rDNA的V3+V4区和真核微生物的ITS1区,进行PCR扩增,成功获得扩增目的条带(图2)。表明该菌群总DNA样品质量合格,可用于后续菌群DNA的PCR扩增与建库、及高通量测序分析。

图1 4个曲块(T4阶段:T4a-d)菌群总DNA的凝胶电泳结果

图2 曲块细菌16S rDNA基因片段的PCR扩增结果与真核微生物ITS1区的PCR扩增结果
2.2 高温制曲过程中细菌种类多样性及菌群演化趋势
采用16s rDNA高通量测序技术,本项目共计测定了30个曲块菌群总DNA样本(表3),共获得4,003,221对Reads,双端Reads拼接、过滤后共产生3,107,567条Clean tags,平均每个样品产生103,586条 Clean tags。
2.2.1 各阶段曲块细菌种类具多样性
在各阶段曲块中,共计发现291个分类操作单元(OTU),具多样性(图3A);OTU数量在不同阶段曲块中,具明显差异(图3B):与新入库曲块(T0)相比,在第1次(T1)和第2次翻曲(T2)时,曲块细菌OTU数量有显著增加;在第3次翻曲(T3)时,OTU数量急剧下降;在新制成品曲(T4)和储藏3月的成品曲块(T5)中,OTU数目趋于稳定。
使用Mothur(version v.1.30)软件,对样品Alpha多样性指数进行评估。为比较样品间的多样性指数,分析时将样品所含序列数进行标准化。在97%相似度水平下,各样品Alpha多样性指数值统计如表3,在T1和T2期,曲块细菌多样性较高;在T0、T4和T5期,多样性较低;T3期的多样性最低。4种计算算法的结论基本一致。
2.2.2 各阶段曲块共有或特征性具有OTU
在明确曲块中OTU个数后,利用Venn图可以展示样品之间共有或特有OTU数目,直观地表现出样品间OTU的重合情况。结合OTU所代表的物种,可找出不同环境中的共有或特有微生物。分析表明:在制曲不同阶段,共计发现100个OTU为各阶段曲块所共有;在T0、T1、T5期,曲块中特有OTU数目分别为10个、2个和28个;在T2、T3和T4阶段,无特有OTU(图4)。

图3 不同阶段曲块细菌OTU个数分布图与各阶段曲块细菌OTU数目变化趋势
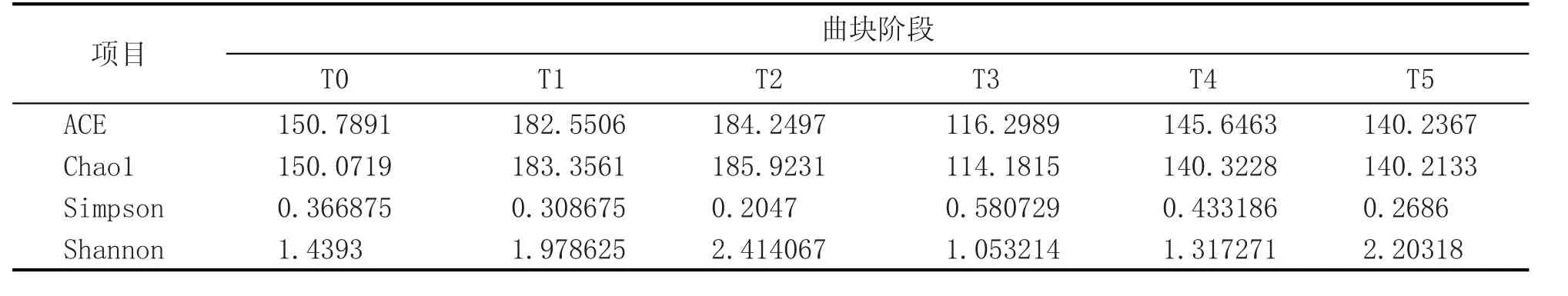
表3 各阶段曲块细菌菌群的Chao1、Ace、Shannon、Simpson指数

图4 OTU venn图示各阶段曲块中共有或特有细菌OTU数目
多个颜色图形之间交叠部分数字为多个阶段曲块间共有OTU数目,非交叠部分为特有OTU数目。
2.2.3 细菌菌群演化趋势解析
从细菌科、属分类水平上看,各阶段曲块菌群的种类及其相对丰度差异较大,多个优势菌群在高温制曲进程中显现(图5)。在制曲T1(第1次翻曲)和T2(第2次翻曲)阶段,曲块温度上升后,Kroppenstedtia(属Thermoactinomycetaceae科)迅速演化为优势菌属,其相对丰度占50%~60%;此外,该菌群在T3(第3次翻曲)、T4(新制成品曲)、T5(储藏成品曲)阶段中,始终作为优势菌属,其相对丰度高于60%(图5)。同时,高温放线菌属(Thermoactinomyces,能在50~85℃高温中生长)在T1和T2阶段,其在曲块菌群中的相对丰度亦高于5%;糖多孢菌属(Saccharopolyspora)在T2阶段,亦成为优势菌属,约占10%,后期阶段比例降低;芽孢杆菌属(Bacillus)在T1期开始出现,T2和T4期都占较大比例;Staphylococcus(葡萄球菌属)在T2期开始亦逐渐成为优势菌属。

图5 科水平细菌种类分布柱状图与属水平细菌种类分布柱状图
在新制成品曲(半成品曲)的储藏过程(T4→T5)中,曲块个别优势菌属相对丰度有显著变化。如:芽孢杆菌属(Bacillus)相对丰度急剧降低。在制曲T1和T2阶段,高温(59~65℃)对优势菌群有明显富集效应,使优势菌属(如Kroppenstedtia)趋于稳定。在制曲后期,随温度降低,个别优势菌群相对丰度有降低或恢复的情况。有趣的是,在制曲各阶段,仍有部分未知菌群待鉴定。

图6 不同阶段曲块真核微生物OTU个数分布图(A)与各阶段曲块OTU数目变化趋势(B)

表4 曲块真核微生物类群的Chao1、Ace、Shannon、Simpson指数
2.3 高通量测序揭示高温制曲过程中真核微生物种类多样性及菌群演化趋势
本研究对30个曲块真核微生物基因组DNA的ITS1区进行测序,共获得2,401,020对Reads,双端Reads拼接、过滤后共产生1,958,852条Clean tags,平均每个样品产生65,295条Clean tags。
2.3.1 各阶段曲块真核微生物多样性
在各阶段曲块中,基于UNITE(真菌)分类学数据库对OTU进行分类学注释,共计发现102个分类操作单元(OTU)。如图6所示,在不同阶段曲块中,OTU数目具明显差异;在制曲进程中,真核微生物种类(OTU数目)在第1次(T1)和第2次(T2)翻曲时,显著减少。在第3次翻曲(T3)时,曲块OTU数量减少至最低水平,在新制成品曲(T4)和放置3月的成品曲块(T5)中,OTU数目趋于稳定;制曲进程中,曲块真核微生物OTU数量的变化趋势与细菌OTU数量的变化趋势不同。
通过多样性指数分析发现:在T0、T1和T2期曲块中,真核微生物多样性较高;在T3、T4和T5期,多样性较低。4种计算方法的结论基本一致(表4)。该数据亦表明,真核微生物在制曲过程中,在外界(如温度)条件影响下,真核微生物的多样性呈下降趋势。
多个颜色图形间交叠部分数字为多个阶段曲块间共有OTU数目,非交叠部分为特有OTU数目。
2.3.2 各阶段曲块中共有或特有真核微生物OTU
分析表明:17个真核微生物OTU可在各阶段(T0—T5)曲块样品中检测到。T0期特有OTU数目为3个;T1、T2、T5期曲块特有OTU数目分别为1个、2个和2个;在T3、T4期曲块中,无特有OTU,在制曲各阶段中尤为特殊(图7)。

图7 OTU venn图示各阶段曲块中共有或特有真核微生物OTU数目
2.3.3 真核微生物菌群的演化趋势解析
从属分类水平上看,各阶段曲块中,真核微生物种类及其相对丰度变化显著。在同一制曲阶段中,不同曲块中真核微生物种类及其相对丰度差异不明显;在不同阶段,曲块真核微生物种类及其相对丰度差异较大,优势菌属在高温制曲进程中显现(图8)。在T0期,真核微生物种类较多。其中,存在大量未知真核微生物;在第1次翻曲时(T1),真核微生物种类显著减少,嗜热子囊菌属(Thermoascus)、Rasamsonia菌属(一种新发现耐热或嗜热真菌)、红曲霉属(Monascus)、曲霉属(Aspergillus)逐渐富集,成为优势菌属;在第2次翻曲(T2)时,红曲霉属、Rasamsonia和Thermoascus成为优势菌属。其中,红曲霉属相对丰度最高,约占40%;在T3和T4期,优势菌属为嗜热子囊菌属、Rasamsonia和Thermomyces(嗜热真菌属),其中,嗜热子囊菌属相对丰度占40%~60%。与T3和T4曲块类似,在储 藏 曲 块(T5)中 ,Thermoascus、Thermomyces、Rasamsonia和Aspergillus等为优势菌群,但其相对丰度变化显著。如Thermomyces的相对丰度由T3、T4阶段的3%提升到40%。此外,未知菌群相对丰度急剧降低。

图8 属水平真核微生物物种分布柱状图
2.4 高温制曲过程中,细菌与真核微生物菌群的演化趋势比较
通过对郎酒高温制曲进程中,细菌与真核微生物菌群演化规律比对分析,可发现一些共同特征:(1)新曲入库时(T0),微生物种类较多,但优势菌群未显现;(2)在第1次翻曲(T1,65℃)和第2次翻曲(T2,59℃)阶段,耐高温优势菌群显现和富集,表明高温对曲块优势菌群有筛选与富集效应;(3)与T1和T2相比,在T3、T4阶段,优势菌群的组成及其丰度均有变化;(4)在后期储藏(T5)过程中,部分优势菌群相对丰度显著提升或减少。表明,曲块储藏是制曲必要阶段。
此外,我们还发现,制曲进程中,细菌与真核微生物种类的变化趋势有差异(图9)。细菌微生物种类远比真菌丰富,细菌种类从入库(T0)到第1次翻曲(T1,≈65℃)和第2次翻曲(T2,≈59℃)阶段,增加近30%,在第3次翻曲(T3,≈43℃)阶段,与温度锐降趋势一致,其种类相比T2减少了近52%,在之后储存阶段(T4、T5,≈37℃),细菌种类略微增加。相反,在整个制曲进程中,真核微生物的变化趋势为种类持续减少。在第1次翻曲和第3次翻曲阶段种类分别锐减28%和59%,之后,微生物种类较为稳定。
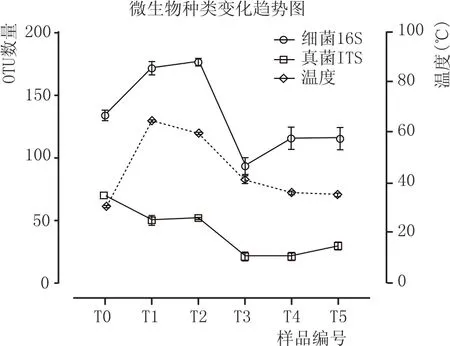
图9 郎酒高温制曲过程中细菌与真菌OTU数量变化趋势与温度变化趋势
通过高温制曲的菌群演化规律分析,一方面可通过分析菌群演化特征,为监测曲块品质差异提供理论支持。同时,也为优化制曲工艺,如缩短曲块储藏时间、改变储藏条件、调节曲房条件(如温度、通风)等,奠定基础。最终为提升与稳定酒品质、降低制曲生产成本提供科学依据。
3 小结
综上所述,通过高通量测序技术,首次针对郎酒高温制曲进程中,细菌与真核微生物的多样性、菌群演化规律以及优势菌群进行了系统探究。
(1)首次揭示在郎酒高温制曲进程中,细菌与真核微生物种类具多样性,但细菌与真核微生物变化趋势差异显著。
(2)发现在制曲早期阶段,高温对酱香功能菌群的筛选与富集效应明显,促使优势菌群富集与显现。同时,亦发现后期储藏对曲块部分优势菌群的相对丰度具明显影响。
(3)本研究也发现一定比例未知菌群。这类菌群对高温制曲的影响值得深度挖掘。
本课题研究将为解析郎酒高温制曲机制奠定基础,同时,亦为优化高温制曲工艺、监测曲块品质、提升酒产量与品质等提供理论指导。

