基于精细化残差U-Net的新生儿局灶性脑白质损伤分割模型
刘亚龙 李洁 王颖 仵赛飞 邹佩


摘 要:针对新生儿局灶性脑白质损伤的病灶区域小而样本差异大导致的检测与分割病灶较为困难的问题,提出一种精细化深度残差U-Net模型,以对病灶进行精细的语义分割。首先,把核磁共振(MRI)图像裁剪成较小的图像块;其次,利用残差U-Net提取出每个图像块不同层次的深度特征;然后,将特征进行融合并输出每个图像块的病灶分布概率图;最后,由全连接条件随机场对拼接后的概率图进行优化得到最终的分割结果。在某合作医院提供的数据集上的评估结果显示,在仅使用T1序列单模态数据的情况下,该模型在分割新生儿局灶性脑白质损伤时,病灶边缘的分割精度得到提高,且模型抗干扰能力较好。该模型的Dice相似性系数达到了62.51%,敏感度达到69.76%,特异性达到99.96%,修正的Hausdorff距离降低到33.67。
关键词:局灶性脑白质损伤;新生儿;脑部肿瘤分割;深度学习;语义分割;深度残差U-Net模型
中图分类号: TP391.4文献标志码:A
Segmentation model of neonatal punctate white matter lesion based on
refined deep residual U-Net
LIU Yalong*, LI Jie, WANG Ying, WU Saifei, ZOU Pei
(School of Electronic Engineering, Xidian University, Xian Shaanxi 710071, China)
Abstract: The tiny lesion area and the large difference between samples of neonatal punctate white matter lesion make it difficult to detect and segment the lesion. To solve the problem, a refined deep residual U-Net was proposed to realize the fine semantic segment of the lesion. Firstly, a Magnetic Resonance Imaging (MRI) image was cut into small patches. Secondly, the deep features of multiple layers of each image patch were extracted by the residual U-Net. Then, the features were fused and the probability map of the lesion distribution of each image patch was obtained. Finally, the probability map after splicing was optimized by the fully-connected condition random field to obtain the final segmentation results. The performance of the algorithm was evaluated on a dataset provided by a cooperative hospital. The results show that with only T1 order unimodal data used, the proposed model has the lesions edge segmented more precisely, and the anti-interference ability of the model is prominent. The model has the Dice similarity coefficient of 62.51%, the sensitivity of 69.76%, the specificity of 99.96%, and the modified Hausdorff distance reduced to 33.67.
Key words: Punctate White Matter Lesion (PWML); neonate; brain tumor segmentation; deep learning; semantic segmentation; deep residual U-Net
0 引言
新生儿局灶性脑白质损伤(Punctate White Matter Lesion, PWML)是一种较为常见的脑部肿瘤。在早产的情况下,新生儿拥有不同程度PWML的概率将会达到20%[1-2],及时进行人工干预可以减少新生儿脑部的发育障碍并改善预后情况。新生儿脑部结构随年龄变化较快,不同时期的新生儿脑部结构有较为显著的差异。因此,分割新生儿PWML的算法需要有较强的泛化能力和较好的鲁棒性。目前认为,PWML的特征在出生一周的新生儿脑部MRI中较为明显,可以在T1加权以及T2加权的图像中观察到较为显著的特征,分别表现为点状、线状或簇状的T1加权高信号及T2加权低信号[3-4],一些PWML分割的相关工作均基于这些特征进行展开。
2013年,Cheng等 [5]提出了一种基于阈值分割PWML的方法,可以在一些病灶区域显著、干扰较少的MRI中得到较好的结果。2015年,Cheng等[6]继续提出了一种基于随机过程来分割PWML的方法,该方法可以避免高斯分布的假设,在低噪声的MRI中也取得了较好的分割效果;但是,该方法处理步骤复杂,在分割噪声较多以及对比度较低的MRI时,性能仍然不够鲁棒[7]。最近,Mukherjee等[7]提出了一种综合性的方法。该方法在单个层中通过最大极值稳定区域[8]得到疑似的病灶区域,通过遗传算法对该区域进行选择进一步得到PWML的候选区域,然后根据PWML主要分布在脑室边缘的假设对候选区域进行筛选得到粗略分割的结果;之后的精细分割通过判断病灶的相邻层中在一定距离内是否也有病变区域来保留或剔除该病灶区域,以此得到最终的分割结果。经过实验验证,该方法在一定规模的数据集上取得了良好的效果;但是,该方法存在模型结构复杂、处理流程繁多的問题,且在数据集增大的情况下,模型的性能逐渐降低,鲁棒性有待提高。
近年来,机器学习与深度学习不断发展,已经在多个领域发挥出优异的性能。在医学信息分析领域,机器学习与深度学习算法在乳腺肿块分类[9-10]、乳腺钼靶肿瘤检测[11-12]以及脑电数据分类[13]等领域中得到了广泛的应用。U型网络(U-Net)[14]对细胞图像的成功分割,再次证明了深度学习可以很好地被用于医学图像的语义分割。在脑部肿瘤分割以及脑白质损伤分割方面,基于深度学习的方法也取得了优异的性能[15-16]。另外,Zhang等[18]将特征提取能力强大的残差网络(ResNet)[17]与结构先进的U型网络相结合,搭建了深度残差U型网络(Deep ResUnet),在遥感数据集上取得了较好的效果。焦点损失(focal loss)[19]可以在模型训练的时候,调整不均衡样本以及难易样本对模型损失的影响,提高模型的小目标检测能力。全连接条件随机场(Fully-connnected Conditional Random Field, Fully-connnected CRF)[20]可以根据原始图像中的纹理信息,对深度网络分割结果进行优化,在图像分割领域也获得了广泛的应用。
因此,本文根据PWML的特点,基于残差U型网络,结合全连接CRF和焦点损失,提出了一种可以高效分割PWML病灶的深度学习分割模型。该模型相比于现有的一些算法,不需要预先去除头皮区域,没有复杂的预处理步骤,仅使用T1加权的MRI就可以精确地分割出PWML。
1 相关工作
1.1 深度残差U型网络
深度残差U型网络(Deep Residual U-Net)[18]是一种融合了残差结构[17]的U型深度网络(U-Net)[14]。其主要部件是残差块,结构如图1(b)所示。残差块接受上一层的输出,利用批归一化、激活和卷积对输入进行处理,经过两条路径对输入特征进行提取,最终将两条路径的特征进行融合,这样既保留了部分原始信息,又增加了新的特征。需要注意,网络中的每个残差块结构均独立存在。收缩部分的残差块在两个路径的卷积中各进行了一次步长为2的卷积操作,使得特征图的尺寸变成原来的一半;而扩展部分的残差块中的卷积操作步长均为1,特征图尺寸恢复主要靠上采样层。
深度残差U型网络的整体结构如图1(a)所示。输入的图像经过卷积层、批归一化层、激活层、卷积层、相加层的处理,可以得到特征图C1。C1经过残差块的特征压缩和提取得到较小的特征图C2,之后得到C3与C4,至此特征压缩与提取完成。扩展部分则用来对提取到的信息进行融合与选择,从而实现对病灶区域的精确定位。C4经过上采样达到与C3一样的尺寸并与C3融合,之后由残差块对融合后的特征进行处理,后续步骤以此类推,得到的特征图经过网络最后的卷积层与Sigmoid激活,得到PWML的分布概率图。深度残差U型网络结合了残差网络强大的特征提取能力以及U型网络强大的多尺度特征图融合方法,可以在复杂的图像上提取出丰富语义特征的同时保留图像的细节信息。
1.2 焦点损失
在一些正负样本不均衡的情况下,使用普通交叉熵函数可能会导致模型训练失败。针对这个问题,焦点损失(Focal Loss)[21]通过对不同类别样本的损失给予不同的权重,使得在样本数量不均衡的情况下也可以对模型进行正常的训练。焦点损失通过对难以区分的样本给予较高的损失,对易于区分的样本给予较低的损失,使得大量简单样本的损失对模型训练的干扰减小,从而可以让模型更加关注于少量的难以区分的样本。焦点损失的公式定义如下:
FL(pt)=-αt(1-pt)γ lg(pt)(1)
其中:pt=p, y=1
1-p,其他 。
模型输出的类别概率p∈[0,1];αt是第t类样本的损失权重,所有类别的损失权重之和为1;γ控制难易樣本损失的大小,γ≥0恒成立。当γ增大时,模型会更加关注难以区分的样本;当γ=0时,公式退化成带αt的普通交叉熵函数。
1.3 全连接条件随机场
全连接条件随机场可以根据原始图像中像素信息对网络输出的概率图进行优化。全连接CRF的输入包括原始图像I以及网络输出的同尺寸概率图ypred,输出就是优化过后的同尺寸概率图,记为yopt。关于全连接条件随机场,先假设有一个随机区域R={r1,r2,…,rn},其中,n为原始图像中像素的个数,ri是像素i的类别标签,所有像素的类别标签构成集合L={l1,l2,…,lk}。本文中的所有模型都将原始图像分割成病灶区域与背景区域两类,因此k=2。另外,原始图像I被定义成一个随机区域M={m1,m2,…,mn},其中mi是单个像素i的颜色特征向量。至此,条件随机场(I,R)的概率函数即可被定义为:
P(R|I)=1Z(I)exp(-E(R|I))(2)
给定归一化因子Z(I),只要最小化能量函数E(R|I),即可得到最优的分割优化结果[22]。
在全连接CRF中,能量函数可以被定义为如下形式:
E(R|I)=∑iψi(xi)+∑ij,i≠jψij(xi,xj)(3)
式中分为一元势函数ψi(xi)和二元势函数ψij(xi,xj)两大部分,一元势函数又可表示为-lg P(xi),其中P(xi)表示像素点i属于集合L中某一元素的概率,可由ypred直接计算得到。二元势函数具体又可表示成如下形式:
ψij(xi,xj)=μ(xi,xj) [ω1exp(-‖qi-qj‖22θ2α)+
ω2exp(-‖qi-qj‖22θ2β-‖mi-mj‖22θ2γ)](4)
其中:μ(xi,xj)=1,xi≠xj
0,其他 。
式中:μ(xi,xj)用于判断不同标签之间的兼容性;q代表像素位置信息,m代表像素的颜色信息,因此式(4)中方括号内第一部分只与像素位置有关,第二部分与像素位置与颜色有关;超参数θα、θβ和θγ分别控制第一部分位置信息的尺度、第二部分位置信息的尺度以及第二部分颜色信息的尺度,表示各自高斯核的大小。
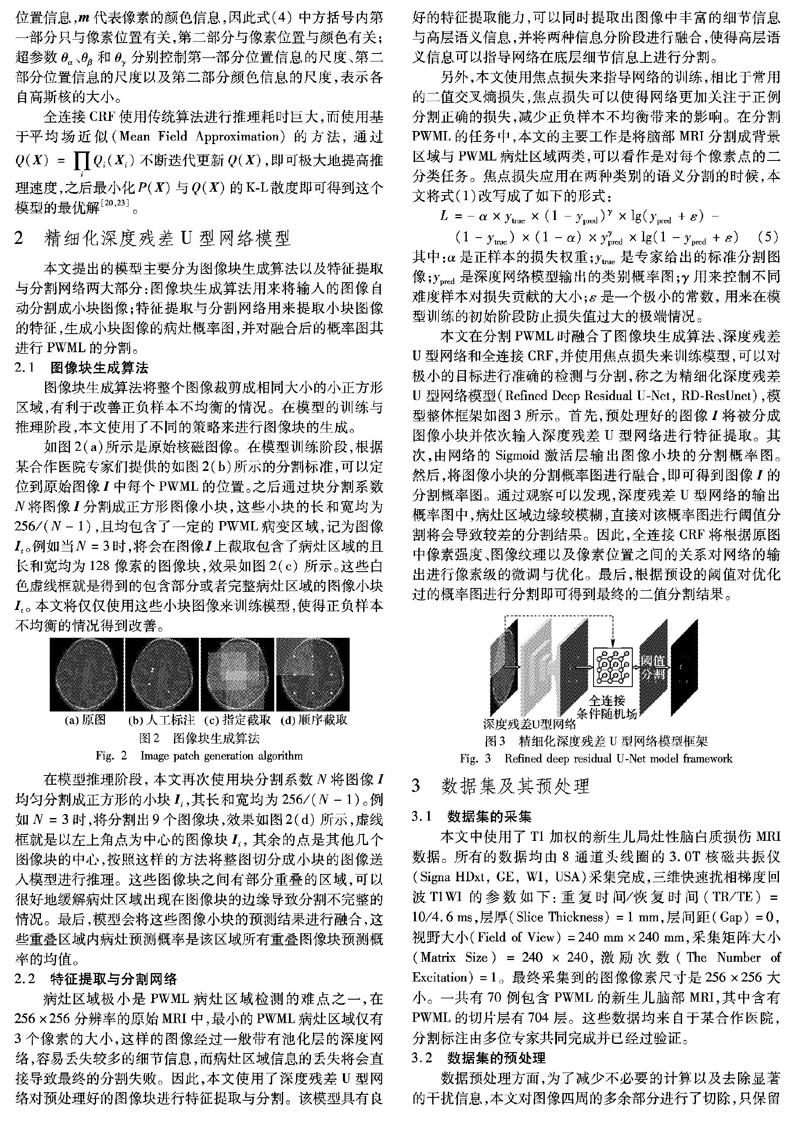
在数据增强方面,鉴于脑部MRI具有特定朝向的特点,本文仅使用了左右翻转以及小角度旋转图像的数据增强方法。即在模型训练的过程中,以0.5的概率横向翻转图像,并以角度ω对原始图像进行旋转(-10°<ω<10°)。通过联合使用这两种方法,大幅增加了数据的数量,最终增强了模型的泛化能力,减少了模型过拟合的情况。
4 实验结果评估与分析
本文将引入分割脑部肿瘤常用的评价指标,并利用这些指标对模型分割PWML病灶的性能进行评估。本文复现了文献[7]中目前性能最优的分割方法,并在同一数据集上对其性能进行了测试。最后则逐步分析了本文提出的模型中每个模块对模型整体性能的影响。
4.1 评估指标
实验中使用Dice相似性系数(Dice Similarity Coefficient, DSC)、敏感度(Sensitivity)、特异性(Specificity)以及修正的Hausdorff距离(Modified Hausdorff Distanse, MHD)这四种常用的医学影像分割指标对本文模型以及文献[7]方法进行性能测试。分割正确的病灶区域面积记为STP,分割错误的病灶区域面积记为SFN,分割正确的背景区域面积记为STN,分割错误的背景区域面积记为SFP,则各个评价指标的定义如下:
DSC=2STP/(SFN+SFP+2STP)
Sensitivity=STP/(STP+SFN)
Specificity=STN/(STN+SFP)
MHD(C,D)=max(d(C,D),d(D,C))
其中:DSC用以评估模型预测结果与专家给出的分割标准的相似性;敏感度用于评估模型正确分割出目标的性能;特异性用以评估模型正确分割出背景的性能;修正的Hausdorff距离用以评估欧氏空间中的C和D两个点集之间的距离,该式中d(C,D)=maxc∈C d(c,D),d(c,D)=mind∈D‖c-d‖表示集合C中某个元素距离集合D中所有元素的最小值,d(C,D)即表示集合C中所有元素d(c,D)的最大值。因此,MHD度量的是两个集合之间的最大不匹配程度。
4.2 结果分析
本文中所有的实验均基于第3章中描述的数据展开。所有代码均基于Tensorflow后端的Keras构建。模型训练时使用了Adam优化器[24],批大小为16,迭代100次,每次迭代100步,初始学习率为0.001;并设置了学习率的自动衰减,即当验证损失连续10个迭代周期没有达到更小的值,学习率自动下降为原来的一半。本文模型的训练过程如图4所示,相较于二值交叉熵损失,焦点损失可以使得模型在验证集上的损失随训练迭代次数快速下降,并趋于收敛,使得模型可以更好地分割PWML。
图像根据N值进行预处理。实际测试结果中发现,提高N值可以提高模型小目标检测的能力,但是过大的N值将会导致块图像尺寸过小、数量过多,分割出的图像小块将仅仅包含病灶区域周围一小部分的信息,容易导致模型训练过拟合,降低模型的泛化能力。N值偏小则会减弱模型的小目标检测能力,正负样本不均衡的问题改善不明显,最终将导致模型分割失败,因此在这里取N=3。
另外,为了可以高效快速地计算出合适的参数,本文使用贝叶斯优化器[25],对全连接CRF的超参数θα、θβ、θγ以及迭代次数n进行自动搜索。另外,为了加快模型的推理速度,在选择自动搜索结果的时候,将更加倾向于选择迭代次数较少的一组参数。最终得到θα=2、θβ=4、θγ=6以及n=1时,全连接CRF对模型的性能有较大的增益。需要注意的是,固定参数的全连接CRF仅仅在模型的推理过程中存在。模型训练完毕以及全连接CRF参数选择完毕后,本文模型的性能与文献[7]方法的性能进行了测试与比较,同时对本文模型加入各部分模块后模型性能的增益进行了评估,结果如表1所示。为了客观地评估模型的性能,实验均使用5折交叉验证,所有指标的数值均是5折交叉验证的中位数。
其中,文献[7]方法在样本数量较少的时候,通过参数的调节可以达到较好的分割性能,但是在样本数量增加的时候,其性能开始随着样本数量的增加逐渐衰减。在与本文模型同等条件下对该模型进行评估的结果显示,文献[7]方法的特异性较高,但是DSC与敏感度较低,对病变区域的分割效果不佳,表明该方法的泛化能力较弱。另外,本文还对目前图像分割领域性能强大的Mask R-CNN[26]进行了测试,在相同的条件下,可以发现Mask R-CNN的DSC、敏感度与特异性指标均优于文献[7]所使用的传统方法,对目标的检测与分割效果更好;但是Mask R-CNN也存在许多误检测的情况,导致其MHD指標较高。
在评估本文模型的过程中,使用了普通二值交叉熵损失(Binary Cross Entropy Loss, BCELoss)进行训练并使用全连接CRF优化最终的分割结果的残差U型网络性能如表1中(ResUNet+BCELoss+CRF)所示。可以发现,这种深度学习模型的性能相比于文献[7]方法,在各项性能上均有较大的提升,可以更好地分割出病灶区域。而使用焦点损失和全连接CRF的模型在同等条件下训练与测试的结果如表1中(ResUNet+FocalLoss)所示。可以发现,使用了焦点损失的模型可以更好地处理PWML分割这种正负样本不均衡的任务,其DSC和敏感度均有一定的提升,但是特异性和MHD没有使用普通二值交叉熵损失的模型优异,因此该模型在分割PWML时,将会有相对较多的假阳性区域。最后,在焦点损失残差U型网络模型的基础上增加全连接CRF,即将网络输出的预测概率图以及网络输入的原始图像输入全连接CRF,最终可以输出优化后的分割结果。该模型的性能如表1中(ResUNet+FocalLoss+CRF)所示,其DSC与敏感度相比上述其他模型又有较大的提升,因此该模型作为本文提出的最终模型,其分割结果可以更加贴合实际的病灶区域。
本文使用DSC与敏感度这两种有代表性的指标对各个模型在所有测试集样本上的分割性能进行统计,结果如图5所示。
由图5可以发现,文献[7]方法的DSC与敏感度指标的四分位间距均较大,表明该模型的性能在数据量较大的情况下不太稳定,分割效果不理想。而使用了普通二值交叉熵损失和全连接CRF的残差U型网络(ResUNet+BCELoss+CRF)在分割PWML的性能上相比于前者有了较大的提升,且模型的性能在数据量较大的情况下也更为稳定。将普通二值交叉熵损失换成焦点损失后(ResUNet+FocalLoss+CRF)可以发现,模型分割PWML的DSC与敏感度指标又有较大的提升,且DSC的四分位间距减小,说明模型的鲁棒性也有提高,总体性能提升明显。最后,本文对没有使用全连接CRF的焦点损失残差U型网络的性能进行了测试,结果发现,模型的DSC和敏感度相比于使用了全连接CRF的焦点损失残差U型网络均有一定程度的下降,证明了全连接CRF在提高算法性能方面起了重要的作用。另外,Mask R-CNN作为目前性能强大的分割算法,在分割PWML时,模型性能较为稳定,但是分割效果较为一般。
最后,各个方法分割PWML的效果如图6所示,大脑中的白色点状区域即为算法预测的病灶区域。图中每一行是使用不同方法对同一个MRI切片的分割结果,最左侧第一列图像是输入模型的原始MRI图像,第二列是人工标注的结果,而最后一列是本文最终模型的分割结果。其中,采用了残差U型网络的方法均可以很好分割出病灶,同时分割结果假阳率较低,证明基于残差U型网络的方法在鲁棒性上相比于文献[7]方法具有一定的优势,而本文最终模型误检测、漏检测的情况也优于Mask R-CNN。从图6前三行中可以看出,采用了二值交叉熵损失的模型在检测小目标的时候性能较差,容易出现漏检的情况。使用了焦点损失的模型则可以较好地应对小目标的情况。通过对比观察第五列与第六列的图像,发现全连接CRF可以在一定程度上减少模型预测的假阳性部分,提高了模型预测与专家标准的匹配程度。最后三行是同一个病人的切片图像,分别代表了脑部下、中、上这三个区域。其中第四行图像包含了病人的眼部区域,最后一行则包含了大量与病灶相似的干扰区域,这些无用的区域容易对模型造成极大的干扰,但是本文提出的模型在对这些图像进行分割时均可以得到较好的结果,在分割同一个病人的时候具有良好的鲁棒性。通过前三行的分割结果可以发现,本文模型在分割PWML时对大脑的形态不敏感,在分割不同病人大脑中PWML的时候效果稳定,算法鲁棒性较好。
5 結语
本文提出了一种结合图像块生成、焦点损失、残差U型网络和全连接条件随机场的新生儿局灶性脑白质损伤分割模型,对新生儿脑部MRI进行了准确有效的像素级分割。图像块生成算法将图像裁剪成一组较小的图像块,缓解了数据中正负样本不均衡的问题。残差U型网络对图像块进行特征的提取,即可得到模型预测的分割概率图。另外,模型的训练使用了焦点损失,使其在分割这种极小的目标时可以更快更稳定地收敛。模型推理时则使用了全连接条件随机场对分割概率图进行像素级的优化。最后,在某合作医院采集的新生儿局灶性脑白质损伤数据集上对模型的性能进行测试的结果表明,本文提出的方法可以在存在干扰信息的情况下对病灶区域进行准确的分割,且在不同个体的脑部核磁图像上具有较好的鲁棒性,是一种准确可靠的新生儿局灶性脑白质损伤分割方法。但是,该模型依然存在一些局限性,例如在分割病灶时,该模型仅考虑了单层切片中病灶的特征,没有考虑相邻切片之间像素的关系,会产生小概率误检与漏检的情况。因此,如何使用相邻切片层甚至全脑的图像对新生儿脑白质损伤进行快速有效的分割,是需要进一步探索的方向。
参考文献 (References)
[1]TORTORA D, PANARA V, MATTEI P A, et al. Comparing 3T T1-weighted sequences in identifying hyperintense punctate lesions in preterm neonates [J]. American Journal of Neuroradiology, 2015, 36(3): 581-586.
[2]KERSBERGEN K J, BENDERS M J N L, GROENENDAAL F, et al. Different patterns of punctate white matter lesions in serially scanned preterm infants [J]. PloS One, 2014, 9(10): e108904.
[3]DYET L E, KENNEA N, COUNSELL S J, et al. Natural history of brain lesions in extremely preterm infants studied with serial magnetic resonance imaging from birth and neurodevelopmental assessment [J]. Pediatrics, 2006, 118(2): 536-548.
[4]CORNETTE L G, TANNER S F, RAMENGHI L A, et al. Magnetic resonance imaging of the infant brain: anatomical characteristics and clinical significance of punctate lesions [J]. Archives of Disease in Childhood — Fetal and Neonatal Edition, 2002, 86(3): F171-F177.
[5]CHENG I, HAJARI N, FIROUZMANESH A, et al. White matter injury detection in neonatal MRI [C]// Proceedings of the Medical Imaging 2013: Computer-Aided Diagnosis, SPIE 8670. Bellingham, WA: SPIE, 2013: 86702L.
[6]CHENG I, MILLER S P, DUERDEN E G, et al. Stochastic process for white matter injury detection in preterm neonates [J]. NeuroImage: Clinical, 2015, 7: 622-630.
[7]MUKHERJEE S, CHENG I, MILLER S, et al. A fast segmentation-free fully automated approach to white matter injury detection in preterm infants [J]. Medical and Biological Engineering and Computing, 2019, 57(1): 71-87.
[8]MATAS J, CHUM O, URBAN M, et al. Robust wide-baseline stereo from maximally stable extremal regions [J]. Image and Vision Computing, 2004, 22(10): 761-767.
[9]JIAO Z, GAO X, WANG Y, et al. A deep feature based framework for breast masses classification [J]. Neurocomputing, 2016, 197: 221-231.
[10]HU Y, LI J, JIAO Z. Mammographic mass detection based on saliency with deep features [C]// Proceedings of the 2016 International Conference on Internet Multimedia Computing and Service. New York: ACM, 2016: 292-297.
[11]JIAO Z, GAO X, WANG Y, et al. A parasitic metric learning net for breast mass classification based on mammography [J]. Pattern Recognition, 2018, 75: 292-301.
[12]YANG D, WANG Y, JIAO Z. Asymmetry analysis with sparse autoencoder in mammography [C]// Proceedings of the 2016 International Conference on Internet Multimedia Computing and Service. New York: ACM, 2016: 287-291.
[13]JIAO Z, GAO X, WANG Y. Deep convolutional neural networks for mental load classification based on EEG data [J]. Pattern Recognition, 2018, 76: 582-595.
[14]RONNEBERGER O, FISCHER P, BROX T. U-Net: convolutional networks for biomedical image segmentation [C]// Proceedings of the 2015 International Conference on Medical Image Computing and Computer-Assisted Intervention, LNCS 9351. Cham: Springer, 2015: 234-241.
[15]HAVAEI M, DAVY A, WARDE-FARLEYC D. Brain tumor segmentation with deep neural networks [J]. Medical Image Analysis, 2017, 35: 18-31.
[16]GUERRERO R, QIN C, OKTAY O, et al. White matter hyperintensity and stroke lesion segmentation and differentiation using convolutional neural networks [J]. NeuroImage: Clinical, 2018, 17: 918-934.
[17]HE K, ZHANG X, REN S, et al. Deep residual learning for image recognition [C]// Proceedings of the 2016 IEEE Conference on Computer Vision and Pattern Recognition. Piscataway: IEEE, 2016: 770-778.
[18]ZHANG Z, LIU Q, WANG Y. Road extraction by deep residual U-Net [J]. IEEE Geoscience and Remote Sensing Letters, 2018, 15(5): 749-753.
[19]LIN T Y, GOYAL P, GIRSHICK R, et al. Focal loss for dense object detection [C]// Proceedings of the 2017 IEEE International Conference on Computer Vision. Piscataway: IEEE, 2017: 2999-3007.
[20]KRHENBHL P, KOLTUN V. Efficient inference in fully connected CRFs with Gaussian edge potentials [C]// Proceedings of the 25th Annual Conference on Neural Information Processing Systems. New York: Curran Associates, 2011: 109-117.
[21]LIN T Y, GOYAL P, GIRSHICK R, et al. Focal loss for dense object detection [C]// Proceedings of the 2017 IEEE International Conference on Computer Vision. Piscataway: IEEE, 2017: 2980-2988.
[22]LAFFERTY J, MCCALLUM A, PEREIRA F C N. Conditional random fields: probabilistic models for segmenting and labeling sequence data [C]// Proceedings of the 18th International Conference on Machine Learning. New York: International Machine Learning Society, 2001: 282-289.
[23]ZHENG S, JAYASUMANA S, ROMERA-PAREDES B, et al. Conditional random fields as recurrent neural networks [C]// Proceedings of the 2015 IEEE International Conference on Computer Vision. Piscataway: IEEE, 2015: 1529-1537.
[24]KINGMA D P, BA J L. Adam: a method for stochastic optimization [EB/OL]. [2019-02-20]. http://de.arxiv.org/pdf/1412.6980.
[25]SNOEK J, LAROCHELLE H, ADAMS R P. Practical Bayesian optimization of machine learning algorithms [C]// Proceedings of the 26th Annual Conference on Neural Information Processing Systems. New York: Curran Associates, 2012: 2951-2959.
[26]HE K, GKIOXARI G, DOLR P, et al. Mask R-CNN [C]// Proceedings of the 2017 IEEE International Conference on Computer Vision. Piscataway: IEEE, 2017: 2980-2988.
This work is partially supported by the National Natural Science Foundation of China (61671339).
LIU Yalong, born in 1994, M. S. candidate. His research interests include deep learning, medical image segmentation.
LI Jie, born in 1972, Ph. D., professor. Her research interests include image processing, intelligent transportation.
WANG Ying, born in 1981, Ph. D., associate professor. Her research interests include video processing and analysis, pattern recognition.
WU Saifei, born in 1995, M. S. candidate. His research interests include machine learning, computer vision.
ZOU Pei, born in 1993, M. S. candidate. Her research interests include video processing and analysis.
收稿日期:2019-04-29;修回日期:2019-06-26;錄用日期:2019-07-24。基金项目:国家自然科学基金资助项目(61671339)。
作者简介:刘亚龙(1994—),男,江苏苏州人,硕士研究生,CCF会员,主要研究方向:深度学习、医学图像分割; 李洁(1972—),女,陕西西安人,教授,博士,主要研究方向:图像处理、智慧交通; 王颖(1981—),女,陕西西安人,副教授,博士,CCF会员,主要研究方向:影像处理与分析、模式识别; 仵赛飞(1995—),男,河南省周口人,硕士研究生,主要研究方向:机器学习、计算机视觉; 邹佩(1993—),女,湖北孝感人,硕士研究生,主要研究方向:影像处理与分析。
文章编号:1001-9081(2019)12-3456-06DOI:10.11772/j.issn.1001-9081.2019049101

