载芬维A铵脂质体体外对恶性黑素瘤细胞增殖、凋亡和迁移的影响
崔艾丽 金哲虎
133000吉林省延吉市,延边大学附属医院皮肤科
恶性黑素瘤是源自黑素细胞的恶性肿瘤,虽然其发生率仅占皮肤肿瘤的5%左右,但因增殖快、转移快、易复发的特点,成为皮肤肿瘤致死的首位原因,占所有致死病例的75%[1]。芬维A铵[N-(4-hydroxyphenyl)retinamide,4-HPR]是一种维A酸类衍生物,具有广谱抗肿瘤作用,与传统维A酸类抗肿瘤药物相比,具有高效、低毒的特点。但是水溶性低及靶向性差等缺点导致其生物利用度低,限制其在临床上的进一步应用。有学者认为纳米靶向治疗技术有可能是克服目前治疗困难的一个潜在途径[2-3]。脂质体是靶向制剂中的一种,具有毒性低、用药剂量低等优点,并且能有效避免耐药性,使被包封药物得到有效保护,药物释放控制更有效。本课题组在前期实验中已经成功制备4-HPR脂质体,大幅度提高药物的生物利用度[4]。本研究观察4-HPR脂质体对A375及B16F10黑素瘤细胞的抑制作用及机制。
材料与方法
一、材料
1.细胞来源:人黑素瘤细胞A375和小鼠黑素瘤细胞B16F10均来自中国医学科学院基础医学研究所细胞中心。
2.试剂:4-HPR(美国Sigma-aldrich公司,纯度98%),CCK-8(日本同仁化学研究所),Hoechst33258(上海碧云天生物技术研究所),碘化丙锭染液(北京赛驰生物科技有限公司),示踪剂C6(美国Sigma-Aldrich公司)。膜联蛋白V-异硫氰酸荧光素/碘化丙锭凋亡检测试剂盒(南京凯基生物发展公司)。
3.仪器:激光共聚焦显微镜(Carl Zeiss LSM 710,德国蔡司公司),流式细胞仪(FACSAria,美国BD公司),酶标仪(Spectra Max190,美国MD公司)。
二、方法
1.细胞增殖抑制实验(CCK-8法):用CCK-8法检测空白脂质体对A375和B16F10细胞的增殖抑制,验证载体材料的生物相容性及毒性高低。结果显示,空白脂质体在浓度0.1~70 g/L范围内的细胞增殖抑制率均小于5.67%,说明载体材料的生物相容性良好,无毒副作用。将细胞分为对照组(只加等量的细胞和培养基,不加药)、4-HPR原料药物组(4-HPR组)和4-HPR脂质体组(4-HPR-L组)。收集对数生长期A375细胞、B16F10细胞,接种于96孔板,细胞密度为2 × 103/孔(200 μl)。37 ℃、5%CO2培养箱中孵育24 h。分别更换含不同浓度(0.1、1、15、30、50、70 mg/L)4-HPR和4-HPR-L的新鲜培养基继续孵育48 h,设对照孔和调零孔。吸去培养液,加入10%CCK-8无血清DMEM培养液,100 μl/孔,置培养箱内培养2 h后取出,酶标仪波长设定为450 nm,测定每孔吸光度(A值)。细胞存活率(%)=(A实验组-A调零组)/(A对照组-A调零组)×100%。
2.Hoechst33258染色观察细胞细胞凋亡:将A375、B16F10细胞置于24孔板内制备爬片,细胞密度为2 × 104/孔,37 ℃、5%CO2培养箱中孵育24 h,吸去培养液,分为3组,对照组只加新鲜培养液,其他两组分别更换含30 mg/L 4-HPR(根据CCK-8结果,选取细胞存活率50%时对应的药物浓度进行体外药效学评价)的4-HPR和4-HPR-L的培养液继续孵育48 h,吸去培养液,冷PBS洗2次,每孔加300 μl 4%多聚甲醛避光固定10 min,再用PBS洗2次,每次3 ~ 5 min。加入Hoechst33258(1 mg/L)300 μl室温暗室染核10 min,PBS清洗3次(5 min/次),取出爬片,将细胞附着面朝下,盖于滴有10 μl抗荧光淬灭封片剂的载玻片上,荧光显微镜下观察细胞核形态。
3.流式细胞仪检测细胞凋亡:取对数生长期A375、B16F10细胞,以15 × 104/孔(2 ml)的密度置于6孔板内,37℃、5%CO2培养箱中孵育24 h,吸去旧培养液,将A375细胞和B16F10细胞分别分为空白组、4-HPR组和4-HPR-L组,4-HPR和4-HPR-L组分别加入含有30 mg/L 4-HPR的4-HPR和4-HPR-L的培养液,对照组只加新鲜培养液,继续孵育48 h后,收集各孔培养液于EP管内,离心(4℃,500×g,5 min),收集细胞。冷PBS冲洗6孔板1~2次,用0.25%不含乙二胺四乙酸的胰酶消化,收集细胞,同之前收集的细胞一起再次离心,弃上清液,冷PBS清洗1~2次,再离心,每个EP管内加入结合缓冲液500 μl,混匀,避光,加入5 μl膜联蛋白V-异硫氰酸荧光素,混匀后再加入5 μl碘化丙锭染液,混匀,室温下静置10 min,过尼龙网,流式细胞仪检测,记录各组细胞凋亡数据并分析。
4.细胞划痕实验:取对数生长期A375、B16F10细胞,以10×104/孔的密度置于12孔板内,37℃、5%CO2培养箱中孵育24 h,用无菌枪头(200 μl枪头)在12孔板内做人工划痕,吸去旧培养液并用PBS清洗3次,分为3组,两组分别加入新鲜的含有30 mg/L 4-HPR的4-HPR和4-HPR-L培养液1 ml,对照组加入1 ml新鲜培养液,倒置显微镜拍照记录给药后即刻、24 h、48 h划痕愈合情况。
5.激光共聚焦显微镜观察脂质体入胞情况:将A375、B16F10细胞置于24孔板内制备爬片,细胞密度为2×104/孔,37℃、5%CO2培养箱中孵育24 h后给含有示踪剂C6脂质体(终浓度为5 mg/L)的培养液继续孵育,根据给药时间分为1、5、15、60 min组,分别于给药后不同时间,用冷PBS漂洗3次,每孔加入300 μl 4%多聚甲醛避光固定10 min,再用PBS清洗2次,加入300 μl DAPI工作液染核10 min,PBS清洗3次,取出爬片,将细胞附着面朝下,盖于滴有10 μl抗荧光淬灭封片剂的载玻片上,在488 nm波长激发光条件下,于激光共聚焦荧光显微镜下观察脂质体进入细胞的情况。
三、统计学处理
所有数据采用SPSS22.0软件进行统计分析,计量资料以±s表示,多组间数据比较采用单因素方差分析,两两组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
一、细胞增殖抑制实验
结果显示,4-HPR与4-HPR-L对A375和B16F10的增殖具有抑制作用。给药48 h后,0.1、1、15、30、50、70 mg/L 4-HPR-L组A375和B16F10细胞存活率低于同浓度4-HPR组,差异均有统计学意义(A375细胞组t值分别为 8.019、8.298、11.455、19.978、33.672、16.314,均P< 0.01;B16F10细胞组t值分别为 3.573、3.153、9.953、4.019、8.097、7.53,P< 0.05或0.01)。见图1、2。

图1 CCK-8法观察同浓度芬维A铵(4-HPR)、载4-HPR脂质体(4-HPR-L)对A375细胞的增殖抑制作用(n=5) a:同浓度4-HPR、4-HPR-L组比较,均P<0.01
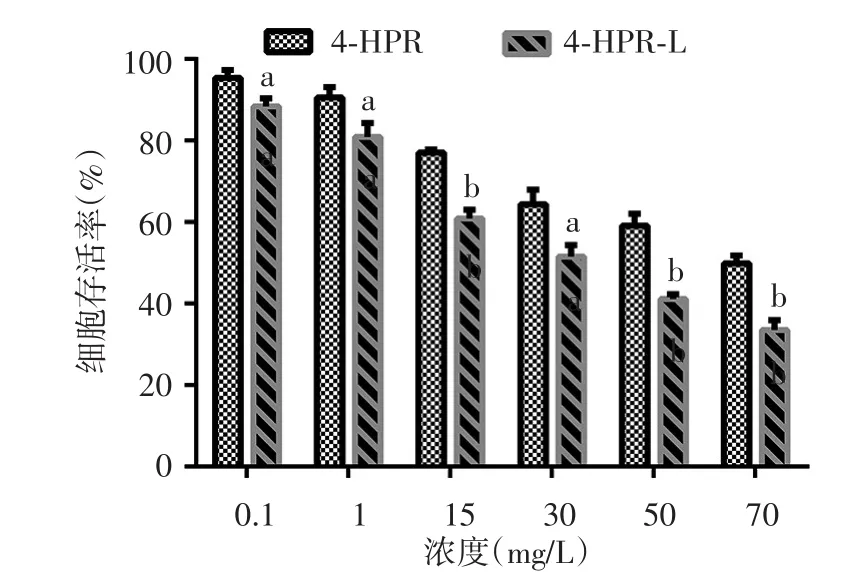
图2 CCK-8法观察同浓度芬维A铵(4-HPR)、载4-HPR脂质体(4-HPR-L)对B16F10细胞的增殖抑制作用(n=5) 同浓度4-HPR、4-HPR-L组比较,a:P < 0.05;b:P < 0.01
二、Hoechst33258染色
对照组、4-HPR组A375和B16F10细胞无明显变化,染色质均匀分散在细胞核中,4-HPR组细胞质略呈亮蓝色,而4-HPR-L组细胞体积变小,细胞质浓缩,细胞核裂解为碎块(图3箭头所示),产生凋亡小体等凋亡特征。

图3 Hoechst 33258染色观察两种黑素瘤细胞在芬维A铵(4-HPR)组、载4-HPR脂质体(4-HPR-L)诱导下凋亡细胞核的形态(×40) 黄色箭头示凋亡小体
三、细胞凋亡检测结果
给药48 h后,4-HPR组、4-HPR-L组和对照组之间A375和B16F10细胞凋亡率差异均有统计学意义(F值分别为206.236、128.204,均P<0.001)。其中,A375细胞对照组凋亡率显著低于4-HPR组和4-HPR-L组(t值分别为6.999、22.933,均P<0.01),4-HPR组显著低于4-HPR-L组(t值为11.412,P<0.01)。3组B16F10细胞凋亡率变化趋势与A375细胞类似,其中对照组与4-HPR组和4-HPR-L组相比,t值分别为5.409、15.850,4-HPR组和4-HPR-L组相比,t值为9.372,均P< 0.01。见图4、5。
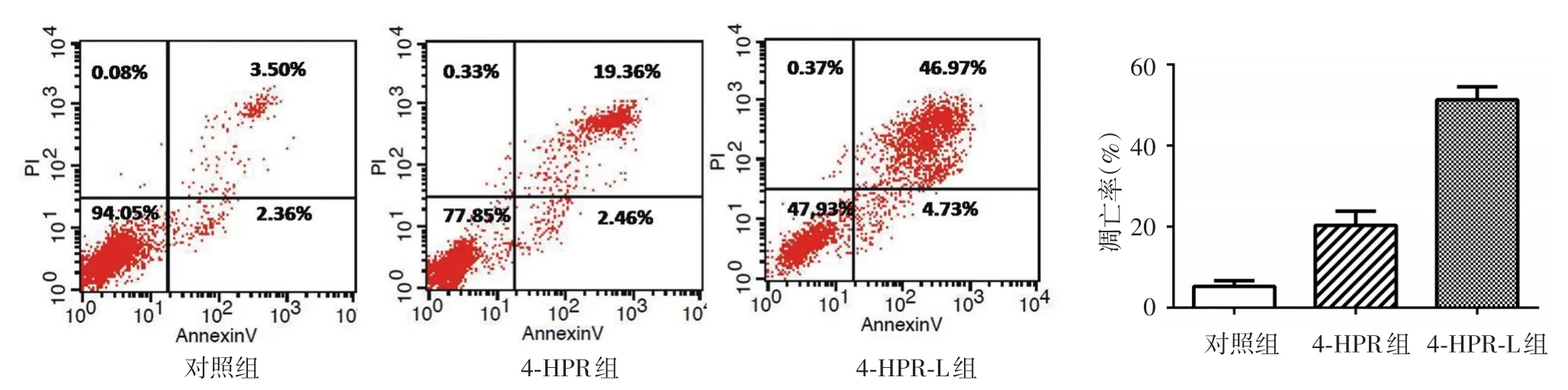
图4 流式细胞仪检测芬维A铵(4-HPR)、载4-HPR脂质体(4-HPR-L)对A375细胞凋亡率的影响 4-HPR-L组细胞凋亡率显著高于4-HPR组和对照组(P<0.01)

图5 流式细胞仪检测芬维A铵(4-HPR)、载4-HPR脂质体(4-HPR-L)对B16F10细胞凋亡率的影响 4-HPR-L组细胞凋亡率显著高于4-HPR组和对照组(P<0.01)
四、细胞划痕实验
A375和B16F10细胞与4-HPR或4-HPR-L共孵育后均出现了不同程度划痕愈合。对照组在孵育48 h后几乎完全愈合,4-HPR组也出现了明显的划痕愈合,而4-HPR-L组划痕的宽度没有明显改变,划痕依旧清晰可见。见图6、7。

图6 相同浓度芬维A铵(4-HPR)、载4-HPR脂质体(4-HPR-L)作用不同时间对A375细胞平面迁移的影响(×40)

图7 相同浓度芬维A铵(4-HPR)、载4-HPR脂质体(4-HPR-L)在不同时间对B16F10细胞平面迁移的影响(×40)
五、激光共聚焦显微镜观察脂质体入胞情况
给药1 min后,细胞内有少量C6绿色荧光,5 min和15 min时细胞内绿色荧光增多,60 min时,细胞内有很强的绿色荧光,细胞核内也可见绿色荧光,说明脂质体包载的药物能成功进入细胞,且入胞速度很快。见图8。

图8 共聚焦显微镜观察不同时间点A375和B16F10细胞对C6脂质体的摄取情况 C6显示绿色荧光,为脂质体示踪剂;DAPI显示蓝色荧光,为细胞核染色剂
讨 论
近年来,关于4-HPR对肿瘤细胞的抑制作用成为众多学者研究的热点。4-HPR通过抑制细胞增殖、促进细胞分化并诱导其凋亡、影响某些信号途径的传导等机制来抑制肿瘤细胞增殖[5]。有研究报道,4-HPR可通过PI3K-Akt-mTOR通路[6]、FAK/AKT/GSK3β通路、NF-κB通路的多个环节产生影响,或者调控细胞周期和应激反应作用于细胞[7],也可通过改变细胞内活性氧的生成及引发自噬[8]、线粒体膜电位的变化、细胞色素C的分泌等多种因素共同发挥作用[9]。
本文细胞增殖抑制实验中,先进行大范围浓度初筛,多次实验后确定浓度范围在0.1~70 mg/L内。实验证实制备的4-HPR-L生物相容性良好,且4-HPR-L与4-HPR原料药相比,药物的细胞毒性作用提高,可更有效地抑制肿瘤细胞增殖。Hoechst33258染色显示,给药后A375和B16F10细胞出现了凋亡的显著特征,而流式细胞仪检测的结果也显示4-HPR-L组肿瘤细胞的凋亡率显著高于HPR组,与上述细胞增殖实验结果相一致。
侵袭和迁移在恶性肿瘤转移过程中发挥着重要的作用,侵袭和迁移能力往往是检测肿瘤恶性程度的指标之一[10]。我们通过在体外培养的单层A375和B16F10细胞上制造人工划痕,观察两种细胞向空白划痕处迁移的情况,发现4-HPR-L能更好地抑制A375细胞和B16F10细胞平面迁移,具有体外抗转移的能力。共聚焦显微镜观察也证实,细胞能很快对脂质体进行摄取。下一步我们将进行动物体内实验研究,进一步验证4-HPR-L生物利用度及对细胞凋亡和迁移能力的影响。
综上所述,4-HPR-L能更好地进入A375细胞、B16F10细胞,且能有效抑制A375细胞、B16F10细胞的增殖并诱导其凋亡,为今后4-HPR-L用于治疗黑素瘤提供了理论依据。

