siRNA沉默HIF-1α基因抑制缺氧诱导的Hela细胞顺铂耐药的研究
徐瑾 李卫红 陈国斌
作者单位:518028 深圳市妇幼保健院妇科
子宫颈癌是常见的妇科恶性肿瘤, 我国每年约有超过100000的新发病例, 是严重危害女性健康的常见恶性肿瘤[1]。化疗是宫颈癌的重要治疗方式, 以铂类药物为基础的化疗是宫颈癌化疗的一线选择, 其中顺铂是常用的宫颈癌化疗药物[2]。肿瘤细胞耐药可致化疗欠佳, 使患者得不到有效的治疗而死于癌症;化疗药物耐药是目前肿瘤治疗面临的难题, 但肿瘤耐药的机制目前尚不清楚。恶性肿瘤细胞由于生长迅速而使细胞微环境处于缺氧状态, 缺氧可使瘤细胞对化疗的抗性增加, 故目前研究认为肿瘤细胞微环境缺氧是肿瘤产生耐药的重要原因[3,4]。缺氧诱导因子1α(hypoxia induced factor 1α, HIF-1α)是细胞在缺氧状态下稳定表达的核转录因子, 可在转录水平调控诸多靶基因的表达从而导致肿瘤细胞的化疗耐药, 已报道与多种恶性肿瘤铂类耐药有关[4,5]。但在宫颈癌方面研究报道较少, 本研究拟siRNA沉默宫颈癌Hela细胞的HIF-1α基因, 观察缺氧培养条件下hela细胞对顺铂的敏感性, 探讨宫颈癌顺铂耐药的机制, 为减少宫颈癌化疗耐药提供科学依据。
1 材料与方法
1.1 主要试剂与仪器 顺铂(上海阿拉丁生化科技股份有限公司), Lipofectamine3000(Invitrogen), CCK-8(上海碧云天),RT-PCR试剂盒(TAKARA), HIF-1α试剂盒(Abcam),AnnexinV-FITC-FITC/PI凋 亡 检 测 试 剂 盒 (solarbio)。HIF-1α siRNA 由上海吉玛制药技术有限公司合成, 包含1条目的 siRNA链和1条阴性对照, si-HIF-1α:Forward:5’GATCCCGCACAGTTACAGTA TTCCATCA AGAGTG GAATACTGTAACTGTGCTTTITT-3’, Reverse:5’-CTAGAAAAAAGCACA GTTACAGTATCCACTCTTGATGGAAT ACTGTAACTGTGCGG-3’。引物由上海生工合成。三气培养箱(NU4950型), 荧光定量PCR仪(BIO-RAD), 酶标仪(美国BIO TEK), 流式细胞仪 (BIO-RAD), 超灵敏度化学发光成像系统(BIO-RAD)。
1.2 细胞培养 宫颈癌细胞株Hela细胞购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库, 用含10%胎牛血清的RPMI Medium 1640 basic培养基培养, 青霉素和链霉素浓度均为100 U/ml, 在37℃、5%CO2的培养箱中培养。
1.3 细胞转染及处理 将Hela 细胞接种于6孔板中, 待细胞融合达到40~50%时, 每孔加入900 μl Optimen@I Medium。将 3 μl的 Lipofectamine3000 和 5 μl的 siRNA 分别与 50 μl的Optimen@I Medium轻轻混匀, 静置 5 min, 然后将上述混合液轻轻混匀, 静置20 min后分别加入相应实验分组中。实验分四组:①正常氧培养组(对照组)②低氧组(单纯低氧培养) ③低氧阴性对照组(低氧培养并转染siRNA阴性对照链)④实验组(低氧培养并转染si-HIF-1α链)。
1.4 WB 和RT-PCR检测HIF-1α蛋白及其mRNA 将1.3转染的细胞培养48 h后收集, Trizol法提取mRNA,RT-PCR法检测mRNA含量, HIF-1α引物:Forward:5’GCCAGATGATC ATGCAGCTACT-3’, Reverse :5’-TGCTCCCTTCCATTCTGTTCAC-3’, 按试剂盒说明进行操作。72 h后收集细胞, RIPA裂解液提取蛋白, PAGE凝胶电泳分离蛋白, PVDF转膜, 5%脱脂牛奶封闭, HIF-1α抗体封闭过夜, 二抗孵育1 h后上机显影。
1.5 CCK-8法检测Hela细胞的药物敏感性 将1.3转染的细胞制成悬液, 以1×105/ml 的细胞密度接种于96孔板, 每孔加入100 μl细胞悬液, 每组设5个复孔, 培养72 h后分别加入含 2、4、8、16、32 μg/ml 顺铂的培养液 100 μl, 24 h 后每孔加入10 μl CCK-8, 培养箱内孵育2 h后酶标仪上测定450 nm处的吸光度值(OD), 据平均OD值计算出药物IC50。
1.6 CCK-8法检测顺铂对肿瘤细胞增殖的影响 将1.3转染的细胞制成悬液, 以5×104/ml 的细胞密度接种于96孔板,每孔加入100 μl细胞悬液, 每组设5个复孔, 培养24 h待细胞贴壁加入含5 μg/ml顺铂的完成培养基100 μl, 分别于药物作用的0、24、48、72、96 h行CCK-8检测, 每孔加入10 μl CCK-8, 培养箱内孵育1 h后酶标仪上测定450 nm处的吸光度值(OD), 根据OD值计算细胞生长抑制率。
1.7 流式细胞仪检测细胞凋亡率 将1.3转染的细胞制成悬液, 以2×105/ml 的细胞密度接种于6孔板, 每孔加入1 ml细胞悬液, 培养72 h后加入含5 μg/ml顺铂的完成培养基1 ml,药物作用24 h后去除培养液, PBS洗涤2次后加不含EDTA的胰酶消化细胞, 离心后PBS洗涤2次加入Binding Buffer重悬细胞 , 加入 10 μl Annexin V-FITC 和 5 μl Popidium Iodide,轻轻混匀, 室温避光孵育15 min后上机检测。
1.8 统计学方法 采用SPSS20.0统计学软件进行数据分析。计量资料以均数±标准差(±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验或Kruskal-Wallis检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 不同氧浓度度培养下Hela细胞HIF-1α表达及细胞增殖 HIF-1α是细胞缺氧状态下表达的核转录因子。HIF-1α在15%、10%和5%氧浓度培养下其蛋白表达明显增加。HIF-1α mRNA在低氧培养下高表达, 20%氧浓度组明显低于15%、10%和5%组, 差异均具有统计学意义(P<0.05)。15%氧浓度高于5%组, 差异具有统计学意义(P<0.05)。15%氧浓度高于10%组, 差异无统计学意义(P>0.05)。在细胞增殖方面, 适度缺氧可以促进细胞增殖,CCK8检测示15%和10%氧浓度培养其OD值明显高于20%氧浓度培养, 在72 h后差异均具有统计学意义(P<0.05)。而过度的缺氧可抑制细胞增殖, 5%氧浓度培养其OD值明显低于20%、15%和10%氧浓度培养。而15%和10%氧浓度培养, 72 h前两组比较差异无统计学意义(P>0.05), 但96 h后15%氧浓度组OD值高于10%氧浓度组, 差异具有统计学意义(P<0.05)。见图1。因此本实验选择15%氧浓度作为后续实验的缺氧培养。
2.2 si-HIF-1α处理后HIF-1α蛋白及其mRNA的表达对照组HIF-1α蛋白表达较低, 而低氧组和低氧阴性对照组HIF-1α蛋白表达明显升高, 实验组si-HIF-1α转染后低氧培养其HIF-1α蛋白表达明显下降, 低于低氧组和低氧阴性对照组, 差异均具有统计学意义(P<0.05)。HIF-1αmRNA在低氧组和低氧阴性对照组表达明显高于对照组, 差异均具有统计学意义(P<0.05)。实验组si- HIF-1α转染后低氧培养其HIF-1αmRNA表达明显下降, 低于低氧组和低氧阴性对照组, 差异均具有统计学意义(P<0.05), 而实验组HIF-1αmRNA表达高于对照组, 差异无统计学意义(P>0.05)。见图2。
2.3 不同氧浓度培养下Hela细胞的顺铂IC50 20%氧浓度组IC50明显低于15%、10%和5%组, 差异均具有统计学意义(P<0.05)。15%和5%氧浓度组IC50高于10%组, 三组比较差异无统计学意义(P>0.05)。后期实验选择顺铂浓度为6 μg/ml。见表 1。
2.4 si-HIF-1α处理后Hela细胞缺氧下顺铂对Hela细胞的IC50 对照组IC50明显低于低氧组和低氧阴性对照组, 差异均具有统计学意义(P<0.05), 低氧阴性对照组IC50高于低氧组, 但差异无统计学意义(P>0.05)。低氧阴性对照组IC50高于实验组, 差异具有统计学意义(P<0.05)。见表2。
2.5 缺氧培养下顺铂对Hela细胞的活性抑制 顺铂对Hela细胞的抑制随时间梯度逐渐增加, 在低氧培养48 h内各组间顺铂对细胞的生长抑制率差异无统计学意义(P>0.05);72、96 h低氧组及低氧阴性对照组细胞生长抑制率明显低于对照组, 实验组细胞生长抑制率高于低氧组及低氧阴性对照组,差异均具有统计学意义(P<0.05);72、96 h实验组细胞生长抑制率低于对照组, 但差异无统计学意义(P>0.05)。见表3。
2.6 低氧下顺铂对Hela细胞凋亡的影响 低氧组及低氧阴性对照组顺铂刺激24 h后细胞凋亡率分别为20.7%、23.7%,低于对照组的40.8%及实验组的37.6%, 差异具有统计学意义 (P<0.05)。见图 3, 图 4。
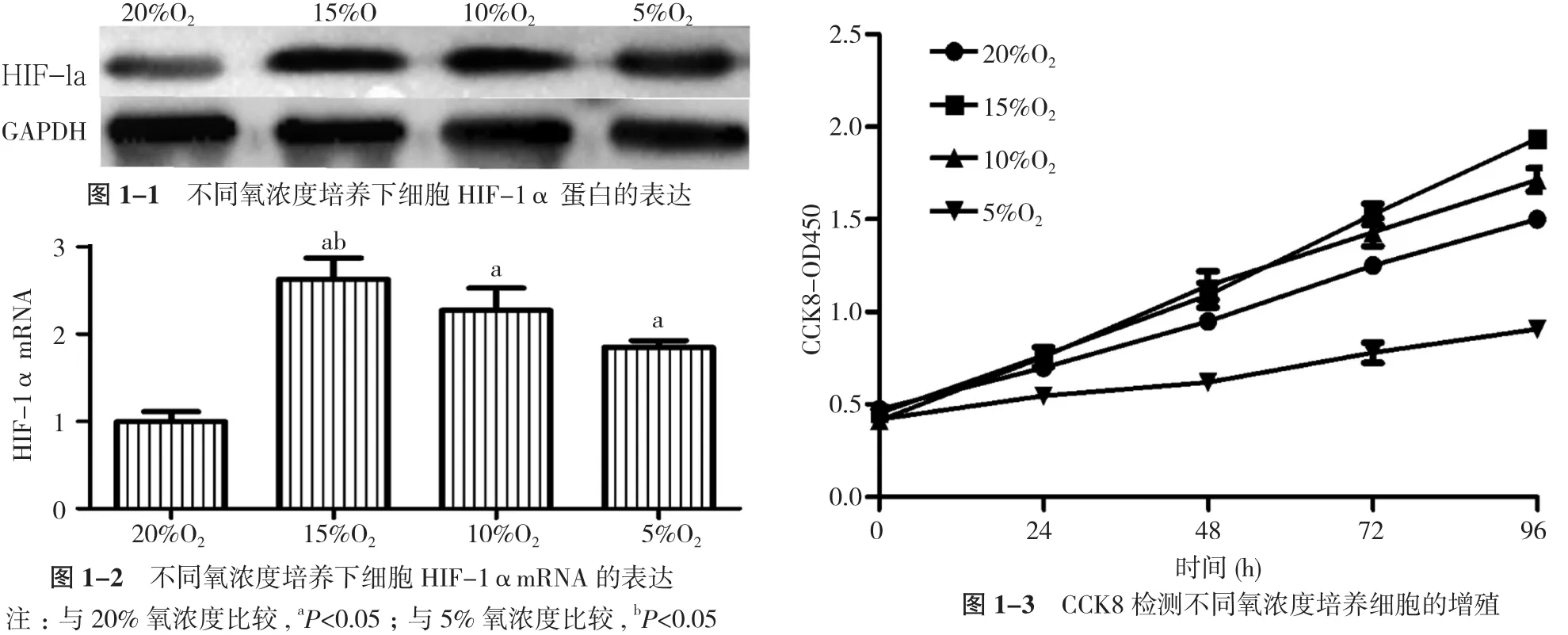
图1 不同氧浓度培养Hela细胞HIF-1α表达及其细胞增殖
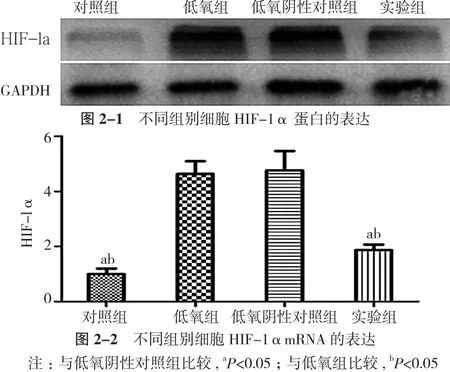
图2 不同组别Hela细胞HIF-1α表达
表1 不同氧浓度培养下Hela细胞的顺铂IC50值比较( ±s, μg/ml)

表1 不同氧浓度培养下Hela细胞的顺铂IC50值比较( ±s, μg/ml)
注:与20%O2组比较, aP<0.05
组别 IC50 20%O2组 4.79±0.23 15%O2组 6.04±0.27a 10%O2组 5.78±0.20a 5%O2组 6.03±0.62a
表2 不同组别Hela细胞的顺铂IC50值比较( ±s, μg/ml)
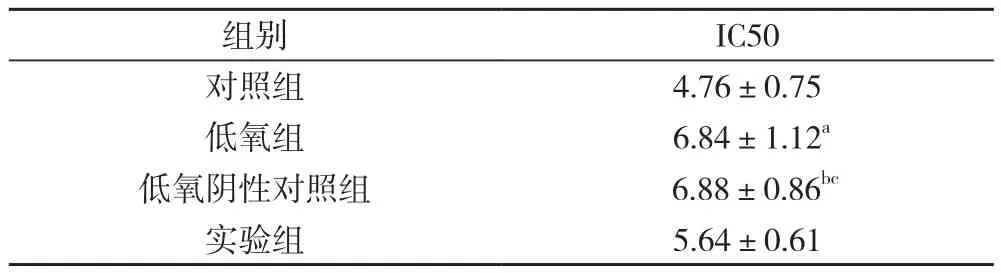
表2 不同组别Hela细胞的顺铂IC50值比较( ±s, μg/ml)
注:与对照组比较, aP<0.05;与低氧组比较, bP>0.05;与实验组比较,cP<0.05
组别 IC50对照组 4.76±0.75低氧组 6.84±1.12a低氧阴性对照组 6.88±0.86bc实验组 5.64±0.61
表3 不同时间顺铂对Hela细胞的生长抑制率( ±s, %)
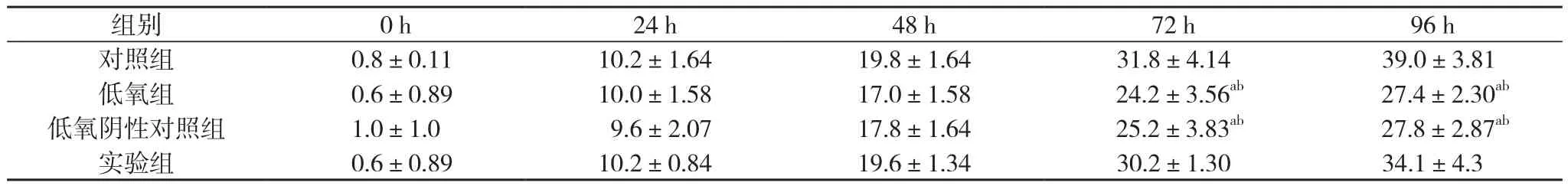
表3 不同时间顺铂对Hela细胞的生长抑制率( ±s, %)
注:与对照组比较, aP<0.05;与实验组比较, bP<0.05
组别 0 h 24 h 48 h 72 h 96 h对照组 0.8±0.11 10.2±1.64 19.8±1.64 31.8±4.14 39.0±3.81低氧组 0.6±0.89 10.0±1.58 17.0±1.58 24.2±3.56ab 27.4±2.30ab低氧阴性对照组 1.0±1.0 9.6±2.07 17.8±1.64 25.2±3.83ab 27.8±2.87ab实验组 0.6±0.89 10.2±0.84 19.6±1.34 30.2±1.30 34.1±4.3
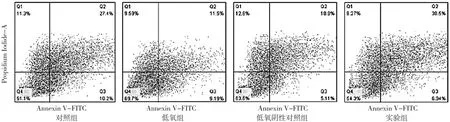
图3 低氧下顺铂对Hela细胞凋亡的影响
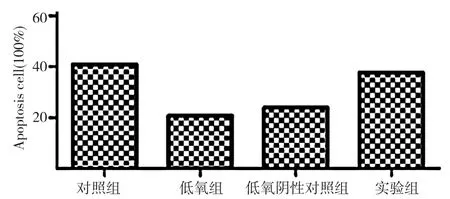
图4 不同组别低氧下顺铂对Hela细胞凋亡比较
3 讨论
宫颈癌是常见的妇科恶性肿瘤, 严重危害女性的健康,我国每年约有27000人因宫颈癌而死亡, 提高宫颈癌的疗效和减少因癌致死率是目前临床上亟待解决的问题[1]。化疗是宫颈癌重要治疗的方法, 化疗有高危因素、肿瘤复发、转移或者晚期宫颈癌患者必不可少的治疗, 以顺铂为基础的化疗或者同步放化疗可提高宫颈癌患者的5年生存率, 使宫颈癌患者的死亡风险下降28%~50%, 尤其对于晚期或者全身多处转移的患者[6]。顺铂为铂的金属络合物, 可作用于DNA形成顺铂/DNA复合物从而破坏DNA的复制, 或与核蛋白结合导致DNA损伤, DNA复制障碍或损伤可通过P53、促分裂原活化蛋白激酶等介导细胞凋亡信号的激活, 从而导致细胞凋亡或细胞增殖抑制[7]。然而, 铂耐药是宫颈癌临床治疗中不可忽视的问题, 铂耐药是中晚期宫颈癌治疗失败因癌致死的原因之一[8]。肿瘤耐药可能与肿瘤微环境低氧状态有关, 肿瘤在发生、发展过程中不断的分裂增殖, 瘤体不断增大, 而瘤体周围血管不能相应提供足够的血供造成肿瘤细胞缺血缺氧, 肿瘤细胞为适应低氧微环境改变而表达缺氧诱导因子(HIF), HIF诱导下游基因表达使肿瘤细胞适应缺氧[9]。HIF-1α是HIF的氧调节亚单位, 是细胞低氧环境下发挥作用的重要核转录因子, 可在转录水平调控多个靶基因, 从而导致肿瘤耐药的产生, 目前已报道HIF-1α与多种肿瘤耐药相关[10,11]。但关于HIF-1α与宫颈癌顺铂耐药的研究报道较少, 本研究拟低氧条件下培养宫颈癌Hela细胞, 观察低氧培养条件Hela细胞对顺铂的敏感性, 探讨HIF-1α与低氧诱导的耐药的关系。课题组将Hela细胞于低氧条件下培养48 h和72 h后分别检测HIF-1α蛋白及其mRNA的表达, 结果显示HIF-1α蛋白及其mRNA在低氧培养条件下明显表达, 而正常氧培养下表达不明显, 说明HIF-1α是细胞受缺氧刺激而特异性表达的, 这与Kourti等[12]报道一致。但HIF-1α与Hela细胞顺铂耐药有何关联, 课题组将Hela细胞低氧培养72 h后加入顺铂并检测其IC50, 结果显示低氧组IC50明显高于对照组(P<0.05), 实验组通过siRNA技术沉默HIF-1α基因后, 其IC50明显低于低氧阴性对照组(P<0.05), 由此可见低氧培养下Hela细胞合成的HIF-1α与顺铂耐药密切相关, 在其他肿瘤研究中亦有报道, GU等[13]通过siRNA技术敲除前列腺癌PC-3细胞的HIF-1α基因发现其提高顺铂的抗癌性。课题组进一步研究低氧与Hela细胞耐药的时间关系,观察不同培养条件下Hela细胞在相同顺铂浓度作用下的生长抑制情况, 在顺铂用药的48 h内各组间Hela细胞生长抑制率差异无统计学意义(P>0.05), 但72、96 h低氧组和低氧阴性对照组其细胞生长抑制率明显低于对照组(P<0.05), 而实验组由于通过基因技术敲除HIF-1α, 其生长抑制率明显低于低氧阴性对照组(P<0.05), 从时间梯度可见随低氧培养时间的延长Hela细胞表达HIF-1α明显增加, HIF-1α的表达可促进Hela细胞对顺铂耐药。耐药可抑制肿瘤细胞的凋亡, 肿瘤细胞在化疗药物的作用下仍可继续增殖, 课题组进一步研究低氧对Hela细胞凋亡的影响, 将Hela细胞低氧培养72 h后加入顺铂, 24 h后流式细胞仪检测Hela细胞凋亡, 结果显示低氧组及低氧阴性对照组其凋亡率均明显低于实验组和对照组(P<0.05), 由此可见低氧可抑制顺铂诱导的Hela细胞凋亡, 而抑制凋亡的机制与细胞低氧下表达的HIF-1α相关。
综上所述, 本研究认为Hela细胞在低氧条件表达HIF-1α,HIF-1α可促进细胞对顺铂的耐药, 抑制细胞凋亡, 从而促进肿瘤继续增殖;而敲除HIF-1α基因的表达可抑制低氧诱导的顺铂耐药, HIF-1α与Hela细胞的化疗药物耐药密切相关, 阻断HIF-1α的表达对于提高化疗药物的肿瘤抗性具有重要的意义。但HIF-1α是通过何种机制介导Hela细胞顺铂耐药, 其机制尚不清楚, 将在后续的实验进一步研究。

