不同酶水解对乳脂挥发性化合物的影响
李 扬,李 妍,王筠钠,张列兵,
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京工商大学食品学院,北京 100048)
牛乳脂肪是乳制品的重要组成部分,除给予机体热量外,还对食物感官特性有不可忽视的作用。乳脂含量高的乳制品具有更浓郁的香气和醇厚的口感[1]。另一方面,脂肪的过度摄入会增加肥胖、冠心病、高血压等疾病的发病率。因此,脱脂或低脂食品受到了这些特定人群的关注。但因为低脂或脱脂食品风味较全脂食品差,口感单薄,在一定程度上制约其推广。
脂肪酶(EC3.1.1.3)是水解酶类的一种,主要水解乳脂甘油三酯的酯键[2],水解作用发生在水油界面上。当体系中无水油界面时,角质酶(EC3.1.1.74)可以发挥水解乳脂的作用[3]。水解乳脂产生的游离脂肪酸,尤其是短链脂肪酸是稀奶油[4]、黄油[5]、酸黄油[6]、奶酪[7]等乳制品的一类重要风味化合物。通过水解作用使乳脂中的风味化合物释放,可在一定程度上改善乳脂风味。水解产物可直接添加或经过加工制备成天然奶味香精后添加于许多食品中,改善食品风味。国内外已有较多相关研究,Hiroshi[8]利用脂肪酶与脂肪氧合酶共同作用于无水黄油,制备黄油风味香精。
不同酶的底物特异性不同,作用于乳脂后产生的游离脂肪酸种类及数量也不同,因此水解后乳脂的感官特性也会有一定差异[9-11]。水解率较低时乳脂产品风味更为饱满;当水解率较高时可给予乳脂黄油味、奶油味或奶酪味[12]。本研究采用固相微萃取-气相色谱-质谱联用法检测乳脂水解前后挥发性化合物组成,分析2 种脂肪酶、2 种角质酶对3 种乳脂水解的影响,旨在为乳脂酶解增香技术提供更多的借鉴。
1 材料与方法
1.1 材料与试剂
无盐黄油A(脂肪质量分数82.1%)、稀奶油(脂肪质量分数36%)产地欧洲;无盐黄油B(脂肪质量分数82.9%)产地澳洲;所有乳脂样品为市售产品。
脂肪酶D活力4 921 U/g,最适温度40 ℃,最适pH 6.0,内生根毛霉来源;脂肪酶E活力4 513 U/g,最适温度25 ℃,最适pH 7.5,内生根毛霉来源;角质酶F活力6 125 U/g,最适温度45 ℃,最适pH 8.0,樟荣枝霉来源;角质酶G活力45 368 U/g,最适温度50 ℃,最适pH 8.0,太瑞斯梭孢壳霉来源。脂肪酶与角质酶由中国农业大学酶工程实验室提供。
1.2 仪器与设备
GCMS-QP2010气相色谱-质谱联用仪(配有NIST数据库)、AOC-5000自动进样系统 日本岛津公司。
1.3 方法
1.3.1 乳脂的水解
1.3.1.1 反应底物的配制
于50 mL具塞三角瓶中加入14 g底物,分别加入pH 6.0、7.5、8.0的0.02 mol/L的磷酸钠缓冲液1 g,配制3 种不同pH值底物质量分数为93.3%的溶液。于50 mL具塞三角瓶中加入7.5 g乳脂,分别加入pH 6.0、7.5、8.0的0.02 mol/L的磷酸钠缓冲液7.5 g,配制3 种不同pH值的底物质量分数为50%溶液。
1.3.1.2 乳脂的水解反应
于pH 6.0的底物体系中加入100 U/g脂肪酶D,40 ℃进行水解反应;于pH 7.5的底物体系中加入100 U/g脂肪酶F,25 ℃进行水解反应;于pH 8.0的底物体系中加入100 U/g角质酶F,45 ℃进行水解反应;于pH 8.0的底物体系中加入250 U/g角质酶G,50 ℃进行水解反应。水解过程中,摇床转速为150 r/min,水解反应结束后,沸水浴保温25 min使酶灭活。
水解反应体系中加入酶后,立即于沸水浴中保温25 min使酶灭活作为水解0 h样品。
1.3.2 酸值的测定方法
依据GB/T 5530—2005《动植物油脂 酸值和酸度测定》测定水解产物的酸值[13]。
1.3.3 固相微萃取-气相色谱-质谱法
于20 mL萃取瓶中加入7 g样品,55 ℃水浴平衡20 min后,采用50/30 μm DVB/CAR/PDMS萃取头吸附30 min后直接插入气相色谱进样口进行检测。
色谱柱:DB-WAX毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:起始温度40 ℃,保持3 min,以5 ℃/min升温至120 ℃,以10 ℃/min升温至200 ℃,保温13 min;载气(He)流速1.6 mL/min,不分流进样;进样口温度200 ℃;离子源温度200 ℃;质量扫描范围m/z 35~500;溶剂延迟时间2 min。
根据NIST标准质谱库结合文献描述对目标物质进行检索,匹配相似度大于80的醛类、酮类、酸类、内酯类化合物作为检出物。
1.4 数据分析
利用Qualitative Analysis B.07.00积分测定挥发性化合物,用峰面积表示挥发性化合物含量,利用Excel计算挥发性化合物总峰面积。
2 结果与分析
2.1 水解对乳脂酸值的影响
从表1可以看出,不同酶水解引起乳脂酸值的变化不同。2 种脂肪酶及角质酶F水解3 种乳脂底物后,酸值有不同程度的增加。2 种黄油为底物时,角质酶G几乎未发挥水解作用,稀奶油为底物时,仅有极弱的水解作用,因此不再对角质酶G进行后续研究。3 种乳脂经脂肪酶D水解后酸值增加量大于15 mg/g,其中质量分数50%的黄油A水解后酸值变化最小,酸值约为16.25 mg/g。质量分数50%的2 种黄油经脂肪酶E水解后酸值变化最大;2 种质量分数的稀奶油经脂肪酶E水解后酸值变化最小,酸值增加量约为14 mg/g。2 种黄油经角质酶F水解后酸值变化小于稀奶油,黄油水解后酸值在7~10 mg/g范围内,稀奶油酸值增加量大于30 mg/g。Regado等[12]比较了1 种角质酶与10 种脂肪酶水解3 种不同动物乳脂的效果,发现乳脂经过不同酶的水解后水解率不同,其中角质酶水解率最低,约为0.1%。这与本研究的结果不完全一致,本研究中角质酶G水解3 种不同乳脂引起酸值的变化较脂肪酶小,而角质酶F水解引起稀奶油酸值的变化较脂肪酶大。出现这种结果的原因可能与不同酶最优水解条件的差异有关,底物种类和浓度对酶的水解作用有一定的影响[14]。黎海彬等[15]利用脂肪酶Palatase 20000L水解无水奶油时发现,当底物添加量处于75%~85%之间时脂解率迅速增大,而底物添加量超过85%后脂解开始变缓。

表1 2 种脂肪酶及2 种角质酶引起的乳脂酸值的变化Table1 Acid value of milk fat before and after hydrolysis by lipase D,lipase E, cutinase F or cutinase G
2.2 酶水解对乳脂挥发性化合物的影响
2.2.1 脂肪酶D水解对乳脂挥发性化合物的影响
如表2所示,质量分数93.3%及50%的黄油A水解后,挥发性化合物种类分别由6、4 种增加至12 种。水解后游离脂肪酸种类增至11 种,其中辛酸含量最高,质量分数93.3%时,水解后辛酸峰面积为7.32×107;质量分数50%时,辛酸峰面积为8.94×107。质量分数93.3%的黄油B水解后挥发性化合物个数由10 种增至12 种,质量分数50%的黄油B水解后挥发性化合物由5 种增加至11 种,其中辛酸含量最高,质量分数93.3%时,辛酸峰面积为9.46×107;质量分数50%时,辛酸峰面积为9.09×107。2 种质量分数的稀奶油经脂肪酶D水解后挥发性化合物中游离脂肪酸含量增加,当质量分数93.3%时,丁酸含量最高,峰面积为2.10×107,当质量分数50%时,水解后挥发性化合物中含量最高的为辛酸,峰面积为5.01×107。可以看出,不同乳脂经过脂肪酶D水解后,游离脂肪酸种类和含量增加,而δ-癸内酯含量却未明显增加。
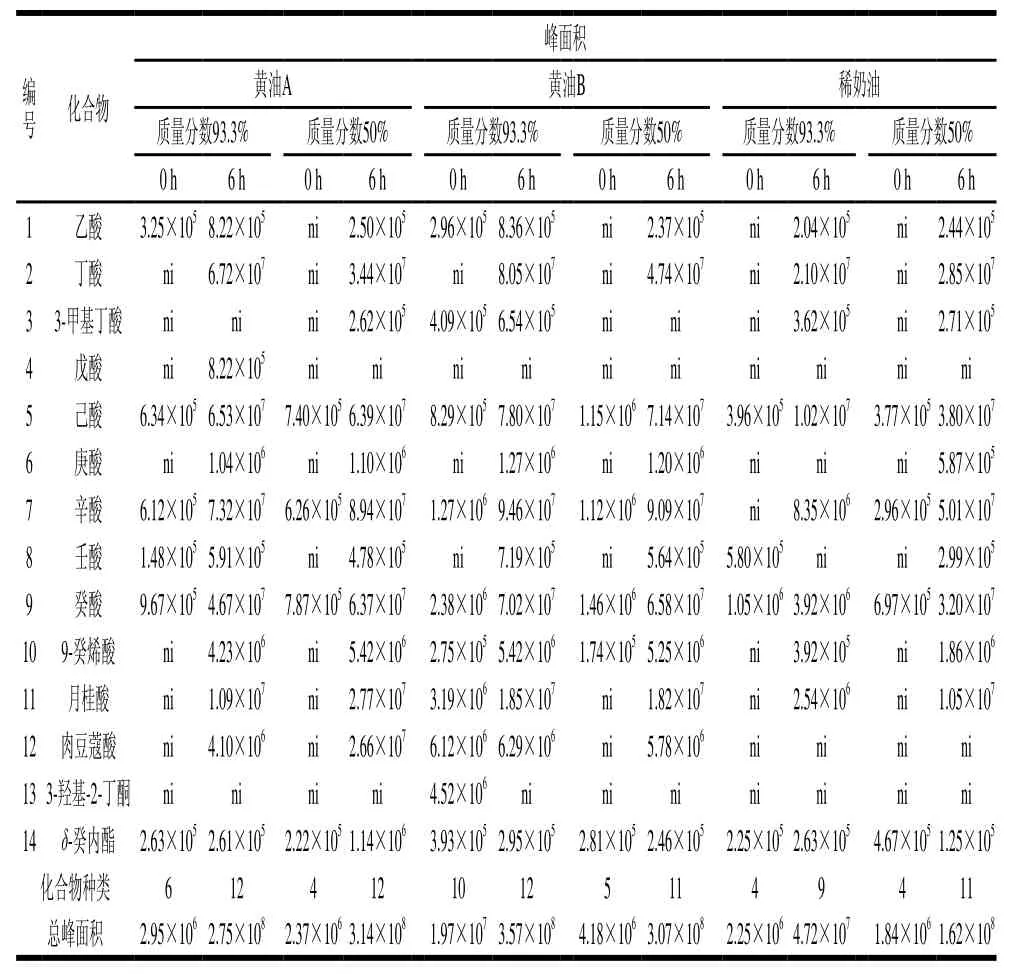
表2 脂肪酶D水解对乳脂挥发性化合物的影响Table2 Volatile compound prof i les of milkfat before and after hydrolysis by lipase D
2.2.2 脂肪酶E水解对乳脂挥发性化合物的影响

表3 脂肪酶E水解对乳脂挥发性化合物的影响Table3 Volatile compound prof i les of milkfat before and after hydrolysis by lipase E
如表3所示,质量分数93.3%的黄油A水解后挥发性化合物由6 种增至12 种,水解后挥发性化合物中丁酸、己酸、辛酸含量相差不多,是3 种含量最高的挥发性化合物。质量分数50%的黄油A水解后挥发性化合物由4 种增至12 种,其中辛酸、己酸、丁酸及癸酸含量最高。93.3%黄油B水解后挥发性化合物由10 种增加至13 种,其中辛酸含量最高,峰面积为2.45×107。50%黄油B水解后挥发性化合物由4 种增加至12 种,其中含量最高的脂肪酸为辛酸,峰面积为4.68×107。2 种质量分数稀奶油经脂肪酶E水解后挥发性化合物增至11 种,其中己酸含量最高,质量分数93.3%时,己酸峰面积为6.66×107,质量分数50%时,己酸峰面积为1.06×108。乳脂经脂肪酶E水解后,挥发性化合物中的游离脂肪酸含量增加,而δ-癸内酯及酮类化合物含量未出现增加趋势。
2.2.3 角质酶F水解对乳脂挥发性化合物的影响
如表4所示,黄油A水解前挥发性化合物包括游离脂肪酸类、δ-癸内酯及甲基酮类化合物,经角质酶F水解后,游离脂肪酸的种类和含量增加,其中己酸含量最高,当黄油A质量分数93.3%时,己酸峰面积为9.75×107,当质量分数50%时,己酸峰面积为5.83×107。黄油B水解后挥发性化合物中己酸含量最高,当质量分数93.3%时,己酸峰面积为9.09×107,当质量分数50%时,己酸峰面积为9.34×107。稀奶油经角质酶F水解后,当稀奶油质量分数93.3%时,水解后挥发性化合物中己酸与辛酸的峰面积相差不多,峰面积分别为1.43×108和1.44×108;当稀奶油质量分数50%时,水解后癸酸含量最高,峰面积为1.92×108,其次为辛酸,峰面积为1.66×108。

表4 角质酶F水解对乳脂挥发性化合物的影响Table4 Volatile compound prof i les of milkfat before and after hydrolysis by cutinase F
从表2~4可以看出,当底物种类和质量分数相同时,乳脂水解前(0 h)挥发性化合物的组成有一定差异,这可能与反应体系不同有关。水解0 h的乳脂中分别按比例加入不同的酶,且3 种反应体系起始pH值不同,这可能是导致乳脂水解前挥发性化合物组成不同的原因。研究认为,风味化合物在顶空气体与液体及有机与水相间的分配会受到多种因素的影响,如pH值[16]、脂肪[17]等。另一方面,可能与乳脂水解前挥发性化合物含量较低有关,叶国注等[18]采用顶空固相微萃取分析绿茶香气成分时发现,低含量的香气成分在顶空固相微萃取及检测分析中不稳定,可能会出现检测不出的情况。
虽然脂肪酶D、脂肪酶E与角质酶F水解引起乳脂酸值的变化程度不同,且3 种酶的最优水解条件不一致,但可以看出,酶水解引起乳脂挥发性化合物的变化有相似性。乳脂水解前后挥发性化合物组成发生明显变化,游离脂肪酸总量增加,丁酸、己酸、辛酸、癸酸4 种脂肪酸含量最高,这与王蓓等[19]的研究结论一致。乳脂水解后δ-癸内酯及酮类2 种风味化合物的占比下降,这与乳脂的组成特性有关。乳脂甘油三酯中的脂肪酸以偶数碳的直链脂肪酸为主,而内酯类化合物的前体物质4/5-羟基脂肪酸在乳脂中含量较少[20],因此无法仅通过酶的水解作用产生大量的内酯类化合物。甲基酮类化合物常需通过微生物的不完全β-氧化途径代谢脂肪酸[21]或者高温加热黄油[22]产生。乳脂水解产生的游离脂肪酸阈值低,尤其是丁酸在乳脂中的阈值为0.66 mg/kg[23],其对乳脂风味有重要的影响。丁酸呈奶酪味、乳臭味,己酸呈奶酪味、辛辣味[24],辛酸呈奶油味、涩味,癸酸呈甜味、奶油味、陈腐味[23],这些脂肪酸是奶酪风味的重要来源[25-26]。乳脂经过不同酶水解后挥发性化合物的组成不同,可用于制备不同风味特征的香精。在研究中也发现,水解开始阶段,乳脂风味有一定程度改善,随着水解程度的增加,乳脂出现不同程度的酸败味、异味。这与姚正晓[27]的研究结果类似,水解产物中脂肪酸含量过高,导致水解产物的整体风味强度过大,不够柔和。出现这种现象的原因,一方面可能与不同种类风味化合物间的平衡被破坏有关,当游离脂肪酸与其他风味化合物含量处于某种平衡时乳脂风味才比较理想[28]。另一方面可能与中短链脂肪酸在高浓度时的风味特性有关。游离脂肪酸含量过高时,尤其是中链脂肪酸含量较高时,水解乳脂风味较差[29]。Urbach等[23]通过在模拟“黄油”体系中添加风味化合物的研究发现,C2~C10这些中短链游离脂肪酸在远高于阈值的浓度条件下,会给予“黄油”不良的风味,以丁酸为例,其含量在阈值附近时,“黄油”呈令人愉快的风味,随着含量的增加,风味呈腐败味。所以乳脂水解产物需要经过一些修饰才可以用于乳制品增香,Zhang Xiaomei等[30]研究发现,在乳脂水解产物中添加乙醇,利用脂肪酶酯化作用制备的酶解产物可使脱脂乳的风味改善。骆婕怡等[31]通过添加乳糖进行美拉德反应改善水解产物风味。
3 结 论
采用脂肪酶D、E及角质酶F、G水解引起乳脂酸值的变化不同。3 种乳脂经2 种脂肪酶及角质酶F水解后酸值增加较多,2 种黄油经角质酶G水解酸值无明显变化,稀奶油经角质酶G水解后酸值略有变化。3 种乳脂经脂肪酶D、脂肪酶E及角质酶F水解后挥发性化合物组成发生了明显的变化,游离脂肪酸总量增加;而δ-癸内酯及酮类化合物含量未明显增加,占比降低。丁酸、己酸、辛酸、癸酸是水解乳脂挥发性化合物中的主要物质。

