传统自然发酵酸肉中细菌群落多样性与风味品质分析
米瑞芳,陈 曦,,熊苏玥,戚 彪,李家鹏,,乔晓玲,王守伟,张立升
(1.中国肉类食品综合研究中心,肉类加工技术北京市重点实验室,北京 100068;2.北方工业大学理学院,北京 100144)
酸肉是将预处理后的原料肉切块或切片,加入盐、米粉等密封,自然发酵加工而成的传统发酵肉制品。酸肉历史悠久,主要产于贵州、湖南、云南、四川等地区,具有保质期长、风味独特、富含游离氨基酸和活性肽等特点,近年来越来越受到关注[1-4]。传统酸肉多为自然发酵,自然发酵可以网罗多种多样的微生物,赋予酸肉独特风味。酸肉生产所采取的工艺、环境条件和地区差异可以筛选和富集不同类型和代谢特征的菌群,但受气候、人为操作等因素影响,酸肉的品质稳定性难以得到保证。因此,了解酸肉中微生物群落结构组成是调控和提升产品品质的关键。
国内对传统自然发酵酸肉的微生物群落研究主要还是应用传统培养、分离、纯化以及进行一系列生理生化实验等手段[5-8],也有利用聚合酶链式反应-变性梯度凝胶电泳方法进行研究的报道[9]。基于宏基因组深度测序技术又称为高通量测序技术,具有检测通量高、准确度高、用时短等优点,已越来越多地应用于发酵食品微生物生态学研究。高通量测序不需要对微生物进行分离培养,就可以检测到低丰度的微生物,同时还能更加全面而准确地反映样品的微生物群落构成和多样性。在发酵肉制品中,近年来有一些关于应用高通量测序技术对发酵香肠微生物多样性的研究报道[10-12],然而目前尚鲜见利用该技术对传统发酵酸肉的细菌群落多样性进行研究的报道。
本研究采集云南地区4 种具有代表性工艺的传统酸肉样品,利用基于半导体测序技术的Ion S5 XL平台单端测序方法,评估酸肉中细菌群落结构和多样性;同时结合电子鼻和固相微萃取-气相色谱-质谱(solid phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)分析,揭示细菌群落结构与酸肉风味品质的关系,加深对酸肉发酵机制的认识,从而为传统产业的现代化改造和食品质量安全控制提供理论依据。
1 材料与方法
1.1 材料与试剂
4 种酸肉样品,分别采集自云南当地4 家不同的酸肉生产手工作坊。各样品均采集3 份,于-80 ℃保存备用。酸肉样品基本信息见表1。

表1 酸肉样品基本信息Table1 Information about sour meat samples tested in this study
细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;Taq酶 大连宝生物工程有限公司;C5~C20系列正构烷烃标准溶液 美国Sigma公司;氦气(>99.999%) 北京氦普北方气体工业有限公司。
1.2 仪器与设备
NanoDrop One超微量紫外-可见光分光光度计、Ion S5 XL测序仪、TG-Wax MS色谱毛细管柱(30 m×0.25 mm,0.25 µm)、1310型GC-TSQ 8000型三重四极杆MS联用仪 美国Thermo Scientific公司;Centrifuge 5417R冷冻离心机 德国Eppendorf公司;T100TMThermal Cycler型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;PEN3型便携式电子鼻传感器 德国Airsense公司;57330-U SPME手动进样器、50/30 µm聚二乙烯苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)SPME针 美国Supelco公司。
1.3 方法
1.3.1 细菌群落的高通量测序分析
取采集的酸肉样品各25 g,加入225 mL无菌生理盐水,均质拍打后4 ℃摇床振荡30 min,静置10 min后取上清液离心收集沉淀[13],采用细菌基因组DNA提取试剂盒提取微生物群落总DNA。DNA纯度(A260nm/A280nm、A260nm/A230nm)及浓度采用NanoDrop One超微量紫外-可见光分光光度计测定。每种酸肉做4 个平行重复,4 种酸肉共计16 个DNA样本送至北京诺禾致源股份有限公司,采用341F-806R为引物扩增细菌16S V3~V4区后,进行高通量测序文库的构建和基于Ion S5 XL平台的单端测序。测序数据经过处理后[14-15],利用Uparse软件以一致性97%作为标准划分操作分类单元(operational taxonomic units,OTUs),采用Silva数据库进行比对[16]。利用QIIME软件计算Alpha多样性指数并绘制基于Weighted UniFrac距离的非加权组平均(unweighted pair-group method with arithmetic means,UPGMA)法得到聚类树。
1.3.2 电子鼻检测分析
PEN3型电子鼻传感器含有10 种金属氧化物半导体型化学传感元件,每种传感元件对应的敏感物质类型不同[17]。准确称取2.0 g酸肉样品于顶空瓶中,加盖密封,利用PEN3型电子鼻传感器对酸肉样品进行检测。测定条件:顶空温度50 ℃;顶空时间300 s;进样流量300 mL/min;信号采集时间90 s;传感器清洗时间250 s。每个样品分别做5 次平行重复。利用Winmuster软件对电子鼻检测结果进行主成分分析(principal component analysis,PCA)并绘图。
1.3.3 挥发性风味物质测定分析
SPME条件:准确称取5.0 g酸肉样品于15 mL SPME小瓶中,置于50 ℃恒温水浴锅中预热平衡20 min,将经老化的50/30 µm DVB/CAR/PDMS萃取头插入小瓶,50 ℃萃取30 min 后,迅速将萃取头置于230 ℃进样口解吸5 min[18]。
GC条件:TG-Wax MS毛细管柱(30 m×0.25 mm,0.25 µm);载气为高纯氦气,氦气流速1 mL/min;进样口温度230 ℃。升温程序:参照Gutsche等[19]并略作修改,起始温度40 ℃,保持3 min;以10 ℃/min升至50 ℃;再以4 ℃/min升至120 ℃;最后以12 ℃/min升至230 ℃,保持5 min。
MS条件:电子电离源,离子源温度280 ℃;电子能量70 eV;质量扫描范围35~400 u,全扫描模式采集信号。
定性与定量分析:根据所得MS图,检索NIST数据库,结合C5~C20系列正构烷烃混标计算保留指数(retention indice,RI),对酸肉的挥发性组分进行定性分析,计算每种组分的平均含量[18]。
1.4 数据处理
利用SPSS 19软件进行显著性分析(P<0.05)和Pearson相关性分析(P<0.05),利用Sigmaplot 12.5软件进行柱形图绘制。
2 结果与分析
2.1 不同种类酸肉中细菌群落多样性分析
2.1.1 细菌群落的OTUs聚类分析

图1 测序数据统计Fig.1 Statistics of tags annotation in sour meat samples

图2 各样品中细菌的稀释曲线Fig.2 Rarefaction analysis of pyrosequencing reads for bacteria from sour meat samples
由图1可知,Y1、Y2、Y3和Y4样本所获得的细菌原始序列条数(总tags数)平均值分别为110 117、111 138、110 177 条和110 151 条,序列平均长度429 bp。如图2所示,所有样品的稀释曲线都已进入平台期,说明测序数据量合理,测序深度已基本覆盖样品中所有微生物,更多的数据量对发现新的OTUs边际贡献很小。其中Y4细菌的平均OTUs值显著高于其他3 个(P<0.05),达到187,而Y1、Y2、Y3之间无显著性差异,分别为146、149和145。其中4 种样品共有的细菌种类为112 个。
2.1.2 细菌群落的丰度分析

图3 基于加权UniFrac距离的UPGMA聚类树Fig.3 UPGMA cluster dendrogram of sour meat samples based on the Weighted UniFrac distance
如图3所示,4 种酸肉样品中主要存在11 个细菌类群,分别是厚壁菌门、变形菌门、放线菌门、蓝藻细菌、拟杆菌门、浮霉菌门、装甲菌门、疣微菌门、酸杆菌门等。4 种酸肉所含物种基本相似,主要优势菌是厚壁菌门、变形菌门和放线菌门。其中厚壁菌门占绝对优势,相对丰度分布为Y2(98.92%)>Y4(97.80%)>Y3(86.85%)>Y1(83.73%);其次是变形菌门,分别为Y1(15.70%)>Y3(11.30%)>Y4(1.58%)>Y2(0.32%);放线菌门分别为Y3(1.67%)>Y4(0.33%)>Y1(0.29%)>Y2(0.22%)。另外,通过聚类分析可知Y1和Y3距离最近,其微生物种类和数量最为相似,这可能与其工艺较为相似有关。

表2 酸肉样品中优势细菌菌属(前20)及其在各样品中的相对丰度Table2 Abundances of predominant bacteria (top 20) in four sour meat samples%
如表2所示,进一步对细菌群落中主要优势菌属(前20 位)进行分析。不同种类酸肉中细菌菌属结构存在一定差异。厚壁菌门中,乳杆菌属占绝对优势,在所有样品中的相对丰度为31.28%~74.27%,这与利用传统培养方法研究酸肉微生物群落的结果较为一致,例如李宗军等[8]在酸肉发酵过程中检测到的优势细菌是乳杆菌、片球菌、明串珠菌和微球菌等;周才琼等[20]在渝黔地区传统酸肉中检测到的优势细菌也是乳杆菌和片球菌;陈韵等[9]从贵州侗族发酵肉中检测到优势细菌为乳杆菌和葡萄球菌。在其他发酵肉制品例如发酵香肠中,利用高通量测序研究也发现乳杆菌是主要优势细菌,例如Quijada等[10]利用高通量测序技术研究干发酵香肠中的微生物群落,其中乳杆菌属占比为65.1%~92.0%;Fontana等[21]利用高通量测序技术研究骆驼肉发酵香肠中的乳酸菌群落,结果表明优势菌是乳杆菌属、明串珠菌属和假单胞菌属等。其次是魏斯氏菌属,Y4和Y2样品中相对丰度较高,分别为60.00%和17.93%,远高于Y1和Y3。乳球菌、片球菌、葡萄球菌等也是厚壁菌门中的优势菌属。变形菌门中,Y2和Y4中肠杆菌含量远低于Y1和Y3,而且未检出大肠埃希氏菌-志贺氏菌群(大肠埃希氏菌和志贺氏菌16S rDNA序列几乎完全一致,进一步区分需要生化及血清分型)。这可能与某些魏斯氏菌可产细菌素有关[22],从而保证酸肉的质量安全性。放线菌门和拟杆菌门中,各样品中大部分菌属的相对丰度都低于0.1%。
2.2 不同种类酸肉中挥发性风味物质分析
2.2.1 酸肉样品的整体风味分析

图4 利用电子鼻检测不同酸肉风味的PCA图Fig.4 PCA plot of volatile compounds in different sour meat samples distinguished by electronic nose
如图4所示,第1主成分和第2主成分的方差贡献率分别为89.35%和10.50%,总贡献率接近100%,可以代表酸肉样品的整体信息。图4中各组分析数据点均分布在各自的区域内,没有重叠现象,说明4 种传统发酵酸肉的挥发性气味有较大差异性。其中Y1和Y3的中心距离最小,说明Y1和Y3的整体风味差异最小,这与细菌群落的分析结果相符(图3)。
2.2.2 酸肉样品的挥发性风味物质种类及含量分析
由表3可知,利用SPME-GC-MS技术,在4 种酸肉样品Y1、Y2、Y3和Y4中分别检测到52、53、37 种和73 种挥发性风味物质,共计126 种。主要包括酸类14 种、醇类28 种、醛类14 种、酯类24 种、酮类12 种、萜烯类15 种、含硫/含氮类8 种和芳香族类11 种。仅在其中1 种酸肉样品中检测到的挥发性物质有77 种,占总挥发性物质种类的61.1%,包括酸类7 种、醇类18 种、醛类11 种、酯类11 种、酮类10 种、萜烯类10 种、含硫/含氮类6 种、芳香族类4 种,说明云南地区传统酸肉的挥发性物质组成结构差异较大,风味较为多样化。余冰等[23]从侗族酸肉中检测到48 种挥发性物质,酯、醛、醇、烷烃和其他杂环化合物分别为13、11、6、5、13 种;周才琼等[24]从渝黔苗汉杂居地区传统酸肉中检测到85 种挥发性物质,酯、醛、醇、酚酸和碳氢化合物分别为23、23、9、3、27 种;张倩等[2]从贵州酸肉中检测到34 种挥发性物质,酸、醛、烷烃、烯、酯和醇类物质分别为15、11、1、1、3、3 种;黄群等[25]在传统湘西酸肉中检测到酯、醛、醚、醇、烃和其他杂环化合物分别有5、3、2、9、19、5 种,共计43 种。这些研究报道进一步表明,不同地区和工艺制作的酸肉具有各自独特的风味。
如图5所示,可在2 种或2 种以上酸肉中检测到的挥发性物质有49 种,其中酸类、醇类和酯类在不同酸肉样品之间具有较大差异。例如乙酸、辛酸、癸酸在Y4样品中的含量显著高于其他3 个样品(P<0.05),张倩等[2]在贵州酸肉中也检测到了这3 种物质,但其检测到的其他酸类物质如油酸、亚油酸、硬脂酸、棕榈酸,在本实验样品中并未检测到。醇类物质中含量差异显著的主要有乙醇、正己醇、顺-3-己烯-1-醇、1-辛烯-3-醇和苯乙醇,其中乙醇在4 个样品中的含量都较高,样品Y4的乙醇含量显著高于其他3 个样品(P<0.05)。乙醇、正己醇、1-辛烯-3-醇(蘑菇香、水果香)、苯乙醇(玫瑰香、甜香)均在侗族酸肉中报道过,且苯乙醇是侗族酸肉的主体风味成分之一[23],而顺-3-己烯-1-醇首次在酸肉中发现。酯类物质中,不同样品间差异显著的包括己酸乙酯(果香、酒香)、庚酸乙酯(青香、果香)、乳酸乙酯(果香)、辛酸乙酯(花香、水果香)和癸酸乙酯(蜂蜜香、玫瑰香)等,其中己酸乙酯、乳酸乙酯在Y4样品中含量均为最高,Y1和Y3次之。据报道,己酸乙酯和辛酸乙酯是侗族酸肉的主体风味物质[23],癸酸乙酯是渝黔苗汉杂居地区传统酸肉的主体风味物质[24],这些乙酯类物质通常能够赋予产品果香味和酒香味[26],对酸肉的风味品质形成具有重要贡献。

图5 不同酸肉中各挥发性风味化合物的种类数Fig.5 Number of volatile compounds belonging to each chemical class in different sour meat samples
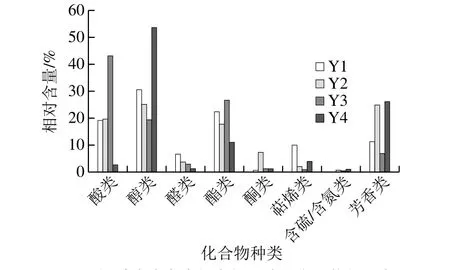
图6 不同酸肉中各类挥发性风味化合物的相对含量Fig.6 Relative percentages of each class of volatile compounds in different sour meat samples
另外,本实验中检测到的芳樟醇、α-松油醇、茴香脑、右旋萜二烯、3-蒈烯、1-石竹烯、大根香叶烯等化合物是八角茴香和花椒的主要成分,在Y2和Y4样品中的含量较高,可能与不同酸肉制作时采用的工艺配方有关。如图6所示,4 种酸肉样品中检测到的醛类、酮类、含硫/含氮化合物的相对含量都较低,Y2和Y3中检测到少量的二甲基三硫化物,二甲基三硫化物具有令人不愉快的味道,含量过高可能会影响产品风味[27];Y4样品中还检测到吡嗪类含氮化合物,吡嗪类化合物主要呈现出豆豉、坚果风味[28],这是首次在酸肉中检测到该类化合物。
2.2.3 酸肉挥发性风味物质与微生物的关系
如表3所示,4 种酸肉样品中的主要酸类物质均为乙酸,而优势微生物均为乳杆菌、魏斯氏菌等乳酸菌(表2)。乳酸菌对发酵肉制品风味的贡献主要是通过分解代谢碳水化合物、氨基酸等产生有机酸[29-30]。其中Y4样品的总酸含量显著高于其他3 个样品(P<0.05),这可能是由于Y4中某些细菌(例如魏斯氏菌)具有较强的产酸能力[31],大大提高了该样品中有机酸例如乙酸、辛酸、癸酸的含量(均与其他3 个样品差异显著,P<0.05),同时相关性分析表明乙酸与魏斯氏菌呈极显著正相关(Pearson相关系数0.995,P<0.01)。
由图5、6可知,所有酸肉样品中醇类和酯类物质的种类数和相对含量都较高。这可能是由于细菌对碳水化合物的代谢和脂质氧化可产生并不断积累醇类物质,例如异型发酵的乳酸菌可产生乙醇,而有研究表明乳酸菌也会影响发酵香肠的脂肪氧化速率[32]。所有酸肉样品中的酯类物质均以乙酯类为主,乙酯类物质占酯类物质的85%以上,而有研究报道成熟发酵香肠中的酯类物质也以乙酯类为主[33]。由于原料猪肉中的酯类物质含量较低,且以甲酯类为主[34-35],因此酸肉中酯类物质的形成主要与发酵相关。本实验中检测到的乙酯类物质主要有乳酸乙酯、乙酸乙酯、己酸乙酯、庚酸乙酯、辛酸乙酯和癸酸乙酯等。乳杆菌在酸肉中占绝对优势地位,其代谢产物乳酸是形成乳酸乙酯及其他香味成分的重要物质基础[36];明串珠菌可利用碳水化合物进行异型发酵产生D型乳酸和乙酸,分别是乳酸乙酯和乙酸乙酯的前体物[37]。Y4样品中的乙醇含量显著高于其他3 个样品(P<0.05),醇与酸反应生成酯类,这可能是Y4样品中己酸乙酯、庚酸乙酯、乳酸乙酯、辛酸乙酯、2-羟基-4-甲基戊酸乙酯、癸酸乙酯等乙酯类物质都显著高于其他3 个样品的原因。另外,样品Y1和Y3中,己酸乙酯、乳酸乙酯、2-羟基-4-甲基戊酸乙酯等均无显著性差异,这可能是由于这2 种酸肉制作工艺较为类似,导致其微生物群落结构较为相似(图3)。

续表3

续表3
3 结 论
本研究运用高通量测序技术对采集的4 种传统发酵酸肉的细菌群落进行检测。结果表明传统发酵酸肉中细菌多样性丰富,包含11 个门,其中厚壁菌门占绝对优势,约占总细菌群落的83.73%~98.92%,其次是变形菌门和放线菌门。主要优势菌属为乳杆菌属、魏斯氏菌属和乳球菌属。与传统分离培养方法相比,高通量测序具有检测通量高、准确度高、用时少等优点。同时,利用SPME-GC-MS,从酸肉样品中检测到酸类、醇类、醛类、酯类、酮类、萜烯类等挥发性风味化合物共9 大类126 种。结果表明4 种酸肉样品之间的菌属种类和相对丰度均存在一定的差异性,同时酸肉样品中的风味物质在种类和含量上也存在较大差异性。结果表明乳杆菌、魏斯氏菌等微生物,可能影响酸肉中醇类、酯类和酸类挥发性风味物质,从而影响酸肉的风味品质。本研究结果为深入了解传统自然发酵酸肉的微生物群落与风味的相关性、开发酸肉专用细菌剂提供数据支撑和参考依据。

