酒酒球菌(Oenococcus oeni)耐酸突变株苹果酸-乳酸发酵能力分析
谢昉书,文向圆,刘树文,2,3,
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100;3.陕西省合阳葡萄试验示范站,陕西 渭南 715300)
苹果酸-乳酸发酵可以降低葡萄酒的酸度和色度,增加细菌学稳定性及改善葡萄酒的香气,因此,它是酿造优质葡萄酒的必需工艺环节[1]。在乙醇发酵结束之后葡萄酒的生境极其恶劣和复杂,低pH值、高乙醇体积分数和高SO2等均会抑制乳酸菌的生长和代谢,而酒酒球菌可以适应这种环境[2],因此,它成为苹果酸-乳酸发酵过程中重要的菌种[3-5]。
在苹果酸-乳酸发酵过程中,酒酒球菌可以将葡萄酒中具有酸涩感的L-苹果酸分解为L-乳酸,使葡萄酒更加柔和圆润。Bronwen等[6]研究发现,低pH值和高乙醇含量对植物乳杆菌的降酸能力起到抑制作用。葡萄酒的香气是衡量葡萄酒品质最为重要的指标之一[7]。萜烯类化合物具有浓郁的香味,是构成葡萄酒香气的主要物质,其主要以无味的糖苷结合态存在于葡萄酒中[6,8]。糖苷酶可以酶解香气前体物质以增加葡萄酒香气的复杂性,其中β-葡萄糖苷酶是改善葡萄酒香气的关键酶[9]。乳酸菌特别是酒酒球菌具有较高的β-葡萄糖苷酶活性,可以促进香气前体物的分解,对增加葡萄酒香气复杂性具有重要意义[10-13]。酒酒球菌对葡萄酒感官品质的影响具有菌株差异性[14-15],低pH值、高乙醇体积分数、高SO2环境都会对酒酒球菌的糖苷酶活性产生影响。因此,酒酒球菌在葡萄酒生境中的抗胁迫能力及糖苷酶的活性,直接影响苹果酸-乳酸发酵的启动、完成及葡萄酒的感官品质[16]。目前研究多是针对胁迫环境对酒酒球菌的降酸能力或β-葡萄糖苷酶活性的影响,但从酒酒球菌的生长能力、降酸能力和β-葡萄糖苷酶活性3 个方面评价其苹果酸-乳酸发酵能力的研究鲜少报道。
本研究通过分析单因素胁迫环境(pH值、乙醇体积分数和L-苹果酸)、复合因素胁迫环境和模拟酒环境对耐酸突变菌株[17]的生长能力、降酸能力和β-葡萄糖苷酶活性的影响,旨在全面评价耐酸突变菌株苹果酸-乳酸发酵的能力,为耐酸突变菌株成为商业发酵剂提供技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
酒酒球菌SX-1b[18]、商业菌株31-DH[19]保藏于西北农林科技大学葡萄酒学院;陈其玲等[17]对SX-1b进行离子注入诱变,经过分离纯化后筛选出的耐酸突变菌株b1。
1.1.2 培养基与试剂
ATB液体培养基(1 L):葡萄糖10 g,蛋白胨10 g,酵母浸粉5 g,MgSO4·7H2O 0.2 g, MnSO4·4H2O 0.05 g,盐酸半胱氨酸 0.5 g,番茄汁250 mL,pH 4.8。
模拟酒培养基(1 L):无水乙醇100 mL(培养基乙醇体积分数10%),葡萄汁10 g,L-苹果酸3 g,D-葡萄糖2 g,D-果糖2 g,CaCl20.13 g,KCl 0.45 g,(NH4)2SO41 g,CH3COONa 2 g,KH2PO40.6 g,MgSO4·7H2O 0.2 g,MnSO40.05 g,酵母浸粉4 g, pH 3.4。110 ℃灭菌10 min,待模拟酒培养基温度降至常温水平再添加100 mL无水乙醇。
对硝基苯酚-β-D-葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG) 美国Sigma公司;L-苹果酸检测试剂盒 爱尔兰Megazyme公司;其他均为分析纯试剂。
1.2 仪器与设备
SW-CJ-1超净工作台 中国苏州安泰空气技术有限公司;SX-500高压蒸汽灭菌锅 日本Tomy公司;SHP-250生化培养箱 上海森信实验仪器有限公司;Cary60紫外分光光度计 安捷伦科技(中国)有限公司;Orion Star A111 pH计 美国Thermo Scientif i c公司。
1.3 方法
1.3.1 菌株的生长能力
1.3.1.1 菌株生长曲线绘制
将菌株于ATB液体培养基中26 ℃静置培养,活化2 次后以4%的接种量接种于单因素胁迫培养基中培养,绘制菌株生长曲线。
1.3.1.2 菌株生长量的测定
将菌株于ATB液体培养基中26 ℃静置培养,活化2 次后以4%接种量接种于正交条件的培养基中,测定OD600nm,在26 ℃静置培养120 h后再次测定OD600nm,以两次测定的差值(ΔOD600nm)衡量实验菌株的生长。
1.3.2 L-苹果酸含量的测定
按照L-苹果酸检测试剂盒的方法进行测定。
1.3.3 β-葡萄糖苷酶样品制备及活性测定
取对数生长中期(OD600nm=1.0)菌液各1 mL,9 000 r/min离心10 min收集菌体,加入0.85% NaCl溶液洗涤2 次,并悬浮于0.5 mL 0.85% NaCl溶液。
β-葡萄糖苷酶活力测定参照Barbagallo等[20]的方法并略作修改。反应体系(3 mL):在上述的悬浮液中加入0.5 mL的柠檬酸磷酸缓冲液和p-NPG混合液(pH 5.0,p-NPG浓度5 mmol/L),于37 ℃反应1 h,立即加入2 mL的1.0 mol/L Na2CO3溶液终止反应。10 000 r/min离心20 min,取上清液并使用全波长酶标仪测定400 nm波长处的吸光度。空白样品是使用0.85% NaCl缓冲溶液代替菌悬浮液,其他处理与样品相同。菌体干质量的计算如下式所示:

式中:A600nm为菌液在600 nm波长处的吸光度;2.616 8为固定系数。
β-葡萄糖苷酶活力定义为以p-NPG为底物,每克菌体(干质量)每分钟水解该底物生成对硝基苯酚(p-nitrophenol,p-NP)的量(μmol/(g·min))。标准曲线由不同浓度(10~60 μmol/L)p-NP溶液在400 nm波长处比色获得。回归方程为y=0.008 6x+0.002 7,R2=0.999 4,线性关系良好,满足实验需求。
1.3.4 单因素胁迫环境对菌株抗胁迫能力的影响
1.3.4.1 pH值的影响
将3 g/L的L-苹果酸添加到ATB液体培养基,并将培养基的pH值分别调节为3.0、3.2、3.4、3.6和3.8。以4%接种量接种于不同pH值的液体培养基中,测定生长曲线、L-苹果酸含量及β-葡萄糖苷酶活性。
1.3.4.2 乙醇体积分数的影响
将3 g/L的L-苹果酸添加到ATB液体培养基,并使培养基的乙醇体积分数分别为8%、10%、12%和14%,pH值为4.8,以4%接种量接种于含有不同乙醇体积分数的液体培养基中,测定生长曲线、L-苹果酸含量及β-葡萄糖苷酶活性。乙醇体积分数8%接近葡萄酒最低值7%,葡萄酒乙醇体积分数一般为10%~14%。
1.3.4.3 L-苹果酸的影响
将1、2、3、4 g/L的L-苹果酸分别添加到ATB液体培养基,pH值为4.8,以4%接种量接种于含有不同L-苹果酸质量浓度的液体培养基中,测定生长曲线、L-苹果酸含量及β-葡萄糖苷酶活性。
1.3.5 复合因素胁迫环境对菌株抗胁迫能力的影响
葡萄酒的高酸和高乙醇体积分数环境对酒酒球菌的生长和苹果酸-乳酸发酵具抑制作用,L-苹果酸是葡萄酒中重要的有机酸,对酒酒球菌的生长和降酸能力具有影响,因此,选择pH值、乙醇体积分数和L-苹果酸作为正交试验因素,采用L9(34)正交试验设计,确定正交试验因素影响程度及最优组合。
1.3.6 模拟酒环境下菌株的苹果酸-乳酸发酵能力
按照1.1.2节配制模拟酒培养基,并使模拟酒培养基的乙醇体积分数分别为10%、12%和14%,pH值为3.4,以4%接种量接种于模拟酒中,培养到一定时期,按照1.3.3节方法测定β-葡萄糖苷酶活性,并且每天按照1.3.2节方法测定L-苹果酸的含量。
1.4 数据处理
采用SPSS 20.0分析软件(上海卡贝信息技术有限公司)对实验结果进行分析。
2 结果与分析
2.1 单因素胁迫环境对菌株抗胁迫能力的影响
2.1.1 pH值对菌株抗胁迫能力的影响
2.1.1.1 pH值对菌株生长能力的影响

图1 菌株SX-1b(a)、耐酸突变株b1(b)和商业菌株31-DH(c)在不同pH值条件下的生长曲线Fig.1 Growth curves of SX-1b (a), b1 (b) and 31-DH (c) under different pH values
由图1可知,菌株SX-1b、b1和31-DH在稳定期的生长量随着pH值降低而降低,当pH值为3.0时,b1的生长量高于SX-1b和31-DH。在不同pH值条件下菌株的生长曲线可为之后L-苹果酸降解速率的测定提供时间依据。结果表明,pH值对菌株的生长具有抑制作用。但菌株b1在低pH值(3.0)下具有较强的生长能力。Tourdot-Maréchal等[21]研究发现,当pH值为3.2时,酒酒球菌的生长受到严重抑制。葡萄酒的pH值一般为3.0~3.4,酒酒球菌能否在葡萄酒的高酸环境中生长繁殖对苹果酸-乳酸发酵的启动具有重要意义。经过研究发现,低pH值将会引起酒酒球菌细胞膜结构和成分的变化,使菌株的生长受到抑制[22-23],但陈其玲等[17]采用离子注入诱变,分离纯化后获得的菌株b1表现出良好的抗酸胁迫能力,这有可能是离子注入诱变使与细胞膜结构有关的基因发生突变。
2.1.1.2 pH值对菌株L-苹果酸降解速率的影响

图2 pH值对L-苹果酸降解速率的影响Fig.2 Effect of pH on the degradation rate of L-malic acid
将菌株接种于不同培养基培养120 h,测定L-苹果酸含量。当菌株的培养时间相同时,菌株的L-苹果酸降解量越高则其L-苹果酸降解速率越高。因此,以菌株在120 h时苹果酸的降解量表示L-苹果酸降解速率。由图2可知,菌株SX-1b、b1和31-DH的L-苹果酸降解量随着pH值降低而降低,即低pH值对菌株L-苹果酸降解速率具有抑制作用。当pH值为3.0时,b1保持较高的苹果酸降解量,为1.978 6 g/L,是SX-1b的1.34 倍,是31-DH的1.18 倍。
苹果酸乳酸酶是苹果酸-乳酸发酵过程中的关键酶[24],因此,其活性将会影响菌株L-苹果酸降解速率。研究发现,对于发酵速率较快的菌株,其苹果酸乳酸酶基因(mleA)的转录水平较高[25]。经过离子注入诱变,SX-1b的mleA可能发生突变,从而影响苹果酸乳酸酶活性和mleA的表达。
2.1.1.3 pH值对菌株β-葡萄糖苷酶活性的影响

图3 pH值对β-葡萄糖苷酶活性的影响Fig.3 Effect of pH on β-glycosidase activity
以p-NPG为底物,在37 ℃条件下反应1 h,测定菌株SX-1b、b1和31-DH的β-葡萄糖苷酶活性。由图3可知,在不同pH值条件下,菌株SX-1b、b1和31-DH均具有β-葡萄糖苷酶活性,且β-葡萄糖苷酶活性具有菌株差异性,这与之前的研究结果基本一致[26-27]。菌株β-葡萄糖苷酶活性随着pH值降低而降低。当pH 3.0时,SX-1b和31-DH的β-葡萄糖苷酶活性受到强抑制作用,但b1受到的抑制作用较小,β-葡萄糖苷酶活性为8.610 0 μmol/(g·min),是SX-1b的6.64 倍,是31-DH的1.62 倍,这与陈其玲等[17]的研究基本一致。当pH 3.8时,SX-1b保持较高的β-葡萄糖苷酶活性。
大部分酒酒球菌β-葡萄糖苷酶的最适pH值为5.0[28],当pH值降到3.5时,β-葡萄糖苷酶活性急剧降低[20],且Michlmayr等[29]研究发现,在葡萄酒pH值(3.0~4.0)条件下,短乳杆菌β-葡萄糖苷酶活性很低,由此可知低pH值对菌株的β-葡萄糖苷酶具有抑制作用[20]。与杨芮等[28]研究结果相比较,菌株b1在低pH值条件下保持较高的β-葡萄糖苷酶活性。
2.1.2 乙醇体积分数对菌株抗胁迫能力的影响
2.1.2.1 乙醇体积分数对菌株生长能力的影响

图4 菌株SX-1b(a)、耐酸突变株b1(b)和商业菌株31-DH(c)在不同乙醇体积分数下的生长曲线Fig.4 Growth curves of SX-1b (a), b1 (b) and 31-DH (c) at different alcohol concentrations
由图4可知,菌株SX-1b、b1和31-DH在稳定期的生长量随着乙醇体积分数增加而降低,即乙醇对各菌株的生长均具有强抑制作用。当乙醇体积分数为14%时,在稳定期生长量最高的为菌株b1。
2.1.2.2 乙醇体积分数对菌株L-苹果酸降解速率的影响

图5 乙醇体积分数对L-苹果酸降解速率的影响Fig.5 Effect of alcohol concentration on the degradation rate of L-malic acid
由图5可知,菌株SX-1b、b1和31-DH的L-苹果酸降解量随着乙醇体积分数增加而降低,即乙醇对菌株L-苹果酸降解速率具有抑制作用。但b1的L-苹果酸降解量均高于其余菌株。当乙醇体积分数为14% 时,菌株b1的L-苹果酸降解量为1.717 7 g/L,分别是SX-1b和31-DH的1.36 倍和1.05 倍。
Miller等[30]研究发现,乙醇对植物乳杆菌mleA的表达具有抑制作用。Wang等[24]研究发现,当乙醇体积分数大于4% 时,随着乙醇体积分数的增加,酒酒球菌SD-2a的苹果酸乳酸酶活性显著降低。经过离子注入诱变,SX-1b的mleA发生突变,可能提高了菌株mleA的表达和苹果酸乳酸酶的活性。
2.1.2.3 乙醇体积分数对菌株β-葡萄糖苷酶活性的影响

图6 乙醇体积分数对β-葡萄糖苷酶活性的影响Fig.6 Effect of alcohol concentration on β-glycosidase activity
由图6可知,菌株SX-1b、b1和31-DH的β-葡萄糖苷酶活性随着乙醇体积分数增加显著降低,这与之前的研究结果一致[20]。葡萄酒的乙醇体积分数一般为12%~14%,在该条件下,菌株b1保持较高的β-葡萄糖苷酶活性。当乙醇体积分数为14%时,β-葡萄糖苷酶活性最高的为菌株b1(1.597 5 μmol/(g·min)),分别是SX-1b和31-DH的1.09 倍和1.07 倍。
2.1.3 L-苹果酸对菌株抗胁迫能力的影响
2.1.3.1 L-苹果酸对菌株生长能力的影响
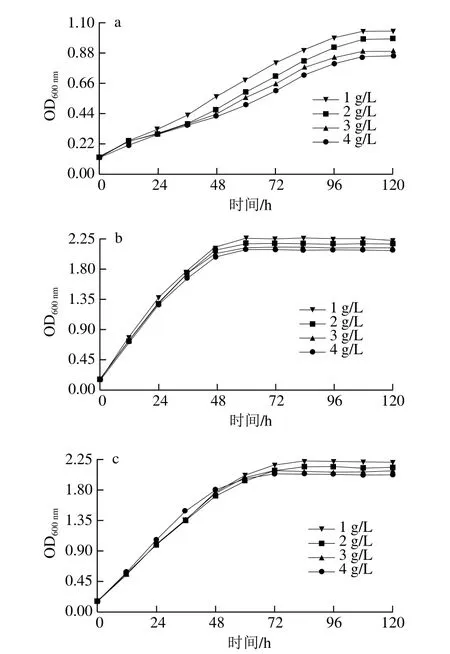
图7 菌株SX-1b(a)、耐酸突变株b1(b)和商业菌株31-DH(c)在不同L-苹果酸质量浓度下的生长曲线Fig.7 Growth curves of SX-1b (a), b1 (b) and 31-DH (c) under different concentrations of L-malic acid
由图7可知,菌株SX-1b、b1和31-DH在稳定期的生长量随着L-苹果酸质量浓度增加而降低。当L-苹果酸质量浓度为3 g/L时,菌株b1在稳定期的生长量高于SX-1b和31-DH。
2.1.3.2 L-苹果酸对菌株L-苹果酸降解速率的影响

图8 L-苹果酸质量浓度对L-苹果酸降解速率的影响Fig.8 Effect of L-malic acid concentration of on the degradation rate of L-malic acid
由图8可知,菌株SX-1b、b1和31-DH的L-苹果酸降解量随着L-苹果酸质量浓度增加而增加,即L-苹果酸对菌株的L-苹果酸降解速率具有促进作用。葡萄酒中L-苹果酸质量浓度一般为3 g/L,在此质量浓度下,L-苹果酸降解量最高的为菌株b1(2.846 9 g/L),分别是SX-1b和31-DH的1.19 倍和1.12 倍。
2.1.3.3 L-苹果酸对菌株β-葡萄糖苷酶活性的影响

图9 L-苹果酸质量浓度对β-葡萄糖苷酶活性的影响Fig.9 Effect of L-malic acid concentration on β-glycosidase activity
由图9可知,菌株SX-1b、b1和31-DH的β-葡萄糖苷酶活性随着L-苹果酸质量浓度增加而降低。L-苹果酸对SX-1b和31-DH的β-葡萄糖苷酶活性抑制作用较强,对b1的β-葡萄糖苷酶活性抑制作用较小。当L-苹果酸质量浓度小于3 g/L时,菌株SX-1b和31-DH的β-葡萄糖苷酶活性较高,当L-苹果酸质量浓度大于3 g/L时,菌株b1表现出较高的β-葡萄糖苷酶活性。当L-苹果酸质量浓度为3 g/L时,菌株b1的β-葡萄糖苷酶活性高于其余菌株,为6.823 8 μmol/(g·min),分别是SX-1b和31-DH的1.16 倍和1.06 倍。
2.2 复合因素胁迫环境对菌株抗胁迫能力的影响
2.2.1 复合因素胁迫环境对菌株生长能力的影响

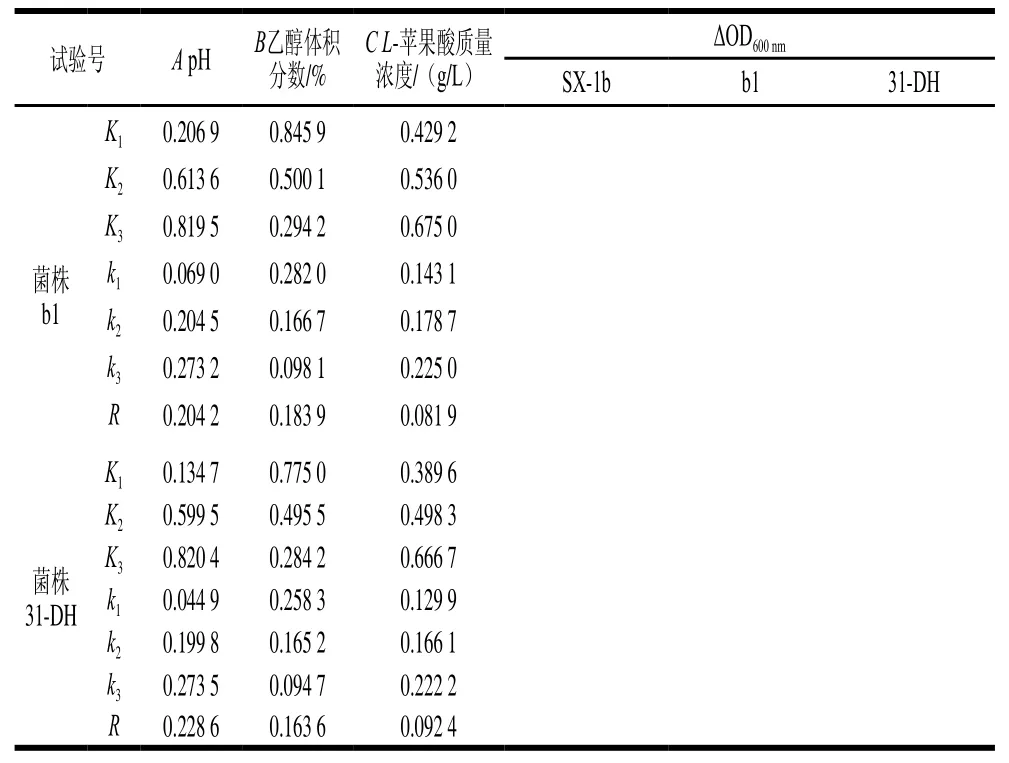
表1 正交试验条件对酒酒球菌ΔOD600 nm的影响Table1 Orthogonal array design with ΔOD600 nm values of three Oenococcus oeni strains
续表1

表2 ΔOD600 nm正交试验方差分析结果Table2 Analysis of variance for the effect of variables on ΔOD600 nm
由表1可知,ΔOD600nm与单因素胁迫试验结果相差较大。pH值、乙醇体积分数和L-苹果酸对菌株的生长均具有抑制作用,因此,在3个胁迫因素协同作用下,对菌株生长的抑制作用将会显著增强。影响菌株生长因素的主次顺序均为pH值>乙醇体积分数>L-苹果酸质量浓度。由K值可以确定最优组合为A3B1C3,即pH 3.8、乙醇体积分数10%、L-苹果酸质量浓度4 g/L。
SPSS 20.0统计软件对试验结果进行方差分析,由表2可知,对于菌株b1,因素A和B有显著性差异(P<0.05)。对于菌株31-DH,因素A有显著性差异(P<0.05)。
2.2.2 复合因素胁迫环境对菌株L-苹果酸降解速率的影响
由表3可知,影响菌株SX-1b、b1和31-DH的L-苹果酸降解速率因素的主次顺序均pH值>乙醇体积分数>L-苹果酸。由K值可以确定最优组合为A3B1C3,即pH 3.8、乙醇体积分数10%、L-苹果酸质量浓度4 g/L。用SPSS 20.0统计软件对试验结果进行方差分析,由表4可知,因素A、B和C没有显著性差异。

表3 正交试验条件对L-苹果酸降解速率的影响Table3 Orthogonal array design with L-malic acid degradation rates of three O. oeni strains

表4 L-苹果酸降解速率正交试验方差分析结果Table4 Analysis of variance for the effect of variables on L-malic acid degradation rate
2.2.3 复合因素胁迫环境对菌株β-葡萄糖苷酶活性的影响
由表5可知,影响菌株SX-1b、b1和31-DH的β-葡萄糖苷酶活性因素的主次顺序均为pH值>乙醇体积分数>L-苹果酸质量浓度。由K值可以确定最优组合为A3B1C3,即pH 3.8、乙醇体积分数10%、L-苹果酸质量浓度4 g/L。用SPSS 20.0统计软件对试验结果进行方差分析,由表6可知,对于菌株31-DH,因素A有显著性差异(P<0.05)。

表5 正交试验条件对β-葡萄糖苷酶活性的影响Table5 Orthogonal array design with β-glycosidase activity of three O. oeni strains
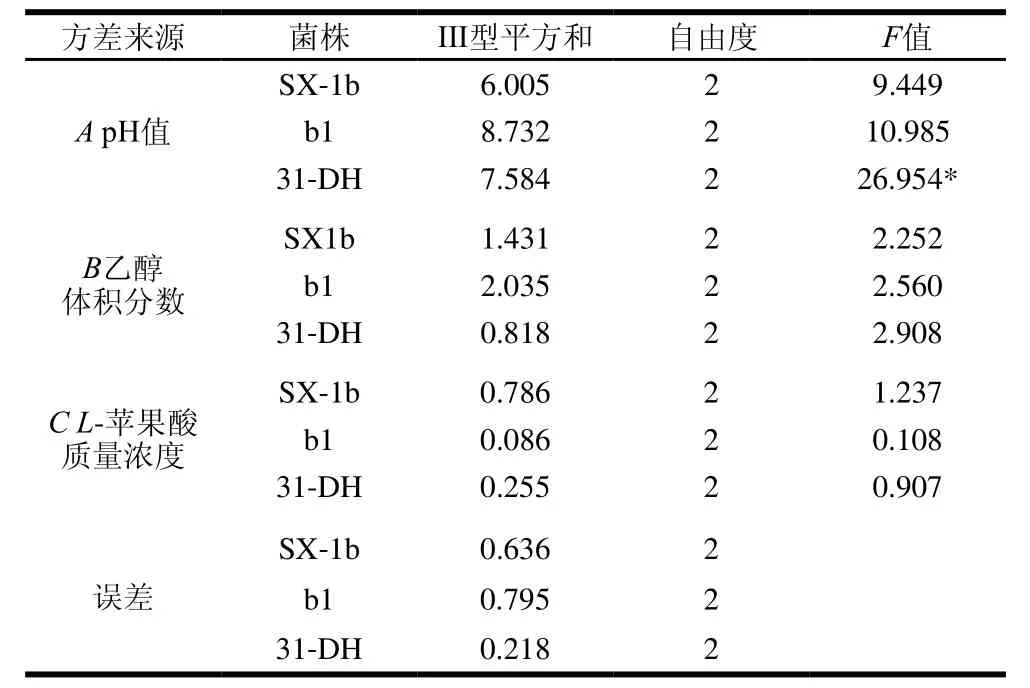
表6 β-葡萄糖苷酶活性正交试验方差分析结果Table6 Analysis of variance for the effect of variable on β-glycosidase activity
2.3 模拟酒环境下菌株的苹果酸-乳酸发酵能力
2.3.1 模拟酒环境下菌株的L-苹果酸降解速率

图10 模拟酒中乙醇体积分数10%(a)、12%(b)和14%(c)条件下的L-苹果酸降解速率Fig.10 Effect of alcohol concentration (10% (a), 12% (b) and 14% (c))of model wine on the degradation rate of L-malic acid
为进一步探究菌株b1的苹果酸-乳酸发酵能力,将生长至对数生长期(OD600nm=1.0)菌株接种于含有不同乙醇体积分数(10%、12%和14%)的模拟酒中,在20 ℃培养12 d,每天测定L-苹果酸含量,以菌株的累积L-苹果酸降解量表示L-苹果酸降解速率。由图10可知,在模拟酒环境中,各菌株均具有L-苹果酸降解能力,随着乙醇体积分数的增加,菌株累积L-苹果降解量显著降低,即菌株L-苹果酸降解速率随着乙醇体积分数增加而降低。由图10c可知,当模拟酒的乙醇体积分数为14%时,菌株SX-1b和31-DH在模拟发酵初期受到严重的抑制作用,菌株b1受到的抑制作用较小,因此,菌株b1可以快速适应高乙醇体积分数的环境;当模拟发酵至第12天时,菌株b1累积L-苹果酸降解量最高,为1.493 2 g/L,分别是菌株SX-1b与31-DH的1.41 倍和1.26 倍。
2.3.2 模拟酒环境下菌株的β-葡萄糖苷酶活性
由图11可知,在模拟酒环境中,随着乙醇体积分数增加,各菌株β-葡萄糖苷酶活性均降低。在不同乙醇体积分数条件下,菌株b1的β-葡萄糖苷酶活性均高于SX-1b。当乙醇体积分数大于12% 时,菌株b1的β-葡萄糖苷酶活性较SX-1b和31-DH高。因此,在高乙醇体积分数的葡萄酒中,b1表现出较高的β-葡萄糖苷酶活性。

图11 模拟酒中乙醇体积分数对酒酒球菌β-葡萄糖苷酶活性的影响Fig.11 Effect of alcohol concentration of model wine on β-glycosidase activity
结果表明,在模拟酒环境中,乙醇对菌株L-苹果酸降解速率和β-葡萄糖苷酶活性均具有抑制作用。当乙醇体积分数为14%时,菌株b1的L-苹果酸降解速率和β-葡萄糖苷酶活性均高于其余菌株,因此,耐酸突变菌株b1具有开发为商业发酵剂的潜能。
3 结 论
本研究通过对耐酸突变菌株b1生长能力、L-苹果酸降解速率和β-葡萄糖苷酶活性的研究发现,b1表现出良好抗胁迫能力和苹果酸-乳酸发酵能力,具有成为商业发酵剂的潜能。结果表明低pH值、高乙醇体积分数对菌株的生长能力、L-苹果酸降解速率和β-葡萄糖苷酶活性均具有抑制作用,L-苹果酸对其生长能力和β-葡萄糖苷酶活性具有抑制作用,对L-苹果酸降解速率具有促进作用。当单因素胁迫环境分别为pH 3.0、乙醇体积分数14%和L-苹果酸质量浓度3 g/L时,b1的L-苹果酸降解速率和β-葡萄糖苷酶活性均高于其余菌株。正交试验进一步确定各因素对菌株生长能力、L-苹果酸降解速率和β-葡萄糖苷酶活性的影响程度为:pH值>乙醇体积分数>L-苹果酸。当模拟酒的乙醇体积分数为14% 时,菌株b1的累积L-苹果酸降解量为1.493 2 g/L,分别是SX-1b与31-DH的1.41 倍和1.26 倍,且菌株b1的β-葡萄糖苷酶活性高于其余菌株。在后续的研究中,可将菌株b1接种于葡萄酒中进行苹果酸-乳酸发酵,进一步探究其L-苹果酸降解能力及其对葡萄酒香气的影响。

