1 株水蜜桃采后病害拮抗细菌的鉴定及抑菌作用
李培中,许 丽,何惠霞,尹京苑,高海燕,
(1.上海大学生命科学学院,上海 200444;2.上海应用技术大学,上海 201418;3.上海佳迈农业技术服务有限公司,上海 201300;4.上海大学计算机工程与科学学院,上海 200444)
水蜜桃作为一种常见的水果,其味甜汁多,营养丰富,深受广大消费者的喜爱,目前主产于华东地区。由于水蜜桃属于典型的呼吸跃变型水果,贮藏期间会出现严重的失水、硬度下降、果肉褐变等问题,同时,其采收多集中在高温多雨的7、8月份,极易受真菌感染,故耐贮性差,因此水蜜桃的采后保鲜一直是影响果农收入的主要问题[1]。先前已有报道若干病原真菌可导致采后桃果实发病,例如:交链孢霉(Alternaria alternata)[2]、桃褐腐菌(Monilinia fructicola)[3]、复端孢霉(Cephalothecium sp.)与丝核菌(Rhizoctonia sp.)[4]等。
对于水蜜桃采后病害的防治,目前仍以化学杀菌剂为主,但防效不甚理想,而且长期使用化学杀菌剂不但会导致病菌产生抗药性,同时在食品安全及生态环境方面也会导致一系列严重的负面后果[5]。为克服这些问题,急需一种对环境友好且性价比高的方法,而生物防治则可以满足这些需求[6]。生物防治中主要应用的是微生物防治,是指将拮抗微生物或其代谢产物作用于果体,与致病菌产生拮抗作用,从而抑制致病菌的生长,防止由致病菌引起的腐烂,从而达到保鲜目的[7]。在水蜜桃采后保鲜的拮抗微生物中,已报道的有罗伦隐球酵母(Cryptococcus laurentii)[8]、荧光假单胞杆菌(Pseudomonas fl uorescens)[9]、芽孢杆菌(Bacillus spp.)[10-13]等。
本实验室前期研究从豆腐乳中分离得到了1 株对水蜜桃采后病害具有较好防治效果的生防菌株,将其编号为CF-2。本研究旨在通过形态学、生理生化、分子生物学等方法对生防菌株CF-2进行鉴定,并探究其生物学特性及对水蜜桃采后病原真菌的抑制作用,以期为进一步研究利用生物防治方法提供参考,为解决水蜜桃采后腐烂变质的病害控制提供理论依据。
1 材料与方法
1.1 材料与试剂
生防细菌:生防菌CF-2菌株,由上海大学生命学院食品质量与安全控制实验室筛选分离并保存。
病原真菌:交链孢霉、桃褐腐菌、复端孢霉、丝核菌,由上海大学生命学院食品质量与安全控制实验室从水蜜桃果实上分离并保存。
水果:供试品种“大团蜜露”水蜜桃摘自上海市南汇区果园,当天运至上海大学,选取果型端正、大小均一、无机械损伤的约七成熟果实进行实验,不进行任何消毒,直接进行后续处理。
引物P0与P6 生工生物工程(上海)股份有限公司;聚合酶链式反应(polymerase chain reaction,PCR)体系各种试剂 宝日医(TaKaRa)生物技术(北京)有限公司;DNA回收试剂盒 上海英骏生物技术有限公司;其他试剂均为分析纯 上海国药集团化学试剂有限公司。
1.2 仪器与设备
756CRT紫外-可见分光光度计 上海精密科学仪器有限公司;CHA-213型双目生物显微镜 日本Olympus仪器有限公司;C1000 Touch PCR仪 伯乐生命医学产品(上海)有限公司;Tanon EPS300电泳仪 上海天能科技有限公司;AlphaImager Mini凝胶成像系统 美国ProteinSimple公司。
1.3 方法
1.3.1 培养基配制
牛肉膏蛋白胨(luria-bertani,LB)固体与液体培养基以及葡萄糖马铃薯(potato dextrose agar,PDA)固体培养基均参照文献[14]进行配制。
1.3.2 生防菌CF-2的鉴定
1.3.2.1 CF-2形态特征鉴定
将菌株CF-2接种在LB培养基平板和斜面上,放入37 ℃的培养箱中培养24 h后,参照文献[15-16]对其进行革兰氏染色、芽孢染色,观察菌体形态及菌落特征。
1.3.2.2 CF-2生理生化性状鉴定
耐盐性测定、好氧性和厌氧性测定、柠檬酸盐的利用、淀粉水解、V-P(Voges Proskauer)实验、明胶液化实验、接触酶反应,均参照文献[15-17]进行。各处理均设定3 次重复。
1.3.2.3 菌株CF-2 16S rDNA基因片段序列分析
参照文献[1 8]的方法扩增C F-2菌株的1 6 S r D N A片段。采用细菌通用引物P 0(5’-GAGAGTTTGATCCTGGCTCAG-3’)和P6(5’-CTACGGCTACCTTGTTACGA-3’),预期扩增片断大小为1 513 bp。PCR体系包括:Taq DNA聚合酶(5 U/μL)2 μL、10×PCR缓冲液5 μL、dNTPs(10 mmol/L)1 μL、引物P0/P6(10 μmol/L)各1 μL、模板DNA(约50 g/L)1 μL、ddH2O 39 μL;PCR总体系为50 μL。PCR程序为:先升温至94 ℃保持3 min,循环为:94 ℃、30 s,60 ℃、30 s,72 ℃、90 s,共计30 个循环,最后72 ℃延伸10 min。
PCR产物经1%琼脂糖凝胶电泳(120 V,15 min)后,在紫外灯下,切割扩增片段,采用DNA回收试剂盒进行回收,并连接到载体pMD18-T vector上,转化大肠杆菌感受态杆菌TOP10。用Amp抗性LB平板筛选阳性克隆,挑阳性克隆摇菌,送上海美吉生物医药科技有限公司测序。
将获得的测序结果提交NCBI数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行BLAST同源性分析,随后利用MEGA 7.0软件进行序列比对以及构建系统进化树。
1.3.3 CF-2生物学特性分析
1.3.3.1 CF-2种子培养液的制备
用接种环将在LB固体培养基上预先活化的CF-2接入灭菌后的LB液体培养基中,在37 ℃、150 r/min条件下培养24 h,用血球计数板计数并用无菌蒸馏水将浓度调至1×108CFU/L,即为CF-2种子培养液。
1.3.3.2 生长曲线的测定
接种1 mL CF-2种子培养液到100 mL LB液体培养基中,放置于37 ℃、150 r/min的摇床中培养,每隔3 h用分光光度计在625 nm波长处测吸光度,通过观察其生长速度来确定进一步测定吸光度的取样间隔时间。以不接菌的LB液体培养基为对照,每处理3 个重复。
1.3.3.3 最适生长pH值的测定
将灭菌后的100 mL LB液体培养基分别调成pH值为4.0、5.0、6.0、7.0、8.0、9.0、10.0,随后分别接种1 mL CF-2种子培养液于100 mL调至不同pH值的LB液体培养基中,放置于37 ℃、150 r/min的摇床中培养,24 h后用紫外-可见分光光度计在625 nm波长处测其吸光度。以不接菌的LB培养液为空白对照,每处理3 个重复。
1.3.3.4 最适生长温度的测定
接种1 mL CF-2种子培养液于100 mL pH 7.0的LB液体培养基中,放置于20、28、30、37、40、45、50 ℃,150 r/min的摇床中培养,24 h后用分光光度计在625 nm波长处测其吸光度。以不接菌的LB培养液为空白对照,每处理3 个重复。
1.3.4 CF-2对病原真菌体外抑菌率的测定
采用平板对峙法测定抑菌率,用打孔器(直径6 mm)打孔原病原真菌菌丝,放置于新鲜PDA平板中央,在接种真菌菌丝的右侧距菌丝3 cm处划线接种经过24 h活化的CF-2,分别重复3 个平行,放入28 ℃恒温培养箱中培养。同时将4 种病原菌按相同菌落大小(直径6 mm)接在新鲜PDA平板上,并且不接种CF-2,在相同条件下一起培养作为空白对照。待空白对照组的菌落长满整个平板时,分别用十字交叉法测量空白组与处理组菌丝直径并计算抑菌率。抑菌率计算如式(1)所示:

1.3.5 CF-2不同组分液的体外抑菌效果及其无菌滤液的抗菌活性测定
1.3.5.1 CF-2 24 h发酵液的制备
接种1 mL CF-2种子培养液到100 mL LB液体培养基中,在37 ℃、150 r/min条件下培养24 h,用血球计数板计数并用无菌蒸馏水将浓度调至1×108CFU/L,即为CF-2 24 h发酵液。
1.3.5.2 CF-2菌悬液与无菌滤液的制备
取适量CF-2 24 h发酵液置于10 mL的离心管中在10 000×g条件下4 ℃离心20 min后,分离上清液后收集沉淀菌体,利用无菌生理盐水(0.9%氯化钠溶液)进行稀释。用血球计数板计数及无菌生理盐水将菌落浓度调至1×108CFU/L,即为CF-2 24 h发酵液的菌悬液。将先前离心后所得到的上清液在相同条件下重新离心一次。然后用直径35 mm、孔径0.22 μm的滤膜过滤,即为CF-2 24 h发酵液的无菌滤液。
1.3.5.3 致病真菌孢子菌悬液的配制
将含有0.05% Tween 80的无菌蒸馏水加入已经过预先培养的致病真菌PDA平板上,用接种环将斜面上的孢子刮下,并用8 层灭菌纱布进行过滤,取其清液,用血球计数板计数并制成约1×104spores/mL浓度的孢子悬浮液,待用。
1.3.5.4 CF-2不同组分液的抑菌效果测定
将灭菌后的牛津杯置于新鲜PDA平板中心(直径为90 mm),轻轻按压,使其与PDA培养基充分接触没有空隙。随后在与牛津杯成一条直线的两侧中心点(即左右各24.5 mm处)分别接入由6 mm打孔器打孔的病原菌丝。随后将牛津杯中央注入100 μL的CF-2的24 h发酵液、菌悬液或无菌滤液,并且用无菌蒸馏水作空白对照。将平板置于28 ℃培养箱中培养7 d,7 d后测定其抑菌圈直径大小。每个处理重复3 次。
1.3.5.5 CF-2无菌滤液对致病真菌菌丝生长的抑制率测定
将CF-2无菌滤液与灭过菌且还未凝固的PDA固体培养基以1∶5(V/V)混合,混合均匀后倒平板,配制成每个平板为20 mL的抗性培养基,空白处理则加入等量无菌水替代CF-2无菌滤液。晾干后在平板中央接入由6 mm打孔器所打的致病真菌菌丝,将平板置于28 ℃恒温培养箱中培养7 d,7 d后测定菌丝生长长度。每种病原菌每个处理重复3 次。抑菌率计算公式参考1.3.1节。
1.3.5.6 CF-2无菌滤液对致病真菌孢子萌发的抑制率测定
将20 mL含有CF-2无菌滤液的拮抗培养基(CF-2无菌滤液与PDA固体培养基体积比1∶4)倒入经过灭菌的平板中,待培养基冷却凝固后,将20 μL的致病真菌孢子菌悬液均匀涂抹在固体培养基上。对照组则是20 mL用无菌蒸馏水替代CF-2无菌滤液的普通培养基(无菌蒸馏水与PDA固体培养基体积比1∶4)。将平板置于28 ℃恒温培养箱中培养,每种病原菌每个处理重复3 次。用光学显微镜观察处理组与空白对照组的孢子萌发情况,以芽管长度超过孢子最大直径长度作为萌发标准。观察时间间隔为2 h,并且在后续实验中适当延长了观察时间间隔,当有孢子萌发则以该时间点作为开始萌发时间。另外,分别在6 d与12 d观察并计数处理组与空白对照组的孢子萌发个数,计算孢子萌发率。孢子萌发率计算如式(2)所示:

1.3.6 CF-2及其代谢产物对水蜜桃贮藏保鲜效果分析
CF-2 24 h发酵液、菌悬液、无菌滤液及无菌水(空白对照)处理水果,每组24 个桃子,每个处理设3 组平行。水果处理采用喷雾方法,确保不同组分液均匀覆盖每个桃子表面,晾干后,将水蜜桃轻轻放入保鲜盒,装入保鲜袋以保持湿度,然后将水果置于恒温储藏间进行贮藏,贮藏温度为25 ℃,周期为6 d。每天测定好果率,6 d后结束贮藏。以未发生病害、冷害、机械性损伤、霉变的果实为好果。好果率计算如式(3)所示:

1.4 数据处理
2 结果与分析
2.1 菌株CF-2的鉴定
2.1.1 形态特征及染色结果
CF-2菌株在LB固体培养基上37 ℃培养24 h后,镜检,菌体细胞呈杆状,能运动。如图1所示,经革兰氏染色显紫色,呈阳性(以大肠杆菌为对照),且有绿色芽孢。如图2所示,在LB固体培养基上培养24 h后,菌落呈淡黄色,略隆起,圆形,边缘不整齐,呈放射状。

图2 CF-2在LB固体培养基培养24 h后的菌落形态Fig.2 Colony morphology of strain CF-2 on LB solid culture after 24 h cultivation
2.1.2 生理生化特性
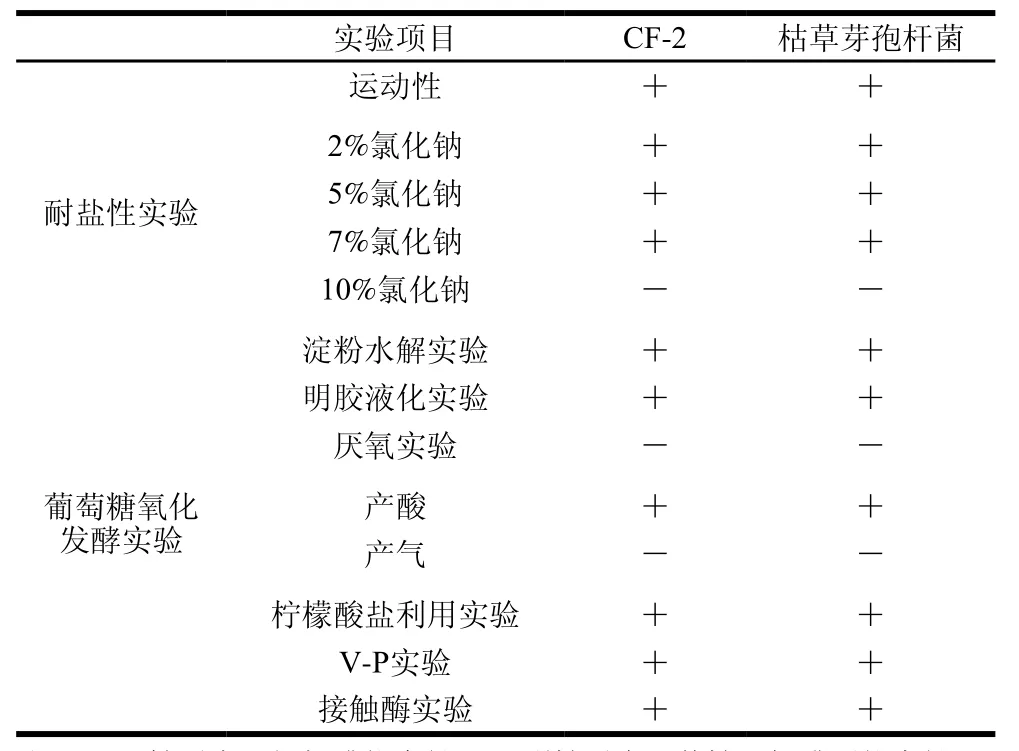
表1 CF-2生理生化特性Table1 Physiological and biochemical characteristics of strain CF-2
如表1所示,CF-2具有运动性,在氯化钠质量分数为2%~7%的情况下可以生长,能水解淀粉,能液化明胶,无法在厌氧条件下生长,能利用葡萄糖产酸但不能产气,能利用柠檬酸盐,V-P实验呈阳性反应,接触酶呈阳性反应,与枯草芽孢杆菌(Bacillus subtilis)特征一致。
2.1.3 16S rDNA同源性鉴定
利用引物P0和P6,扩增出CF-2的16S rDNA片段,其长度为1 516 bp,比预期1 513 bp多3 bp,分析得知多出的3 bp均发生在重复序列处,由测序误差产生。通过BLAST分析,扩增的片段序列与枯草芽孢杆菌的16S rDNA部分序列的同源性达99%以上。随后利用MEGA 7.0软件构建出系统进化树(图3),结果显示CF-2与枯草芽孢杆菌的遗传距离最近,再一次证实生防菌CF-2属于枯草芽孢杆菌。

图3 CF-2的系统进化树Fig.3 Phylogenetic tree of strain CF-2
2.2 菌株CF-2生物学特性
2.2.1 CF-2生长曲线
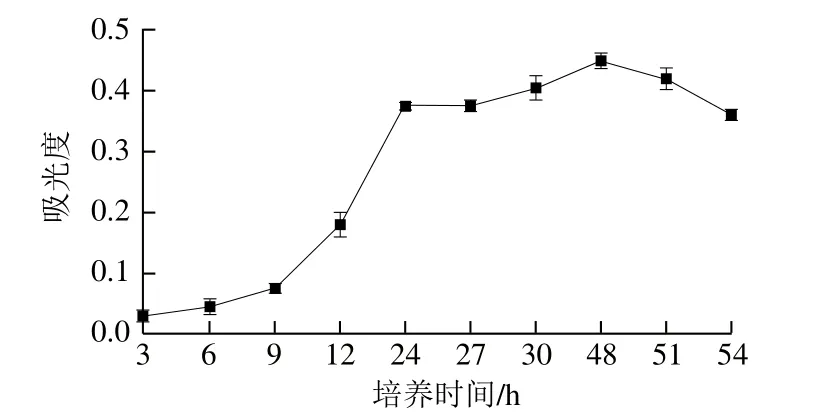
图4 CF-2生长曲线Fig.4 Growth curve of strain CF-2
从图4可看出,CF-2在LB液体培养基中,当培养时间为48 h时,培养液的吸光度最大。CF-2在接种到LB培养液后的24 h内处于对数生长期,24~48 h内处于稳定生长期,接种51 h后进入衰老期。可见该菌生长速度较快,接种后24~48 h内菌量最多。
2.2.2 pH值对CF-2生长的影响
由图5可看出,该菌在较大pH值范围内都能生长,但pH值对CF-2菌株生长影响明显。其中pH 5.0~9.0适宜CF-2的生长,而CF-2最适pH值在7.0左右,可见该菌适宜在中性条件下生长。

图5 pH值对CF-2生长的影响Fig.5 Influence of pH value on growth of strain CF-2
2.2.3 温度对CF-2生长的影响

图6 温度对CF-2生长的影响Fig.6 Effects of temperature on growth of strain CF-2
由图6可看出,温度对生防菌CF-2生长和繁殖有明显的影响,在20~50 ℃范围内,CF-2生长和繁殖速率呈先上升后下降趋势,最适温度为37 ℃左右。
2.3 菌株CF-2对病原真菌的抑制作用
2.3.1 CF-2对病原真菌的体外抑制效果

图7 CF-2对病原菌的体外抑制率Fig.7 Inhibition rates of CF-2 on four fungal pathogens in vitro
由于4 种病原真菌生长速度不一,待空白对照组PDA平板上长满真菌菌落后测定空白组与接种组平板上的菌丝直径。在本实验中,分别于桃褐腐菌生长4 d后,丝核菌与复端孢霉生长6 d后,交链孢霉生长7 d后进行测定。由图7可知,CF-2对供试病原菌表现出较强的抑制作用,平均抑制率为(38.70±9.22)%。其中对复端孢霉的抑制作用最大,抑制率为(52.30±3.67)%,其次是对丝核菌、交链孢霉与桃褐腐菌,抑制率分别为(37.63±3.28)%、(35.93±2.71)%与(28.94±1.65)%。该结果表明,CF-2对于桃果实采后常见病原真菌具有抑制作用。
2.3.2 CF-2不同组分液的体外抑菌效果及其无菌滤液的抗菌活性
2.3.2.1 CF-2不同组分液对菌丝生长的影响
为进一步研究CF-2菌体以及代谢产物对4 种病原真菌的抑菌效果,将CF-2的24 h发酵液分离成只含有菌体的菌悬液及只含有代谢物质的无菌滤液,测定该3 种组分液对真菌的抑制作用,从图8可看出,菌株CF-2 24 h发酵液、菌悬液及无菌滤液对4 种病原菌均具有一定的抑制作用,其中无菌滤液对桃褐腐菌、丝核菌、复端孢霉与交链孢霉的抑菌圈直径分别为(10.08±0.82)、(1 3.5 3±1.4 3)、(2 6.1 9±1.4 2)m m及(12.82±0.61)mm,抑菌作用较好,说明CF-2的代谢产物中含有抑菌物质。

图8 CF-2不同组分液对病原真菌的影响Fig.8 Inhibition zone diameters of fungal pathogens when exposure to the fermented both of CF-2 and its cell-free filtrate and cell suspension
2.3.2.2 CF-2无菌滤液对菌丝生长的影响
为进一步探究CF-2代谢产物对4 种病原真菌菌丝生长的抑制效果,为后续的应用提供根据,将仅含有代谢产物的无菌滤液添加进PDA培养基中制成拮抗培养基,观察菌丝生长的情况。在病原真菌接种7 d后,交链孢霉、丝核菌、桃褐腐菌和复端孢霉的空白对照组菌落直径已经分别长满整个平板(9 cm),而添加无菌滤液的培养基中交链孢霉、丝核菌、桃褐腐菌和复端孢霉菌落直径分别为(1.9±0.1)、(3.0±0.1)、(3.0±0.1)cm和(3.1±0.1)cm,可见添加无菌滤液的抗性培养基菌落直径明显小于空白对照组;如图9所示,CF-2无菌滤液对桃褐腐菌、丝核菌、复端孢霉、交链孢霉的抑制率分别为(67.22±2.68)%、(6 5.2 3±3.4 7)%、(6 5.1 9±2.6 3)%、(77.41±1.91)%,平均抑制率达到(68.76±5.77)%,说明CF-2经发酵产生的代谢产物能显著抑制致病真菌的生长,尤其是对交链孢霉的抑制效果最为明显。

图9 CF-2无菌滤液对病原菌菌丝生长的影响Fig.9 Inhibition rates of the cell-free filtrate of CF-2 on fungal pathogens in vitro
2.3.2.3 CF-2无菌滤液对病原菌孢子萌发率的影响
为进一步探究CF-2代谢产物对于4 种病原真菌孢子萌发的作用,将仅含有代谢产物的无菌滤液添加进PDA培养基中制成拮抗培养基,观察孢子萌发的情况。孢子不萌发,说明其抑制效果良好,而萌发的越早,说明其抑制效果越差,反之说明其抑制效果越好,因此通过测定CF-2无菌滤液对病原真菌孢子萌发时间、萌发率的影响可直接反映其抑制效果。由于丝核菌不产孢子,因此研究中只测定了无菌滤液对交链孢霉、桃褐腐菌和复端孢霉孢子萌发的影响。

表2 CF-2无菌滤液对病原真菌孢子开始萌发时间的影响Table2 Effect of the cell-free filtrate of CF-2 on starting time of spore germination
如表2所示,空白对照组中的交链孢霉、桃褐腐菌与复端孢霉的孢子分别在12、8 h与14 h后开始萌发,但经过CF-2无菌滤液处理后交链孢霉、桃褐腐菌与复端孢霉的孢子萌发时间分别延迟至74、72 h与76 h,较空白对照组延长了62、64 h与62 h。

表3 CF-2无菌滤液对病原菌孢子萌发率的影响Table3 Effect of the cell-free filtrate of CF-2 on spore germination rate%
由表3可知,12 d后,经CF-2无菌滤液处理的交链孢霉、桃褐腐菌与复端孢霉的孢子萌发率分别为8.45%、9.25%和9.64%,较空白对照组分别降低了91.55%、87.27%与84.97%,平均降低了87.93%。由此可知,添加CF-2无菌滤液可有效降低病原菌孢子萌发率。
以上结果表明,CF-2的无菌滤液可以使病原真菌的菌丝生长受到抑制,使病原菌孢子在适宜条件下不能正常萌发,说明CF-2的代谢产物对病原菌的生长和代谢产生了抑制作用;同时CF-2无菌滤液对4 种不同病原菌的抑制效果不同,对交链孢霉的抑制效果最好。
2.4 CF-2组分液对水蜜桃采后的保鲜效果
为明确CF-2在水果上的实际应用效果,研究在25 ℃常温条件下CF-2不同组分液对水蜜桃采后的保鲜作用,从图10可看出,在第3天时,空白对照组已出现腐烂的果实,其他经过CF-2组分液喷洒处理与空白对照有显著性差异(P<0.05);在第4天时,CF-2 24 h发酵液处理的果实开始出现腐烂,而CF-2无菌滤液与CF-2菌悬液处理的果实未腐烂,保鲜效果与发酵液差异显著(P<0.05);到第6天时,CF-2 24 h发酵液、无菌滤液与菌悬液处理组的好果率显著高于空白对照组,其中无菌滤液处理组的好果率最高,显著高于其他处理组(P<0.05),说明在室温下,CF-2 24 h发酵液及无菌滤液与菌悬液对水蜜桃均有显著的保鲜效果,其中无菌滤液的效果最好,第6天时无菌滤液处理组好果率为(95.5±1.9)%,较空白对照组(66.5±1.7)%提高29%。

图10 CF-2组分液对采后水蜜桃好果率的影响Fig.10 Effects of the fermented both of CF-2 and its cell-free filtrate and cell suspension on percentage of marketable fruit
3 讨 论
细菌形态和生理生化特征鉴定是细菌现代分类鉴定重要的依据[19]。本研究通过形态学和生理生化方法,参照《常见细菌系统鉴定手册》[16]和《伯杰细菌鉴定手册》[17]中有关芽孢杆菌种属鉴别特征的描述,确定CF-2菌株为枯草芽孢杆菌(B. subtilis)。在此基础上,利用16S rDNA基因序列比对分析法,在分子生物学水平上对CF-2进行进一步鉴定,最终确定其为枯草芽孢杆菌。
枯草芽孢杆菌作为一株已被广泛研究的生防菌,已有大量报道证明了其抗真菌作用。关一鸣等[20]发现枯草芽孢杆菌B11使灰葡萄孢霉(Botrytis cinerea)与腐皮镰刀菌(Fusarium solani (Mart.) App. et Wollenw.)生长受到影响。韩雨桐等[21]发现枯草芽孢杆菌Sc2可以抑制稻瘟病菌(Magnaporthe oryzae)的生长。本研究发现枯草芽孢杆菌CF-2的菌体在体外对供试的4 种病原菌均具有较强的抑菌作用。
另外,枯草芽孢杆菌代谢产物也被报道具有抑制真菌的能力。例如:枯草芽孢杆菌EA-CB0015的菌体本身与无菌滤液对灰葡萄孢霉与刺盘孢属(Colletotrichum sp.)均有不同程度的抑制作用[22];枯草芽孢杆菌V26的无菌滤液可抑制灰葡萄孢霉[23]与立枯丝核菌(Rhizoctonia solani)[24]的菌丝生长。本研究中,CF-2的无菌滤液可极强地抑制4 种病原真菌菌丝的生长。另外,枯草芽孢杆菌的代谢产物对于真菌孢子萌发方面也有相关报道:关一鸣等[20]报道枯草芽孢杆菌B11代谢产物原液对于灰葡萄孢霉与腐皮镰刀菌的孢子萌发抑制率均超过85%。刘诗胤[25]分离获得12 株可以拮抗稻瘟病菌的细菌,其中有7 株枯草芽孢杆菌的培养液100%抑制稻瘟病菌分生孢子的萌发。李晶等[26]发现枯草芽孢杆菌B29分泌的抗菌物质可以抑制尖孢镰刀菌(Fusarium oxysporum)孢子的萌发。本研究结果也说明CF-2代谢产物极大地延长了真菌孢子的萌发时间,并且能够使病原真菌孢子在适宜条件下无法正常萌发。
同时,在实体实验方面,枯草芽孢杆菌亦体现出良好的生防能力。候旭等[27]从桃树根部组织中复筛分离得到3 株枯草芽孢杆菌,并通过桃果实实体实验证明该3 株枯草芽孢杆菌能够抑制桃褐腐病的发生,提高好果率。本实验中,CF-2与其代谢产物可以在室温下显著提高桃果实的好果率,延缓腐败的发生,对桃果实的保鲜作用明显。
综上所述,CF-2及其代谢产物对采后水蜜桃病原真菌具有较强的抑制作用,与农药相比有保护环境、安全等优点,是一株具有广阔应用前景的生防菌株。因此,进一步对CF-2的抑菌机理及其代谢产物进行研究,将为生物防治的研究展开一条全新的思路。
4 结 论
对1 株分离自豆腐乳的生防菌株CF-2进行形态学特征、生理生化特征鉴定,同时通过16S rDNA基因序列分析法进行分子鉴定,确定该菌为枯草芽孢杆菌,该菌24~48 h繁殖速度最旺盛,最适生长pH 7.0,最适生长温度为37 ℃。
CF-2对4 种病原真菌在体外均有抑制作用,平均抑制率为(38.70±9.22)%,其中对复端孢霉的抑制作用最大,抑制率为(52.30±3.67)%。CF-2 24 h发酵液及无菌滤液与菌悬液对4 种病原菌均有较强的抑制效果,其中无菌滤液对4 种病原真菌的平均抑制率为(68.76±5.77)%,无菌滤液对交链孢霉的抑制作用最大,抑制率为(77.41±1.91)%;经过CF-2无菌滤液处理后,真菌孢子萌发时间较空白对照组均延长62~64 h,12 d后孢子萌发率较空白对照组平均降低87.93%;在实体实验中,25 ℃室温CF-2 24 h发酵液及无菌滤液与菌悬液对水蜜桃的保鲜效果非常明显,可有效提升好果率,其中无菌滤液效果最好,第6天时较空白对照组好果率提升了29%,表明CF-2及其代谢产物对4 种水蜜桃采后病原菌有较强的抑制作用,同时对水蜜桃采后抑制腐烂效果明显。

