通过二代测序技术开发25个小熊猫的微卫星位点
杨艾琳, 谢军金, 沈富军, 张文平, 侯蓉, 张志和, 张亮*
(1. 四川省濒危野生动物保护生物学重点实验室,成都大熊猫繁育研究基地,成都610081;2.北京师范大学,北京100875)
小熊猫Ailurusfulgens是国家Ⅱ级重点保护野生动物,主要分布在喜马拉雅-横断山脉一带,有2个亚种:指名亚种A.f.fulgens和川西亚种A.f.styani(高耀亭,1987)。自20世纪90年代以来,小熊猫野生种群生存状况不断恶化。世界自然保护联盟(IUCN)红色名录在其评估报告中指出,由于栖息地的退化和破碎化,小熊猫野生种群已处于濒危(EN)状态(Glatston,2015)。当各隔离的小熊猫小种群面临长期续存的挑战时,开展迁地保护,以期复壮未来的野生种群是必要的。同时,这亦是缓解小熊猫野生种群压力的重要手段之一。如何建立科学的小熊猫圈养种群管理体系,力求实现种群的自我维持,是目前管理者们亟待解决的问题。
根据中国动物园协会2017年的谱系调查,现存圈养小熊猫个体为485只。近年来,国内小熊猫圈养种群的数量持续增长,但遗憾的是,由于缺乏科学的管理体系,很多机构小熊猫种群的管理记录不仅不完善,甚至还存在一些错误记录。同时,现有的配对方式易导致圈养种群遗传多样性丢失,甚至发生近交衰退,最后威胁整个种群的续存。遗传多样性对于物种特别是濒危物种的保持至关重要(Meffe & Carroll,1994),濒危物种遗传多样性往往较低,而且有效种群也较小,因此易发生遗传漂变。近交是有共同祖先的个体间的交配(Blouin & Blouin,1988)。遗传多样性的丢失和近交的联合作用会降低种群对环境/气候变化的适应力,通过近交衰退直接或间接地导致适合度下降(Keller & Waller,2002;Armstrong & Seddon,2008;Jamieson,2011)。保护遗传学是保护生物学研究中的一个核心部分,主要研究濒危物种的遗传多样性和保护物种的进化潜力(李明等,2001),加强保护遗传学方面的研究,及时为圈养种群的管理提供科学指导。
微卫星即简单重复序列,由相对短片段的随机重复组成,常常被偶然发现于已经测序过的DNA片段上(Tautz & Renz,1984)。微卫星是脊椎动物基因组的重要组成部分,相比于线粒体DNA和核基因内含子,微卫星具有相对较高的突变率(Ryman & Leimar,2008),在整个基因组上分布广泛(Kashietal.,1997)。
微卫星作为一个应用广泛且十分可靠的分子标记,常常用于解决种群遗传和进化等问题(Estoup & Angers,1998),许多濒危物种的圈养种群管理都采用了微卫星技术,并取得了很好的成效。如Omote等(2012)在毛腿渔鸮Buboblakistoni上开发了8个微卫星位点,在120只个体上进行了扩增,进行遗传多样性的分析,等位基因数为2~7,观察杂合度和期望杂合度分别为0.052~0.742和0.067~0.769;微卫星还可估测现阶段的迁移率,具有区分随机交配和相对高迁移率的能力,并能估计个体之间的相关性(Selkoe & Toonen,2006);在大熊猫Ailuropodamelanoleuca(Zhangetal.,2003)、华南虎Pantheratigrisamoyensis(Zhangetal.,2012)、丹顶鹤Grusjaponensis(Zhangetal.,2015)等濒危动物上也得到了很好的应用。
此前,我们已经采用磁珠富集法开发了26个小熊猫微卫星位点(Liangetal.,2007;Zhangetal.,2008)。遗憾的是,由于国内圈养小熊猫种群普遍缺乏科学、详细的记录,存在着资料有误、父/母未知、父母均未知、疑似父母范围广等多种问题,在圈养种群遗传管理的实际工作中,现有位点还不能在复杂情况下很好地完成亲缘关系推定,因此,我们决定开发新的微卫星位点,以期提高小熊猫亲子鉴定的准确率。
1 研究方法
在成都大熊猫繁育研究基地采集1只2岁雄性小熊猫的血液样品(本研究所用小熊猫样品均采自成都大熊猫繁育研究基地),用血液和组织核酸纯化试剂盒(Qiagen,德国)提取DNA后,将总DNA送往上海美吉生物医药科技有限公司,通过Roche 454测序平台的FLX测序仪进行测序。应用Newbler 2.6(Marguliesetal.,2005)进行短片段文库的拼接,组装后的数据用misa.pl(http://pgrc.ipk-gatersleben.de/misa/)进行微卫星位点分析。
使用PRIMER3(Rozen & Skaletsky,2000)在筛选出的微卫星序列中随机选择了467条设计引物。考虑到滑链风险(Edwardsetal.,1991;Taberletetal.,1996,2008)会对微卫星数据的读取造成影响,本研究所选取的微卫星位点均为3~6碱基重复序列。用这467对引物对5只小熊猫个体进行PCR扩增(Applied Biosystems GeneAmp PCR System 9700,美国)。反应体系为:模板DNA 50 ng,20 μmol·L-1上、下游引物各0.2 μL,25 mmol·L-1MgCl20.6~1.4 μL,2.5 mmol·L-1dNTP 0.2 μL,Taq酶0.2 U,加水补足至10 μL体系。扩增体系如下:95 ℃ 10 min;94 ℃ 15 s,退火15 s(退火温度详见表1),72 ℃ 30 s,10个循环;89 ℃ 15 s,退火15 s(退火温度详见表1),72 ℃ 30 s,20个循环;72 ℃ 10 min;最后4 ℃保存。将所有初始引物的PCR产物在琼脂糖凝胶上进行电泳检测,选取PCR产物的条带位于设计的长度范围内,且条带清晰、明亮的引物加上荧光标记(6-FAM或HEX),接下来使用8只小熊猫的DNA样本,对以上荧光引物进一步筛选。将最后筛选出的引物应用到42只小熊猫个体上进行基因分型。为了确保分型数据的准确性,所有PCR均进行3次重复,基因分型在成都擎科梓熙生物技术有限公司进行。
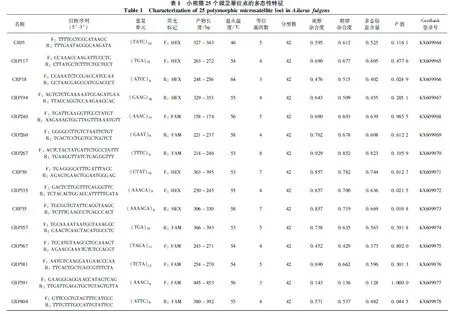
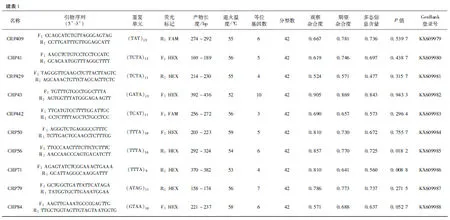
根据所获得的分型数据,使用Cervus 3.0(Marshalletal.,2010)进行微卫星位点的遗传多样性分析,计算等位基因杂合度和多态信息含量(polymorphism information content,PIC)。另外,使用Genepop 3.4(Raymond & Rousset,2003)进行哈迪-温伯格平衡、连锁不平衡以及无效等位基因频率的检测。
2 结果与分析
测序共获得了2.9 Gb的数据量,平均读长为567.9 bp。N50长度为719 bp,平均GC含量为40.41%,平均测序深度1×。Contigs数目为1 830个,拼接得到了近36万条序列。经分析得到微卫星序列近8万条,其中,单碱基重复序列59.2%,二碱基重复序列31.9%,三碱基重复序列4.4%,四碱基重复序列3.8%,五碱基重复序列和六碱基重复序列分别为0.6%和0.08%。
在测序得到的微卫星序列中随机选择了一部分,利用Primer 3.0设计了467对引物。经琼脂糖凝胶电泳,排除多位点扩增及扩增失败的引物,最后筛选出了25个微卫星位点(表1),并提交到GenBank数据库(登录号:KX609964~609988)。对成都大熊猫繁育研究基地的42只小熊猫进行了基因分型,共获得了128个等位基因,等位基因数目3(CRP18、CRP391、CRP442)到10(CRP43),每个位点的平均等位基因数是5.12;PIC=0.128~0.843,平均值为0.596 2;而观察杂合度和期望杂合度分别为0.143~0.929和0.136~0.869(表1)。经过检测,所有位点均未偏离哈迪-温伯格平衡(表1)、无显著的连锁不平衡、无无效等位基因。
用这25对微卫星引物对10份以上陈旧样品(4 ℃放置2年以上的小熊猫血液DNA)进行了PCR扩增。分型结果与新鲜血液DNA结果完全一致,说明这些微卫星引物可应用于较低质量的DNA样品。
3 讨论
PIC是衡量分子标记信息量最常用的指标(Nagyetal.,2012)。根据Botstein等(1980)的标准,本研究中新开发的25个微卫星位点具有很好的重复性和稳定性,其中有19个位点具有高度多态性。所有位点未偏离哈迪-温伯格平衡和连锁不平衡,提示它们适合用于小熊猫种群的遗传多样性及遗传结构分析。今后我们将以这25个位点为主,加上此前开发的优质位点,进一步扩大样品数量,建立成都大熊猫繁育研究基地小熊猫种群乃至国内种群的微卫星数据库。
中国的小熊猫圈养种群管理并不完善,存在的历史问题比较多,例如谱系比较混乱、繁殖配对随意等。此外,考虑到国内圈养小熊猫机构间存在一定的交换,在全国范围内开展一次亲缘关系普查是必要的。本研究中报道的微卫星位点可以对圈养种群个体之间的亲缘关系进行分析和验证,建立科学的谱系关系,从而避免近亲配对等不科学的管理方式,也对小熊猫将来的就地保护和迁地保护具有重要意义。

