高压微射流处理对米谷蛋白热聚集体性质的影响
邢贝贝,张亭亭,赵 强*,熊 华
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
高压微射流均质技术是一种新型的食品高压加工技术,能对流体混合物料进行强烈的剪切、撞击、高频振荡、压力瞬间释放、膨爆和气穴等一系列综合作用,从而起到很好的超微化、微乳化和均一化效果[1]。与传统的高压均质技术相比,高压微射流在很大程度上更能对蛋白组分的结构和性质起到一定的改善作用,可以有效破坏分子间的疏水以及静电相互作用,可改变蛋白分子的三、四级结构,尽管其对改变蛋白亚基结构没有明显效果[2-4]。
大米谷蛋白是大米蛋白中最主要的贮藏蛋白(所占比例66%~78%),由于疏水作用和亚基间—SH或üSüS—交联,导致大米谷蛋白具有高度疏水性,加工性质不理想,因而限制了大米谷蛋白的应用。据文献报道,大米谷蛋白的改性方法主要有高压、脱酰胺、美拉德反应、酶解等物理、化学、生物酶法[5-8]。目前除了有少量酶法制备小分子蛋白水解物/肽实现了大米谷蛋白功能提升之外,开发大米谷蛋白资源并将其广泛应用的问题,至今一直没有得到很好的解决。
蛋白纤维化聚集体是蛋白在酸性加热条件下形成的纤维状蛋白聚集体结构[9],聚集体的形成可以改变蛋白原有的结构及相关性质,如提高难溶蛋白的溶解性[10]。然而,大米谷蛋白纤维化聚集体的研究尚鲜见报道。作为一种热聚集体,其功能性质的开发研究还有待进一步深入。因此,本研究尝试联合高压微射流及酸法热处理对大米谷蛋白进行改性,对表观形貌、粒径、ζ电位、表面疏水性、巯基含量、热特性、二级结构组成、流变性能、乳化性能等指标进行分析,以期为高压微射流技术处理蛋白热聚集体的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
籼米为市售;5,5’-二硫代-2-硝基苯甲酸(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB) 美国Sigma公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA) 北京索来宝化学试剂公司;三羟甲基胺基甲烷(Tris)、甘氨酸、尿素、巯基乙醇、正己烷、盐酸、氢氧化钠等均为国产分析纯。
1.2 仪器与设备
T18高速分散机 德国IKA公司;M-110EH微射流均质机 美国MFIC公司;Nano-ZSE激光粒度电位仪 英国Malvern公司;T6紫外-可见分光光度计 北京普析通用仪器有限公司;5700傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Thermo Nicolet公司;DHR-2型流变仪 美国TA公司;Quanta 200F扫描电子显微镜 荷兰FEI公司。
1.3 方法
1.3.1 大米谷蛋白的制备
大米谷蛋白的提取分离参考Zhao Qiang等[11]的方法。称取粉碎过筛的籼米原料150 g,加入到1.5 L氢氧化钠溶液(0.05 mol/L)中,常温搅拌提取4 h后离心(5 000 r/min,30 min)取上清液,采用0.05 mol/L的盐酸调pH值至4.8,静置12 h后,离心取沉淀,适量去离子水洗涤3 次去除可溶物。接着,将沉淀物分散到1 L质量分数5% NaCl溶液中,常温搅拌3.5 h,离心除去少量的清蛋白和球蛋白。然后,沉淀采用体积分数75%乙醇溶液1 L提取3.5 h后离心除去醇溶蛋白。最后,将沉淀物分散于适量去离子水中,调pH值至7.0,透析48 h,不间断多次换水,冷冻干燥得到样品(NRG)。
1.3.2 大米谷蛋白纤维化聚集体的制备
称取一定量NRG溶于5 mmol/L磷酸氢二钠-柠檬酸缓冲液(pH 2.0)中,配制质量浓度1 g/100 mL的蛋白溶液,室温搅拌2 h后密封于带盖瓶中,置于水浴摇床进行加热处理(90 ℃,30 min)。热处理后将样品(HRG)迅速冰浴冷却备用。
1.3.3 动态超高压微射流处理
量取180 mL HRG样品,经设定好微射流(压力35、70、105、140 MPa)各均质一次。将样品浸入冰水浴中以除去微射流处理产生的热量。在各压力下所得到的样品分别为HRG-35、HRG-70、HRG-105、HRG-140,4 ℃下贮存备用。
1.3.4 表面形貌的观察
采用扫描电子显微镜对NRG、HRG及其高压处理后样品的表面形貌进行观察。将样品均匀平摊在贴有导电胶的样品台上,喷金处理,观察成像时加速电压20 kV。
1.3.5 粒度分析
配制大米谷蛋白聚集物溶液并稀释到蛋白质量浓度为1 mg/mL,经过0.45 μm的滤膜过滤后进行粒径测定。样品置于1 cmh1 cm的样品池中,粒径测试采用Nano-ZSE激光粒度电位仪,设置的基本测定条件为:温度25 ℃;黏度0.887 2 cP;定角173°。
1.3.6 电位分析
采用激光粒度电位仪测定蛋白溶液的ζ电位。测定条件如下:比色池规格为1 cm聚硝乙甲池,采用一对0.45 cm2铂电极,间距为0.4 cm。测定温度25 ℃,温度平衡时间2 min。每组测量10~50 次,依数据重现性而定。每次测定进行3 次,结果取3 次的平均值。
1.3.7 巯基含量的测定
蛋白质样品巯基(包括暴露巯基和总巯基)含量的测定采用Ellman法,参考Zhao Qiang等[12]的操作,并稍作修改。具体过程如下:将每个样品用去离子水稀释至1 g/100 mL。为了测定暴露巯基含量,将0.5 mL 1 g/100 mL蛋白质溶液加入到2.5 mL Tris-甘氨酸缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、0.004 mol/L EDTA,pH 8.0)中,并用含有8 μmol/L尿素的上述缓冲液测定总巯基含量。然后向缓冲液中加入0.02 mL Ellman’s试剂(4 mg/mL DTNB加入Tris-甘氨酸缓冲液中)。接着将溶液在室温下孵育15 min,并通过紫外-可见分光光度计在412 nm波长处测定吸光度。巯基含量以每克蛋白所含巯基的物质的量表示,按式(1)计算。

式中:A412nm为412 nm波长处的吸光度;ρ为大米谷蛋白溶液质量浓度/(mg/mL);D为稀释因子。
1.3.8 表面疏水性的测定
使用8 mmol/L 1-苯胺基-8-萘磺酸盐(溶于10 mmol/L磷酸盐缓冲液,pH 7.2)作为荧光探针。使用相同的缓冲液将每个样品稀释至0.002 5、0.00 5、0.01、0.015、0.02 g/100 mL 5 个质量浓度。将20 μL 1-苯胺基-8-萘磺酸盐溶液加入到4 mL各质量浓度样品溶液中。使用分光荧光光度计,测定荧光强度(激发波长和发射波长分别为365 nm和484 nm)。以系列稀释样品溶液的荧光强度-蛋白质量浓度图的初始斜率表征溶液的表面疏水性指数(H0)。
1.3.9 差示扫描量热法测定
将约10 mg的1 g/ mL样品置于铝盘中并精确称质量,然后将铝盘密封。温度从20 ℃升至100 ℃,5 ℃/min。使用空盘作为参考。然后记录每个样品的峰值温度(Tp)和焓变(ΔH)。
1.3.10 FTIR分析
将蛋白样品与KBr经干燥处理后,称取约5 mg样品与200 mg KBr研磨均匀,然后压片,测定FTIR。扫描范围4 000~400 cm-1,分辨率4 cm-1,扫描次数32 次。谱图采用Omnic 8.0软件和Peakf i t 4.12软件进行分析。
1.3.11 流变性能的测定
配制5 g/100 mL蛋白溶液,采用DHR-2型流变仪测定样品表观黏度,选用直径为40 mm不锈钢平板夹具,设置间隙为1 mm,温度25 ℃,在1%应变条件下,测定剪切速率为0.1~1 000 s-1的黏度动态变化。保持剪切速率为1 000 s-1,持续60 s,检测剪切应力对时间的变化。
1.3.12 乳化活性和乳化稳定性的测定
乳化活性及乳化稳定性采用比浊法测定[13-14]。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)测定方法:在圆底离心管中加入16 mL 0.1 g/100 mL的样品溶液和4 mL大豆油,用匀浆机以12 000 r/min高速剪切1 min,立即从底部0.5 cm处移取乳状液50 µL,加入5 mL 0.1 g/100 mL十二烷基硫酸钠溶液稀释,漩涡振荡混匀,在500 nm波长处测吸光度A0,10 min后再次移取50 µL乳状液,用十二烷基硫酸钠溶液稀释后测定其吸光度A10。其计算如式(2)、(3)所示。
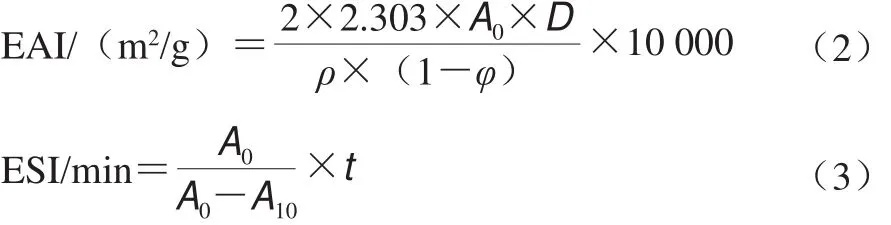
式中:ρ为样品溶液质量浓度(0.001 g/mL);φ为油相所占体积分数(20%);D为稀释倍数;t为时间(10 min)。
1.4 数据统计与分析
采用Origin 8.5软件对实验数据进行统计分析,其中每组实验或分析重复数为3 次,数据以平均值±标准差表示。显著性分析采用ANOVA,并进行Tukey test法检验。
2 结果与分析
2.1 扫描电子显微镜分析
谷蛋白热聚集体的微观结构与其性质密切相关,利用扫描电子显微镜观察了不同压力处理下的米谷蛋白热聚集体的微观结构,如图1所示。天然大米谷蛋白为片状结构,在经过热处理后有致密网络状结构生成,而经高压微射流处理的米谷蛋白热聚集体,观察到明显的网络状结构,且随着压力的增大,网状结构由致密且排列有序的网状结构变得松散且无序。

图1 高压微射流处理的大米谷蛋白聚集体的扫描电子显微镜图Fig.1 Scanning electron microscopic analysis of rice glutelin aggregates treated by HPM
2.2 高压处理对热聚集谷蛋白粒径的影响
米谷蛋白样品的粒径和蛋白质多分散系数如图2所示。NRG的体积平均粒径(101.11 nm)显著小于HRG(146.93 nm)(P<0.05),表明蛋白发生了热聚集。在35 MPa和70 MPa的压力处理下聚集体的粒径进一步增大,分别为183.87 nm和184.77 nm,表明高压使蛋白聚集体颗粒疏松且连续性更高(图1),粒径增大,这与高压处理其他蛋白研究中对粒径影响的结果[15-16]不一致;在更高的压力(105 MPa和140 MPa)作用下,谷蛋白聚集体的粒径减小,分别为155.03 nm和156.83 nm,说明蛋白质聚集体在某种程度上发生了解聚。在加热期间,蛋白质经历变性,随后聚集,通过共价和非共价相互作用。微射流处理可显著增大热聚集的粒径(P<0.05),这可能主要归因于高压微射流的剪切作用破坏了米谷蛋白纤维化聚集体的非共价键。
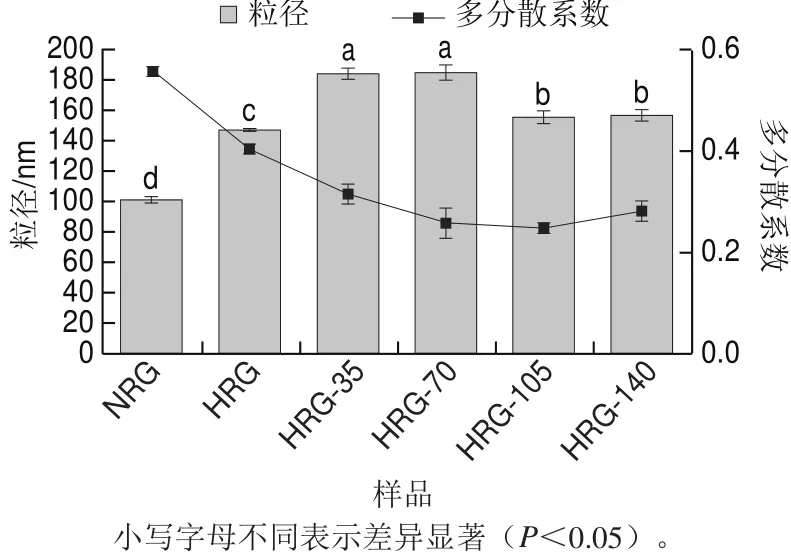
图2 高压微射流处理对聚集体粒径的影响Fig.2 Effect of HPM on particle size of aggregates
一般来说,多分散系数越小,说明分散体系中粒径分布范围越小,颗粒分散性越好。从图2中可以看出,经高压微射流处理的热聚集谷蛋白多分散系数在0.25~0.32之间,较NRG的0.56和HRG的0.41小。随着压力的增大,多分散系数没有明显的变化,但都小于对照组,说明微射流处理改变了蛋白分散体系中颗粒粒径的分散范围,使粒径分布范围减小,蛋白质更容易分散在溶液中。
2.3 ζ电位变化
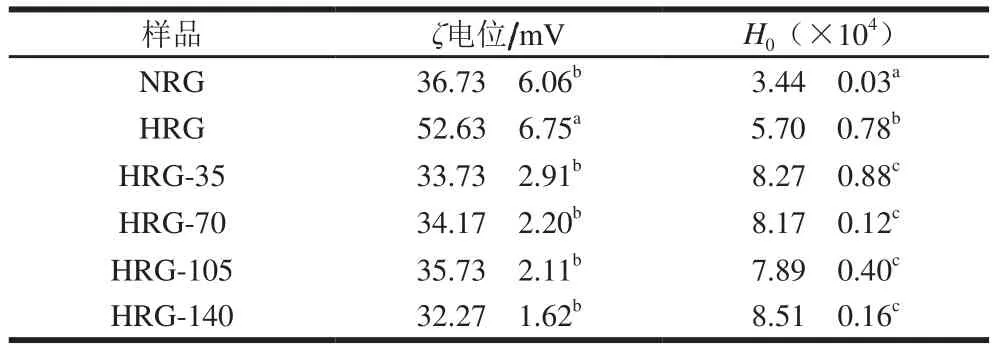
表1 高压微射流处理对米谷蛋白聚集体ζ电位和表面疏水性的影响Table1 Effect of HPM on ζ potential and surface hydrophobicity of rice glutelin aggregates
颗粒的表面电荷不仅可以影响其稳定性,而且可以影响与其他颗粒的相互作用[17]。如多糖通常与蛋白质相互作用以形成可导致表面电荷变化的蛋白质-多糖配合物[18]。ζ电位可能受到许多因素的影响,如盐浓度、pH值和温度[19]。高压微射流对米谷蛋白ζ电位的影响见表1。在酸性pH值下,NRG的ζ电位在36.73 mV附近,而酸法热处理后HRG的ζ电位发生了显著的变化,从36.73 mV显著上升到52.63 mV(P<0.05)。HRG具有较高的表面电荷,具有比NRG更高的正ζ电位,这与文献报道的有关乳清蛋白的研究结果[20]相一致,表明HRG加强了静电排斥,以抵抗进一步的聚集。同时HRG体系很稳定,通常胶体体系ζ电位绝对值超过20 mV(阴性或阳性),即为相对较稳定。在所施加压力的范围内,微射流处理对HRG的ζ电位均未产生显著的影响(P>0.05)。
2.4 高压处理对米谷蛋白热聚集体表面疏水性的影响
表面疏水性可以反映蛋白质表面疏水性基团的数量,它决定蛋白质分子间相互作用的能力,对蛋白质结构的稳定性、功能性质及构象具有重要的作用。如表1所示,NRG、HRG及HRG经高压微射流处理后样品的H0显著增加(P<0.05),表明热处理和压力处理改变了米谷蛋白的分子构象,这可能与谷蛋白分子的解折叠和原先嵌入在分子内部的疏水性氨基酸残基的暴露有关。随后,H0随着微射流压力的增加呈现先降低后增加的趋势,但均不显著(P>0.05),即压力超过35 MPa时H0逐渐减小,且达到140 MPa时又升高。这可能是由于经过酸法热处理和随着压力的增加,谷蛋白的结构进一步展开,同时展开的众多蛋白质分子又在疏水作用和二硫键的作用下重新聚集,谷蛋白聚集体疏水性基团减少使得H0降低;当压力增大到140 MPa时H0增加到最大,表明更大的压力使蛋白聚集体进一步去折叠,抑制了部分二硫键的生成,并且蛋白与重聚的结构发生重组,整体上促进了谷蛋白聚集体结构的展开,疏水性基团的暴露。
2.5 高压处理对米谷蛋白热聚集体暴露巯基含量的影响
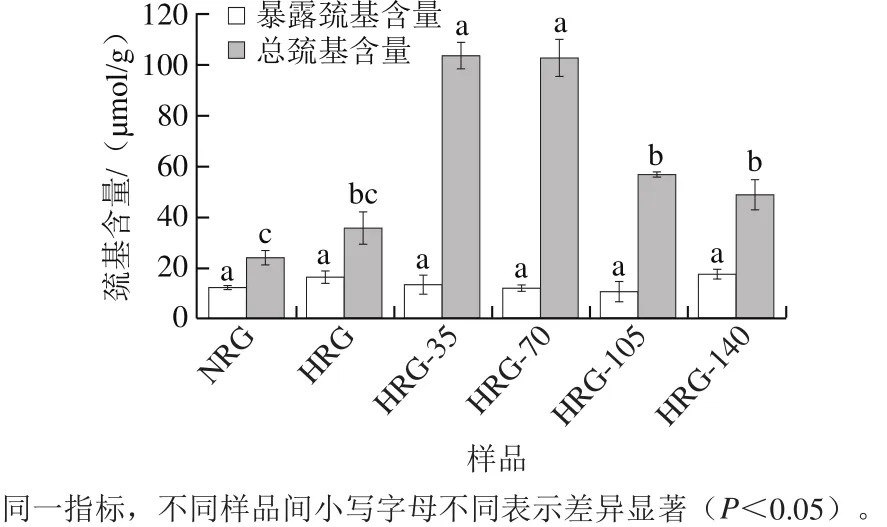
图3 高压微射流处理对米谷蛋白聚集体暴露巯基、总巯基含量的影响Fig.3 Effect of HPM on total sulfhydryl and exposed sulphydryl contents of rice glutelin aggregates
巯基和二硫键是稳定蛋白质分子构象的重要化学键,对蛋白质的功能特性起着重要的决定作用。米谷蛋白经热和高压处理后的巯基含量变化见图3。NRG暴露巯基和总巯基含量分别为12.47 mmol/g和24.18 mmol/g。热处理对HRG暴露巯基含量几乎无影响,总巯基含量稍有增加,表明蛋白结构发生轻微的解折叠;HRG再经不同压力处理,暴露巯基含量仍无明显变化,而样品经35 MPa和70 MPa处理后总巯基含量显著增加(P<0.05),这可能是高压处理使米谷蛋白中二硫键断裂形成巯基的原因,通常热加工或高压处理会诱导发生二硫键/巯基的转换[15,21]。进一步加压处理,总巯基含量继续减少,可能是由于压力达105 MPa后米谷蛋白聚集体进一步解折叠,暴露了原先隐藏的巯基并被氧化重新形成二硫键的结果。
2.6 高压处理对米谷蛋白热聚集体热特性的影响

表2 高压处理对米谷蛋白热聚集体热力学参数的影响Table2 Thermodynamic parameters of rice glutelin aggregates
米谷蛋白样品的差示扫描量热分析结果见表2。差示扫描量热分析图上(图略)显示出不太明显的吸热峰,从焓变(ΔH)结果亦可知。当蛋白样品置于铝盘中从20 ℃升温至100 ℃时,涉及变性(吸热)和聚集(放热)过程,这归因于蛋白质分子内的解折叠和蛋白质分子间形成新的分子键[22],同时,诸如蛋白质量浓度、溶液pH值、离子强度和加热速度还会影响热力学曲线。由表2可知,热聚集后,HRG的Tp较NRG显著增加,ΔH略有下降但不显著,由此表明热聚集的过程中,HRG分散体的热稳定性明显得到改善。高压微射流处理热聚集的米谷蛋白HRG,其Tp和ΔH的变化不是仅由热聚集的变化引起的,表明高压微射流处理对热稳定性的改善有限;同时,随着压力的增大,Tp先增大后减小,ΔH的变化规律不明显;而HRG-70的变性温度最高,ΔH相对最小,表明该压力下米谷蛋白在进一步聚集,HRG的热稳定性可受高压的影响,这与Yan Wei等[15]在高压处理蛋黄方面的发现一致。
2.7 FTIR分析
采用FTIR计算每个组成的峰面积并对曲线进行拟合等[23],大米谷蛋白聚集体的二级结构组成见表3。相比于NRG,加热处理导致HRG中β-折叠结构含量减少,β-转角、α-螺旋和无规卷曲结构含量增加;并且随着处理压力的增加,β-折叠结构进一步主要转化为β-转角和非天然α-螺旋结构,揭示了热加工和高压处理过程诱导蛋白质部分结构的展开,且高压处理对结构改变起主导作用,这些与上述讨论的蛋白质的表面疏水性结果保持一致。实际上,β-转角结构被认为是维持蛋白质高度有序结构的产物,并且反向平行的折叠结构可以在聚集的蛋白质分子中形成,这也是蛋白质结构热稳定性提高的原因[24]。综上可知,大米谷蛋白经过加热和高压处理后导致的β-折叠构象通过展开转变成高度有序的超分子结构,伴有更强的分子内部氢键,由此改善了蛋白的功能性质。

表3 FTIR估算分析大米谷蛋白聚集体的二级结构组成Table3 Secondary structure composition of rice glutelin aggregates estimated by Fourier transform infrared (FTIR) spectroscopy
2.8 高压处理对大米谷蛋白热聚集体流变性能的影响
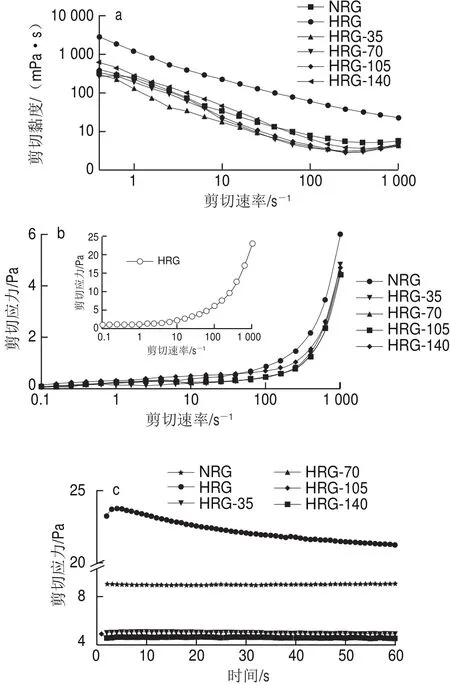
图4 大米谷蛋白聚集体表观黏度(a)和剪切应力与剪切速率(b)及剪切应力与剪切时间(c)的关系Fig.4 Relationships between shear rate and apparent viscosity (a)and shear force (b), and between shear stress and shear time (c) of rice glutelin aggregates
如图4a所示,随剪切速率的增加,所有样品的表观黏度下降,出现剪切变稀现象,表现出典型的假塑性流体特征。NRG和经高压处理的HRG的表观黏度相当,均较HRG的表观黏度小,并且存在先下降后上升趋势,与HRG存在明显差异。表观黏度差异性产生的原因可能是热聚集导致HRG纤维化结构紧密度较高,其悬浊液表观黏度较大,经高压处理后分子结构展开,颗粒度增大,蛋白亲水性增强,表观黏度降低。随剪切速率增大表观黏度缓慢上升,可能主要是与大米谷蛋白溶液热-高压处理致凝胶结构的形成有关,且随剪切速率增加结构愈致密,因而表观黏度上升。图4b中,剪切应力随着剪切速率的增大而升高;在0.1~1 000 s-1的剪切速率范围内,HRG显著大于其他样品的剪切应力;经高压处理的HRG的剪切应力差别不大;在大于100 s-1的剪切范围内,NRG大于经高压处理HRG的剪切应力。一般来讲,蛋白溶液的流变性质通过各种力的组合来确定,力主要取决于分散体的分子结构。此外,蛋白分散体的流动行为可以受颗粒尺寸和尺寸分布以及颗粒形状和颗粒变形性的影响[25-27]。由此看来,热处理的HRG的剪切应力特征的出现应该与其颗粒聚集形状及颗粒的较难变形性有关。按照幂定律方程τ=Kγn的计算,n值介于0.29~0.44之间,验证此蛋白溶液为假塑性流体,同时HRG的K值显著高于其他样品,表明HRG溶液的稠度较大,符合实验结果。在剪切速率为1 000 s-1的作用时间模式下的剪切应力变化如图4c所示(样品的表观黏度变化趋势及样品间的差别与此一致,故不再赘述)。HRG的剪切应力显著高于其他样品,且数值逐渐变小,表明其蛋白结构在剪切作用下发生变化,分子间相对运动变得容易;其他样品的变化趋势不明显,NRG的剪切应力显著高于微射流处理的HRG样品,同时随着处理压力的增大,剪切应力逐渐减小,表明微射流处理可引起大米谷蛋白热聚集体结构的变化,从而使得其溶液剪切应力(同时表观黏度)显著变化。
2.9 高压处理对米谷蛋白热聚集体乳化性的影响
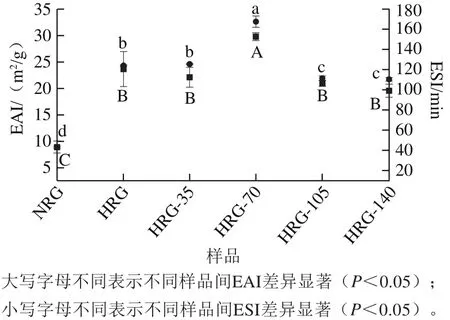
图5 高压微处理对米谷蛋白聚集体乳化性和乳化稳定性的影响Fig.5 Effect of emulsifying activity index on emulsifying stability index and emulsifying stability index of rice glutelin aggregates
EAI表示稀释乳液中稳定界面处每单位质量蛋白质的覆盖面积,ESI表示单位时间内相同稀释倍数乳液的稳定性[28]。由图5可知,HRG与NRG相比,EAI和ESI在热聚集后显著增加(P<0.05),此结果类似于热处理后乳清蛋白EAI的变化趋势,随着热处理程度的增加乳清蛋白ESI也有所增加[23]。HRG-35的EAI和ESI与HRG相比没有显著差异(P>0.05),HRG-70的EAI和ESI较HRG显著增加(P<0.05)。高压处理的米谷蛋白热聚集体表面疏水性显著增加,颗粒尺寸增大以及表观黏度降低,有利于米谷蛋白溶液EAI和ESI的改善。油滴表面上吸附的蛋白质紧密排列,这相当于在油-水界面形成连续的蛋白质膜[29]。HRG经105 MPa处理后乳液的EAI和ESI又有所降低,可能由于更高的压力使聚集体结构遭到破坏,破碎成更小的粒子,吸附在油-水界面的蛋白总量较少,从而导致乳化活性下降[30]。
3 结 论
本实验以自制籼米谷蛋白为原料,制备米谷蛋白纤维化热聚集体并经过不同压力处理,研究高压微射流处理对米谷蛋白热聚集体性质和结构的影响,主要研究发现如下:HRG有着致密网络状结构,较大的粒径,热稳定性和结构稳定性较高,其溶液体系稳定,表观黏度高;随着处理压力的增大,HRG结构变得疏松,粒径增大但分布范围减小,总游离巯基含量先增加后减小,二级结构组成α-螺旋、β-转角含量增加,β-折叠含量减少,乳化性及其稳定性呈现先上升后下降趋势;ζ电位和表面疏水性的变化较小,高压对热稳定性有一定影响,表观黏度变化明显;微射流处理HRG时,低压会使蛋白进一步聚集,较高的压力则会使其解聚;70 MPa处理的HRG具有较好的乳化特性及热稳定性。本研究为高压微射流今后在食品工业中的应用提供数据支持。

