食用色素藻蓝蛋白对非小细胞肺癌A549细胞体外增殖和凋亡的影响
郝 帅,闫 燕,李 爽,黄伟伟,王成涛,*
(1.北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048;2.北京诺禾致源生物信息科技有限公司,北京 100083)
食品着色剂(食用色素)是食品添加剂的重要组成门类,据统计,全球对食用色素的年需求量超过80万 t[1]。近年来,随着人们生活水平的提高以及对健康的关注,除了用于改善食品的色泽以外,功能性食用色素越来越受到人们的青睐,新型“健康友好型”功能食用色素已成为天然食品着色剂的研究热点[2-5]。
藻蓝(C-phycocyanin,C-PC)又称藻蓝色素蛋白,是一种普遍存在于蓝藻、螺旋藻中的捕光色素复合体。藻蓝蛋白主要由脱辅基蛋白亚基(α、β)和藻蓝素辅基结合形成,以完整的六聚体结构存在于细胞内,担任能量的传递和贮存功能[6]。在GB 2760ü2014《食品安全国家标准 食品添加剂使用标准》中,藻蓝已被列为我国允许使用的天然食品着色剂,可应用于糖果、口香糖、冰激凌、饮料等行业中[7]。与目前广泛使用的醇溶性靛蓝色素不同,藻蓝不仅具有优良的水溶性,而且兼有抗氧化、抗炎、抗衰老等多种生理活性功能,同时不产生毒副作用,是一种极具开发潜力的功能性安全食用色素[8-10]。因此,深度研究其生物活性功能是进一步开发利用藻蓝的必要基础。
藻蓝的抗肿瘤活性是目前研究热点之一。早在2003年,Pardhasaradhi等就发现藻蓝蛋白能够通过下调癌基因Bcl-2的表达而抑制大鼠腹腔组织细胞瘤BC-8细胞的体外增殖能力[11];此外,有研究表明藻蓝对肝癌、乳腺癌、结肠癌、卵巢癌等多种癌症细胞也具有不同程度的抑制作用,Roy[12]和Basha[13]等发现藻蓝蛋白能够抑制肝癌HepG2细胞的增殖并诱导其凋亡;Li Bing[14]、Saini[15]以及Yang Peng[16]等通过研究证实藻蓝蛋白同样能够抑制乳腺癌、结肠癌以及宫颈癌细胞的增殖。另外Pan Ruowang[17]和Ying Jun[18]等在卵巢癌SKOV-3细胞中揭示了藻蓝蛋白可能通过调控Akt和MAPK等信号通路的活性来诱导SKOV-3细胞的凋亡[16-17]。近年来关于藻蓝蛋白对于肺癌特别是非小细胞肺癌的研究还并不多,Bingula[19]和Li Bing[20-21]等发现全反式维甲酸和甜菜碱分别与藻蓝蛋白复配后能够抑制肺癌A549细胞的增殖[19-21]。肺癌是我国第一大癌症,大约每年有近60万肺癌病人,已然成为威胁我国人民健康的“第一杀手”[22],其中非小细胞肺癌则是最常见的肺癌类型之一,占所有肺癌的80%左右。因此,本研究以一种典型的非小细胞肺癌A549细胞系为模型,评价藻蓝蛋白对A549细胞体外增殖、凋亡以及周期分布等的影响,研究结果能够为进一步开发天然无副作用的抗肿瘤功能食用色素提供理论依据。
1 材料与方法
1.1 材料与试剂
人类肺癌细胞A549,由北京市食品添加剂工程技术研究中心实验室自主保存。藻蓝蛋白样品(质量分数90%~95%左右)由内蒙古农业大学惠赠。
特级胎牛血清 康源生物技术有限公司;Annexin V/PI染色试剂盒、脱脂奶粉 美国BD公司;实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)相关试剂 天根生物技术有限公司;Western blot相关单克隆抗体 美国Cell Signaling Technology公司;RIPA细胞裂解液、PMSF蛋白酶抑制剂北京鼎国昌盛生物技术有限公司;Western Blot化学发光液、聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜美国Millipore公司。
1.2 仪器与设备
BioSpectrum凝胶成像仪 美国UVP公司;超净工作台 上海博迅医疗生物仪器股份有限公司;漩涡振荡器德国IKA公司;BSA224S型数字电子天平 德国Sartorius公司;CFX96 Touch qPCR检测系统 美国Bio-Rad公司;SpectraMax i3连续波长多功能酶标仪美国MD公司;流式细胞仪FACSJAZZ 美国BD公司;恒温CO2细胞培养箱 德国Heraeus公司。
1.3 方法
1.3.1 细胞培养
将A549细胞株用含体积分数10%胎牛血清、质量分数1%青霉素-链霉素的DMEM培养液置于37 ℃、5% CO2的相对饱和湿度孵箱中培养,使细胞贴壁生长。
1.3.2 MTT法测定细胞的存活率
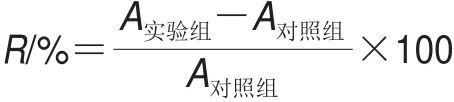
取生长状态良好的细胞,利用血球计数板计数调整细胞悬液浓度,铺板使待测细胞调密度至每孔5 000 个/100 μL,5% CO2,37 ℃孵育12 h,加入不同浓度的藻蓝蛋白培养液(终浓度为0、0.6、1.2、2.4、4.8、9.6、19.2 μmol/L),每个浓度做4 个复孔,分别以不同的时间梯度进行培养后,加入10 μL 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)溶液,继续孵育4 h,加入100 μL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-HCl裂解液,第二天用酶标仪于570 nm波长处测各孔吸光度(A)。根据下式计算细胞存活率(R)。
1.3.3 MTT法测定细胞生长曲线
利用血球计数板计数,以5 000 个/100 μL每孔的细胞量接入96 孔板中正常培养,37 ℃正常培养12 h后分别用0、1.2、2.4、4.8 μmol/L浓度的藻蓝蛋白溶液处理细胞,同时在第一组细胞加入10 μL MTT,4 h后每孔加入100 μL SDS-HCl裂解液,第二天用酶标仪在570 nm波长处测各孔吸光度作为第0天测量值(每个测量组做4 个平行复孔)。以后每天按同一标准加入10 μL MTT,4 h后加100 μL SDS-HCl裂解液,12~16 h后测量吸光度,连续测定5 d,记录实验数据;统计细胞生长情况。以横坐标为时间,纵坐标为吸光度,绘制细胞生长曲线。
1.3.4 倒置显微镜下观察藻蓝蛋白对A549细胞形态的影响
取生长状态良好的细胞,利用血球计数板计数调整细胞悬液浓度,以每孔20 000 个细胞的密度接种于6 孔板中,37 ℃正常培养12 h后加入藻蓝蛋白(0、1.2、2.4、4.8、9.6 μmol/L)分别处理细胞24、48 h和72 h,倒置显微镜下观察细胞形态变化并拍照。
1.3.5 流式细胞仪检测肺癌A549细胞的早期、晚期凋亡率
取生长状态良好的细胞接种在25 cm2培养瓶中培养24 h,加入0、1.2、2.4、4.8 μmol/L的藻蓝蛋白处理48 h,胰酶消化离心后,用100 µL双染孵育液将洗干净的细胞沉淀重悬,往重悬液中先加入5 µL AnnexinV-FITC染液,再加入5 µL碘化丙啶(propidium iodide,PI)染液,放置在冰上进行20 min避光染色。充分混匀后上机检测细胞的凋亡情况,统计早期凋亡、晚期凋亡的细胞比例。
1.3.6 流式细胞仪检测肺癌A549细胞的周期分布
取生长状态良好的细胞接种在25 cm2培养瓶中培养24 h,加入0、1.2、2.4、4.8 μmol/L的藻蓝蛋白处理48 h,胰酶消化离心后,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2 次,并制成单细胞悬液,于体积分数70%乙醇中4 ℃固定24 h以上,1 000 r/min离心10 min得到固定后的细胞沉淀,用提前4 ℃预冷好的PBS洗涤细胞沉淀2 次,加入RNase A使其终质量浓度为50 µg/mL,37 ℃放置40 min,PI染色后用流式细胞仪检测各组细胞周期分布情况。
1.3.7 qPCR检测细胞凋亡和周期调控基因mRNA的表达
取生长状态良好的细胞接种在25 cm2培养瓶中培养24 h,加入0、1.2、2.4、4.8 μmol/L的藻蓝蛋白处理48 h,胰酶消化后用PBS洗涤2 次,离心收集细胞沉淀。利用TRIzol法提取细胞总RNA,根据提取的RNA量,用5~30 µL DEPC水进行溶解,利用NanoDrop测定RNA浓度。参照试剂盒说明进行cDNA合成。反应体系:10hFast RT Buffer 2 µL、RT Enzyme Mix 1 µL、FQ-RT Prime Mix 2 µL、RNase-Free H2O 5 µL,于42 ℃反应15 min,95 ℃反应3 min。qPCR所使用的扩增引物序列如表1所示。

表1 用于qPCR分析的引物序列Table1 Primer sequences used for quantitative real-time polymerase chain reaction (qPCR)
1.3.8 Western blot检测凋亡相关蛋白表达
取生长状态良好的细胞接种在25 cm2培养瓶中培养24 h,加入0、1.2、2.4、4.8 μmol/L的藻蓝蛋白处理48 h,胰酶消化后收集细胞沉淀,根据细胞沉淀的体积加入适量RIPA裂解液对细胞进行冰上裂解1 h,随后12 000 r/min离心45 min,取上清液,Bradford法测定蛋白浓度。在质量分数12%聚丙烯酰胺凝胶上分离后,将蛋白质转移到PVDF膜上,随后利用质量分数5%的脱脂牛奶室温封闭2 h,以体积比1∶1 000稀释的一抗于4 ℃条件孵育PVDF膜12~16 h。第二天用TBST清洗PVDF膜,每15 min更换一次TBST,洗5~6 次将非特异性结合的一抗洗净,随后将膜用抗兔或抗小鼠的二抗于37 ℃孵育1 h,接着用TBST洗膜5~6 次,每次洗15 min,将非特异性结合的二抗洗净。最后在膜上加入发光液避光孵育5 min,利用凝胶成像仪曝光显影,观察结果。
1.4 数据处理与分析
每个实验重复3 次,取其平均值。采用Microsoft Excel 2010及Design Expert 7.1.3软件对数据进行分析,采用Student T-test双尾检验进行显著性差异分析。
2 结果与分析
2.1 藻蓝蛋白对A549细胞体外生长的影响
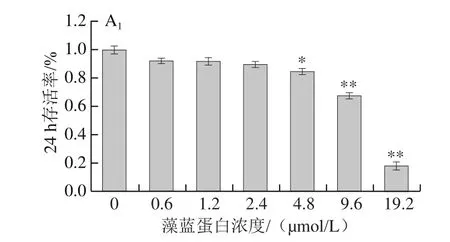
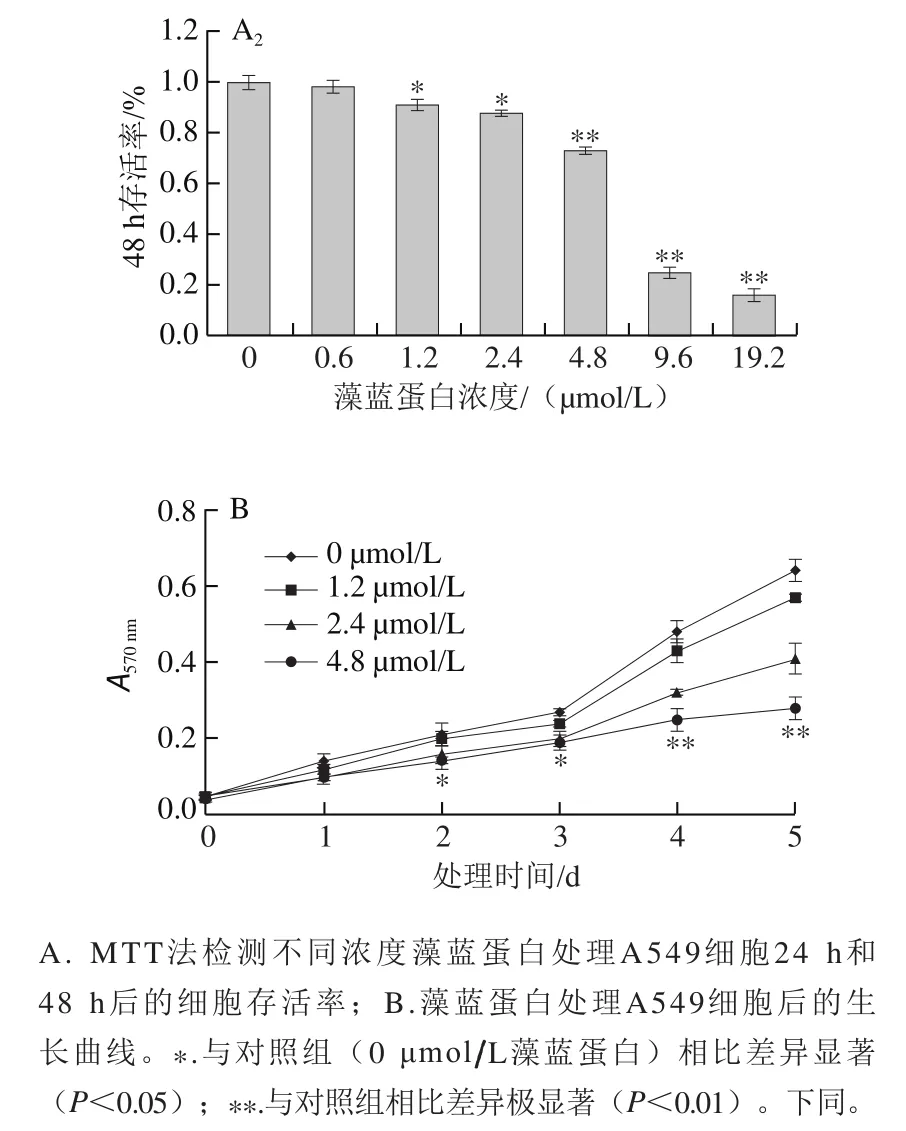
图1 藻蓝蛋白对A549细胞体外增殖能力的影响Fig.1 Effect of C-phycocyanin on the proliferation of A549 cells
由图1A可知,采用藻蓝蛋白处理体外培养的A549细胞24 h或48 h,随着处理浓度的不断增大(0、0.6、1.2、2.4、4.8、9.6、19.2 μmol/L),细胞的存活率均呈现下降趋势,表明细胞的存活状态与藻蓝蛋白存在浓度依赖效应;同时,在相同处理剂量下(4.8、9.6、19.2 μmol/L),细胞在48 h的存活率明显低于24 h,说明细胞存活状态与藻蓝蛋白也存在时间依赖效应。随后选取0、1.2、2.4、4.8 μmol/L的处理剂量进行了细胞增殖检测,如图1B所示,4.8 μmol/L处理组细胞的生长速率从第二天起就显著低于对照组。以上结果表明,藻蓝蛋白对体外培养的肺癌A549细胞具有显著的生长抑制作用。
2.2 藻蓝蛋白对肺癌A549细胞的形态影响
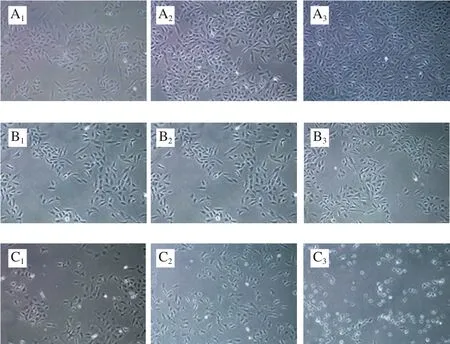

图2 藻蓝蛋白对A549细胞形态的影响(100×)Fig.2 Effect of C-phycocyanin on morphology of A549 cells (100 ×)
如图2所示,未经处理的A549细胞轮廓清晰,呈现梭形,细胞紧密贴壁生长,且未见明显的悬浮细胞。随着藻蓝蛋白处理浓度的不断增大,从2.4 μmol/L作用剂量开始,细胞的形态由梭形变得不规则,形成芽状的突起,部分细胞呈漂浮状不再贴壁;同时,在相同处理剂量下,细胞形态也会随着处理时间的延长而发生非正常改变。当藻蓝蛋白处理浓度达到9.6 μmol/L时,大部分细胞均已脱落,仅观察到极少的细胞贴壁。以上结果表明,较高浓度的藻蓝蛋白能够使A549细胞形态发生非正常改变,初步提示藻蓝蛋白能够引起细胞的凋亡。
2.3 藻蓝蛋白对肺癌A549细胞凋亡程度的情况
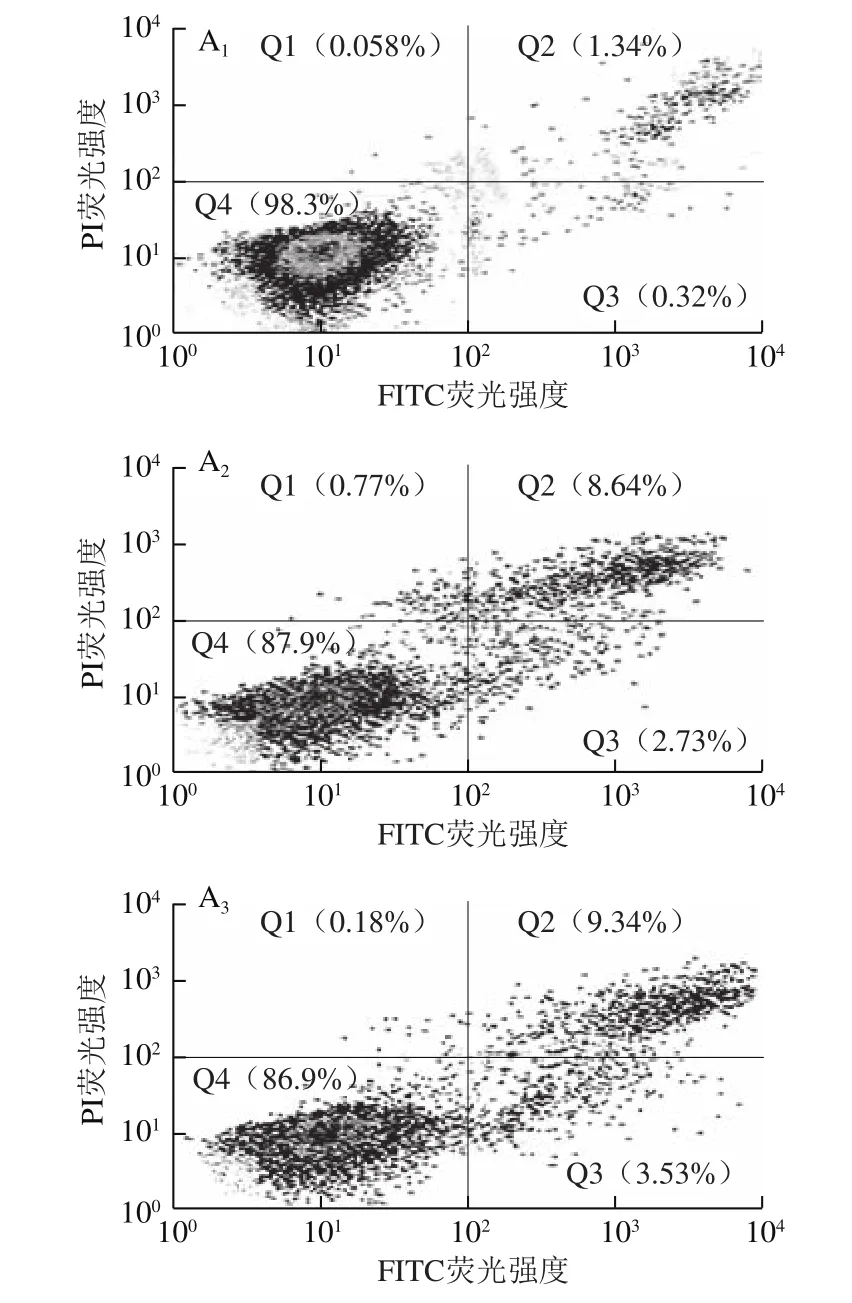
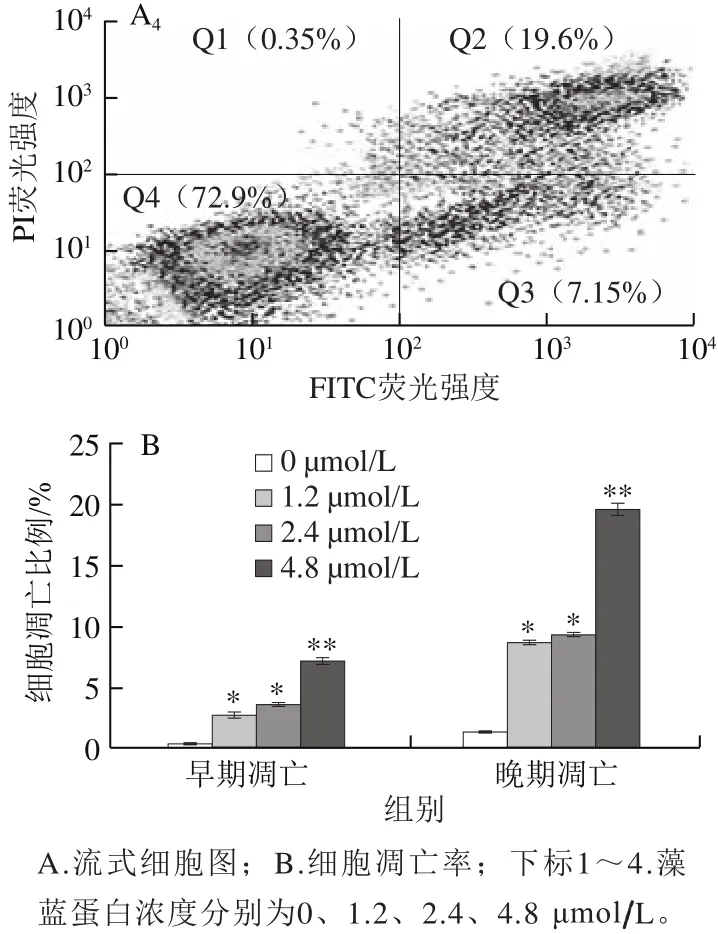
图3 藻蓝蛋白对A549细胞凋亡程度的影响Fig.3 Effect of C-phycocyanin on apoptosis of A549 cells
为了进一步证实藻蓝蛋白是否引起了A549细胞的凋亡,采用流式细胞术对藻蓝蛋白处理48 h后的细胞进行了Annexin V-PI双染凋亡检测。由图3可知,与对照组相比,随着藻蓝蛋白处理浓度的不断增加(0、1.2、2.4、4.8 μmol/L),A549细胞的早期凋亡与晚期凋亡比例均呈现显著的浓度依赖性上调,当处理浓度为4.8 μmol/L时,细胞凋亡比例最大,早期、晚期凋亡率分别达到(8.03f0.32)%和(21.95f1.21)%,表明藻蓝蛋白确实诱导了A549细胞的凋亡。
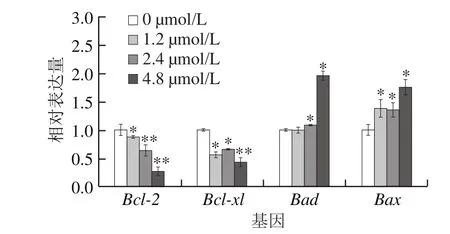
图4 藻蓝蛋白影响A549细胞内凋亡相关基因的转录Fig.4 Transcriptional levels of the genes related to apoptosis in A549 cells after C-phycocyanin treatment
采用荧光定量PCR对凋亡相关基因的转录水平进行了检测。如图4所示,藻蓝蛋白处理后,A549细胞内促凋亡基因Bax、Bad[23]的转录水平发生了显著上调,而凋亡抑制基因Bcl-2以及Bcl-xl[24]的转录水平则呈现相反变化趋势,这与流式细胞术的结果一致。
采用Western Blot方法对细胞内凋亡相关蛋白的表达水平进行了检测。如图5所示,随着藻蓝蛋白处理浓度的不断增加,A549细胞内Bax、Bad蛋白水平出现了明显上调,Bcl-2、Bcl-xL蛋白表达量出现显著降低。以上结果从细胞表型、基因转录水平和蛋白表达水平对细胞的凋亡进行了验证,表明藻蓝蛋白确实能促进体外培养A549肺癌细胞的凋亡,藻蓝蛋白有望作为一种极具潜力的新型抗肺癌功能性食品添加剂。
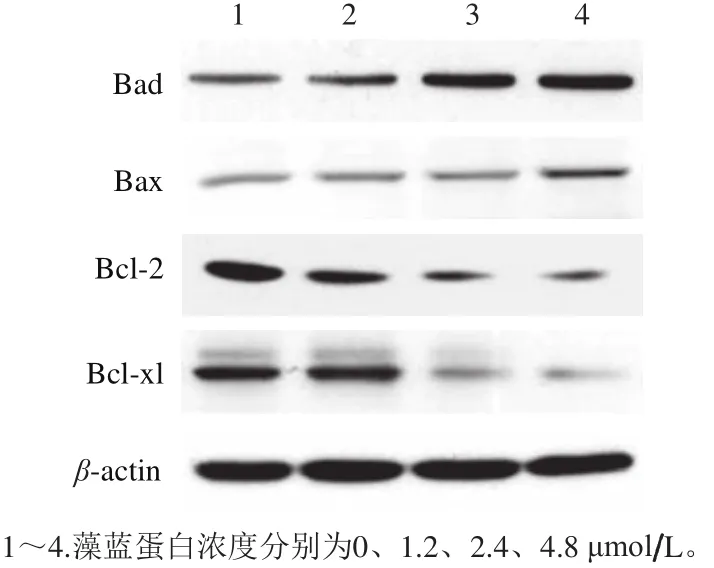
图5 藻蓝蛋白影响A549细胞内凋亡相关蛋白的表达Fig.5 Expression levels of the proteins related to apoptosis in A549 cells after C-phycocyanin treatment
2.4 藻蓝蛋白对肺癌A549细胞周期分布的影响
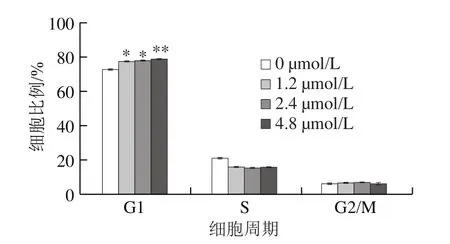
图6 藻蓝蛋白对A549细胞周期分布的影响Fig.6 Cell cycle distribution of A549 cells after C-phycocyanin treatment
为探究藻蓝蛋白是如何引起A549细胞凋亡的,利用流式细胞仪对藻蓝蛋白处理后的细胞周期分布进行了检测。如图6所示,与对照组相比,随着藻蓝蛋白处理浓度的不断增加(0、1.2、2.4、4.8 μmol/L),A549细胞中G1期比例出现增加,S期比例下降。结果表明,藻蓝蛋白能够使细胞阻滞在G1期,无法进入S期进行DNA的复制,影响了正常的细胞周期进程,从而可能引起细胞凋亡的发生。

图7 藻蓝蛋白影响A549细胞周期相关基因的转录Fig.7 Transcriptional levels of the genes related to cell cycle in A549 cells after C-phycocyanin treatment
同时对细胞周期相关基因的转录水平进行了定量PCR检测,结果如图7所示。细胞周期蛋白(Cyclin)E、细胞周期依赖的蛋白激酶(cyclin-dependent kinases,CDK)2以及CDK4作为细胞周期重要的调控因子[25-26],能够促进细胞由G1期向S期转换,而细胞周期调控抑制因子p21、p27则对Cyclin E以及CDK2、CDK4具有抑制作用[27-28]。定量PCR结果显示,藻蓝蛋白处理后,细胞中CyclinE、Cdk2、Cdk4的转录水平均出现了显著下调,p21、p27则出现了显著上调,这些基因的异常调节可能导致细胞不能正常合成G1/S期转换过程所需的蛋白,使细胞阻滞在G1期,这与流式细胞术结果相一致,进一步验证了藻蓝蛋白对细胞周期的调控效应。
3 讨 论
总所周知,癌症是目前严重威胁人类健康的疾病之一。传统治疗癌症的手段主要有手术切除、放疗以及化疗等,但这些方法往往存在易复发、副作用大等缺陷。近年来,一些潜在的具有抗肿瘤活性的营养物质越来越引起广大研究学者的注意,它们对一些特定的癌症有显著的抑制效果;而藻蓝蛋白则是其中重要的一类,其具有安全性高、活性强、无毒副作用等优点,能够为癌症的治疗提供新的思路和方向。
本研究发现,藻蓝蛋白处理体外培养的肺癌A549细胞后,细胞凋亡的比例显著增加。细胞凋亡受到一系列凋亡相关蛋白的调控作用,使细胞能够自发有序地进行程序性死亡,经典的细胞凋亡过程主要受到Bcl-2蛋白家族调控因子的影响。Bcl-2、Bcl-xl、mcl-1等是典型的抗凋亡基因,而Bax、Bad等则是典型的促凋亡基因[29-31]。Bad等促凋亡蛋白能够用过抑制Bcl-2、Bcl-xL的表达而加速细胞的程序性死亡进程,从而促进细胞的凋亡。本研究中,A549细胞经藻蓝蛋白处理后,Bad、Bax基因的转录水平和蛋白表达水平均出现了显著上调,而Bcl-2、Bcl-xL的表达水平出现显著降低,因此推断,藻蓝蛋白可能是通过调控经典的Bcl-2蛋白家族信号通路而抑制非小细胞肺癌A549的凋亡。
细胞凋亡与细胞周期是密不可分的两个过程,在细胞处于凋亡的同时,由于存活细胞数量的急剧下降,群体细胞周期的进程必定也受到影响,因此,探究藻蓝蛋白处理后对A549细胞周期分布的影响也至关重要。细胞周期的正常进行依赖于Cyclin以及CDK的共同调节。CyclinE/CDK2、CDK4等是调控细胞周期G1/S转换点的重要蛋白,其正常表达能够使细胞顺利进入S期进行DNA的复制;CyclinA等蛋白主要促进细胞由S期进入G2期;而CyclinB则主要调控细胞由分裂间期进入M期的过程;除此之外,周期抑制因子p21与p27可以作用多种CDKs,抑制G1/S的转换以及细胞周期的进程[32-33]。前期的研究发现藻蓝蛋白对A549细胞的体外增殖具有显著抑制,但作用于细胞周期进程的具体时期尚不明确。定量PCR结果显示,藻蓝蛋白处理后,A549细胞的CyclinE、Cdk2、Cdk4出现了显著下调,周期抑制因子p21、p27的表达出现显著上调,可以推测,这些基因的异常调节可能导致细胞不能正常合成G1/S期转换过程所需的蛋白,使细胞阻滞在了G1期,从而影响了细胞的生长。研究结果充分证实了藻蓝蛋白对A549非小细胞肺癌的抑制作用,为开发新型安全的功能性食用色素提供了有力的理论支持,具有潜在的应用价值。

