水稻矮缩病毒Pns6和P8蛋白在病毒侵染水稻原生质体后的表达
张洁 宛柏杰 2, 尚鹏祥 丁新伦 杜振国 吴祖建*
水稻矮缩病毒Pns6和P8蛋白在病毒侵染水稻原生质体后的表达
张洁1,#宛柏杰1, 2,#尚鹏祥1丁新伦1杜振国1吴祖建1,*
(1福建农林大学 植物病毒研究所/福建省植物病毒学重点实验室/闽台作物有害生物生态防控国家重点实验室, 福州 350002;2江苏沿海地区农业科学研究所, 江苏 盐城 224000;#共同第一作者;*通讯联系人, E-mail: wuzujian@126.com)
【目的】为明确水稻矮缩病毒, RDV) Pns6和P8蛋白在病毒侵染水稻原生质体后的表达动态,【方法】利用PEG介导的病毒侵染原生质体体系,通过免疫荧光和电镜技术分析Pns6、P8蛋白以及病毒粒体在水稻原生质体中的定位;同时,通过Western blot和实时荧光定量PCR分析Pns6和P8蛋白及其RNA在水稻原生质体中的积累量。【结果】病毒接种水稻原生质体48 h后,Pns6蛋白在细胞质中可以形成类似于病毒原质(viroplasm)的点状内含体,P8蛋白也大量的表达。同时,病毒粒体在水稻原生质体中也形成内含体状的结构。病毒接种水稻原生质体12 h后,均可检测到Pns6和P8蛋白的表达,并且在36 h后达到最高值。病毒接种水稻原生质体后,RNA在24 h时表达量达到最高,RNA在36 h时表达量达到最高。【结论】RDV侵染水稻原生质体后,Pns6和P8蛋白均有表达,并且病毒也可能通过形成病毒原质来完成病毒在寄主细胞的复制和装配。
水稻矮缩病毒;水稻原生质体;Pns6蛋白;P8蛋白
水稻矮缩病毒(, RDV)属于呼肠孤病毒科()植物呼肠孤病毒属()。该病毒是水稻矮缩病的病原,广泛分布于朝鲜、日本、菲律宾等水稻种植区,在我国主要分布于福建、云南和海南等南方稻区。该病毒可以通过黑尾叶蝉()和电光叶蝉()等传播,并且可以通过卵将病毒传播给子代[1]。水稻矮缩病在水稻生长发育整个时期都可以发病,大暴发年份可造成水稻严重减产、甚至绝收[2, 3]。
RDV全基因组由12条双链RNA(S1~S12)组成,编码的蛋白可以分为两类,其中包括7个结构蛋白(P)和5个非结构蛋白(Pns)。其中,P1具有依赖于RNA的RNA聚合酶的特殊结构序列模式[4]。P2位于病毒粒子的最外层,在病毒侵染寄主细胞或者介体昆虫传播病毒过程中起重要作用[5, 6]。此外,P2能与水稻贝壳杉烯氧化酶互作,影响赤霉素合成,从而引起水稻矮缩症状[7],并可通过与水稻吲哚乙酸(OsIAA10)的互作来增强病毒的侵染和症状的形成[8]。P3形成的核衣壳蛋白包裹着S1编码的RdRp、S5编码的鸟苷转移酶、S7编码的RNA结合蛋白以及基因组RNA[4, 9]。Pns4是一种磷酸化蛋白,在病毒的组装和运输以及侵染和复制过程中起重要作用[10, 11]。P5为次要核心蛋白,可能具有鸟苷酸转移酶和核苷酸转移酶活性[12]。Pns6为病毒的运动蛋白,且具有ATPase和RNA结合活性[13, 14]。此外,Pns6通过与Pns11互作,而Pns11与Pns12互作,参与形成病毒装配和复制的病毒原质[15, 16]。P7为小核心蛋白,能够结合核酸,并对mRNA有较高的亲和力,能与P1和P5形成蛋白复合体,在病毒装配过程中具有关键作用[17, 18]。P8是病毒最主要的外壳蛋白[19],定位于过氧化酶体并与乙醇酸氧化酶(GOX)互作,推测其参与病毒的复制[20]。P9与P8、P2共同组成病毒外层壳蛋白,可能通过其转录激活活性参与调控相关基因的表达[21, 22]。Pns10能抑制dsRNA诱导的RNA沉默,为沉默抑制子蛋白,在抑制寄主水稻防御病毒侵染中起作用[23]。此外,Pns10在昆虫细胞中形成小管结构,并能将小管延伸至相邻的细胞,从而使病毒在寄主体内快速侵染[24, 25]。Pns11能够与核酸进行非特异性结合,主要是由于其具有N-端锌指结构[26]。此外,Pns11还可以与核仁编码的Fibrillarin蛋白互作,并且可以定位在细胞核和叶绿体中,这揭示了RDV侵染寄主后,可能通过Pns11蛋白与核仁蛋白互作来诱发病害[27],Pns11还可以特异地与水稻S-腺苷甲硫氨酸合成酶(OsSAMS1)互作,诱导产生大量乙烯,促进病毒侵染[28]。Pns12是病毒原质状内含体的主要组成部分,是病毒复制和侵染的主要调控蛋白[15, 16]。
近年,利用介体昆虫培养细胞体系来研究RDV各蛋白的功能等方面取得了较大进展[10, 15, 16, 24, 25]。本研究借鉴介体昆虫培养细胞体系,利用水稻原生质体体系,通过PEG介导的方法解决病毒不能够同步侵染植物寄主的问题,再结合实时荧光定量PCR技术、免疫荧光技术、电镜技术以及Western blot技术等来研究病毒蛋白在原生质体内的表达情况,为进一步研究RDV各基因在植物寄主细胞中的功能奠定基础。
1 材料与方法
1.1 材料
感染水稻矮缩病毒(, RDV)的水稻采自福州市郊区,经RT-PCR鉴定后,在防虫温室中种植保存。Pns6和P8蛋白抗体由本实验室制备保存。
1.2 RDV的提取及侵染
病毒提取方法参考文献[29]进行。称取1 g感染RDV的水稻毒株叶片,70%酒精消毒10 min,无菌水清洗3遍后晾干;将样品剪碎后放入无菌的研钵中,加入石英砂和2.5 mL MMg溶液(0.4 mol/L甘露醇、15 mmol/L MgCl2、4 mmol/L MES, pH 5.7)进行研磨;将充分研磨的样品转移到无菌的离心管中,4℃、7000 r/min条件下离心10 min,去掉石英砂以及残渣,取上清液,4℃、12 000 r/min下离心10 min,再吸取上清,重复离心1次;最后将得到的上清液过滤除菌,即为病毒的粗提液。
参考文献[30]的方法,利用聚乙二醇(PEG)介导病毒侵染原生质体。
1.3 酶解法制备水稻原生质体
用参考文献[30]的方法进行水稻原生质体的制备。取60株培养12~15 d的水稻幼苗,用无菌剪刀剪掉水稻叶片部分保留茎秆;将所取材料切成0.5 mm的细条,放入灭菌的50 mL三角瓶中,加入30 mL 0.6 mol/L甘露醇,28℃、50 r/min黑暗条件下摇动15 min;倒掉甘露醇溶液,将材料置于另一只干净灭菌三角瓶中,并加入20 mL酶液(1.5% 纤维素酶R-10,0.75% 离析酶R-10,0.6 mol/L甘露醇,10 mmol/L MES,10 mmol/L CaCl2,0.1% BSA,pH 5.7),于28℃ 60~80 r/min酶解4~5 h;酶解完毕后加入等体积预冷的W5溶液(154 mmol/L NaCl,125 mmol/L CaCl2,5 mmol/L KCl,2 mmol/L MES,pH 5.7),剧烈震荡15 s后,尼龙网膜过滤;用W5溶液清洗原生质体,1000 r/min下离心5 min后弃上清,重复3~5次后加入MMg溶液,收集原生质体后镜检,在冰上静置40 min备用。
采用参考文献[31]的方法用二乙酸荧光素(FDA)检测水稻原生质体活性。
1.4 免疫荧光标记检测目的蛋白的表达
参考文献[32]的方法进行蛋白的免疫荧光标记。将培养48 h的原生质体4℃、1000 r/min条件下离心5 min后,弃上清;向装有原生质体的离心管中加入4%多聚甲醛固定液,并在室温黑暗条件下放置90 min;4℃、1000 r/min下离心5 min,W5溶液清洗3次,去除固定液;将样品滴加到经过多聚赖氨酸处理过的粘附载玻片上,用吸水纸吸走多余的水;待样品紧贴在载玻片上时,加入适量的5% BSA封闭液封闭45 min;PBS (pH 7.2)洗涤玻片3次,每次5 min;加入1~5 µg/mL标记异硫氰酸荧光素(FITC)的荧光抗体(荧光抗体标记方法参照文献[33]进行),室温避光孵育1 h;用PBS洗涤玻片3次,每次5 min;Leica荧光共聚焦显微镜下观察。
1.5 Western blot检测目的蛋白的表达动态
取等量RDV侵染不同时间段(0 h,12 h,24 h,36 h,48 h,60 h)的水稻原生质体,提取其蛋白后,进行12.5% SDS-PAGE检测,电泳完毕,通过电转法(电压60 V,时间35 min左右)转印到PVDF膜上。Western blot检测方法参照文献[30]进行。通过Image J软件计算条带灰度值,将各时间点目的蛋白与相应时间GAPDH内参蛋白对照样品值进行比较。实验重复3次。
1.6 实时荧光定量PCR检测目的基因的表达动态
利用绝对定量来测定水稻原生质体中Pns6和P8的表达量。将含有RDV目的片段基因(Pns6和P8)的质粒作为标准品,系列梯度稀释至含有103~106个拷贝的模板,以稀释后的标准品作为模板进行实时荧光定量PCR,以标准品浓度的稀释倍数为横坐标,以Ct循环数为纵坐标分别建立目的基因的标准曲线。
使用康为RNAprep Pure植物总RNA提取试剂盒提取侵染不同时间(12 h,24 h,36 h,48 h,60 h)的水稻原生质体RNA。使用天根FastQuant cDNA第1链合成试剂盒进行反转录,将配置好的反转录混合液(10×快速RT缓冲液2 µL,RT酶混合液1 µL,FQ-RT 引物混合液2 µL,补足无RNA酶的ddH2O至20 µL)加至去除总DNA的10 µL RNA中,42℃下,孵育15 min;95℃下孵育2 min后放冰上2 min,将cDNA置于−20℃下保存备用。以cDNA为模板,引物对S6-F:5′-TTTCGGGATAATGCTGCTGAC-3′ / S6-R:5′-CCGCCAAATAAGCAAACCA-3′和S8-F:5′-TAC AGCCATCAGCTAAGCCAAA-3′ / S8-R:5′-CCGCA ACAGACCGAAACA-3′分别进行荧光定量PCR,将得到的值分别代入目的基因的标准曲线,计算出样本的拷贝数,每次实验重复3次。
1.7 电镜观察病毒在水稻原生质体中的定位
采用参考文献[34]的方法进行常规电镜切片操作,将RDV侵染24 h后的水稻原生质体进行透射电镜观察。
2 结果与分析
2.1 水稻矮缩病毒(RDV)侵染水稻原生质体
将RDV病毒粒子粗提后进行负染,电镜观察发现病毒粒子形态完整。酶解法获得水稻原生质体,经由FDA来检测原生质体的活性,活性比例在95%以上,且原生质体的完整性好。利用PEG介导的病毒侵染原生质体方法,对制备的水稻原生质体进行侵染,48 h后,分别利用RDV Pns6和P8蛋白抗体进行免疫荧光显微镜观察。对照组中没有检测到荧光信号(图1-A),实验组中Pns6蛋白在细胞质中形成类似于病毒原质状内含体(图1-B)。外壳蛋白P8在细胞质中也大量表达,呈分散状排列,部分形成颗粒状结构(图1-C),说明病毒已经在原生质体中进行了大量复制及装配。
为进一步明确RDV在水稻原生质体中的复制情况,将病毒侵染24 h的水稻原生质体,进行常规电镜切片观察,结果显示,水稻原生质体中可以观察到类似病毒原质的内含体状结构,内有较多病毒粒体存在(图1-D)。
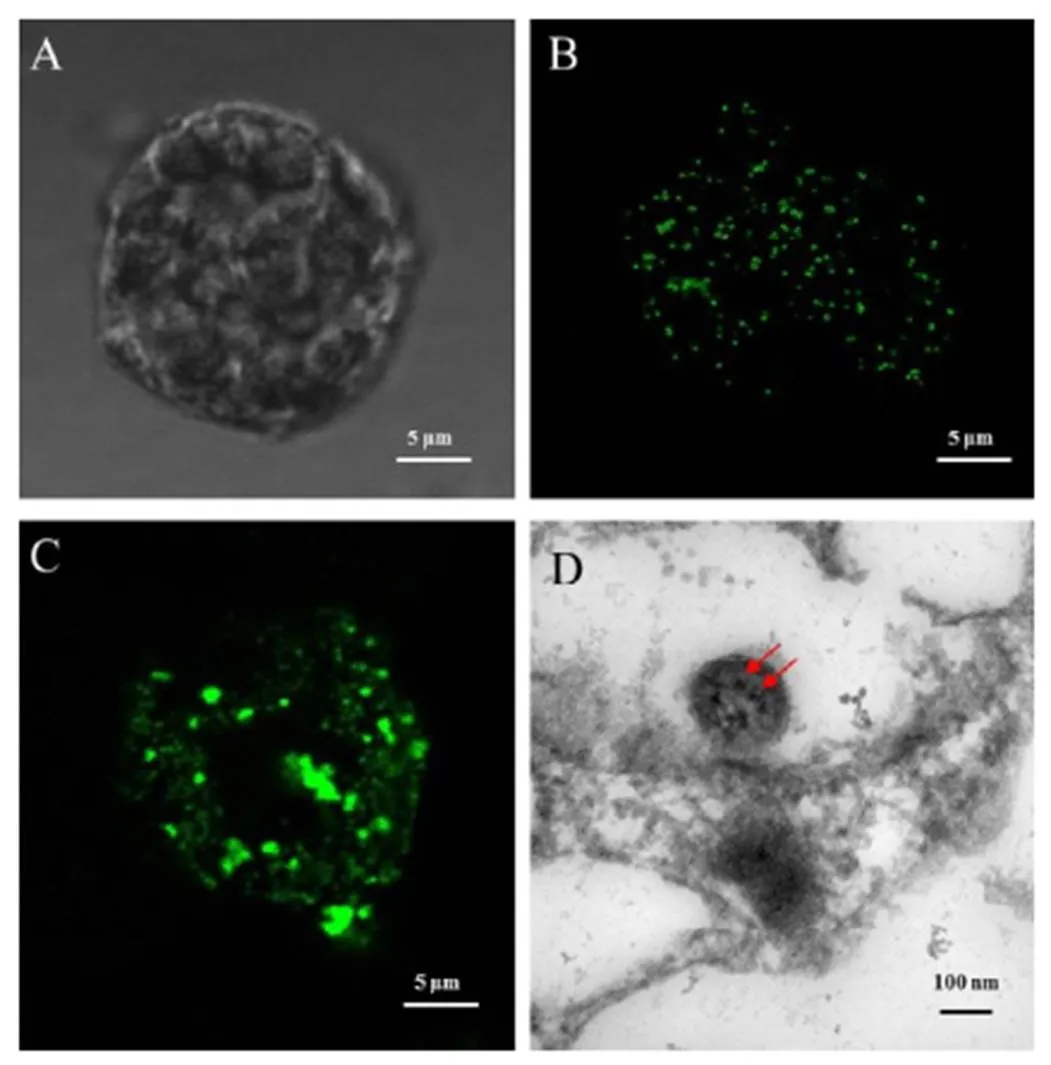
A−阴性对照;B−激光共聚焦显微镜观察Pns6蛋白在水稻原生质体中的定位;C−激光共聚焦显微镜观察P8蛋白的定位;D−透射电镜观察水稻矮缩病毒的定位,箭头示病毒粒体。
Fig. 1. Subcellular localization ofin rice protoplasts under an electron microscope.
2.2 RDV侵染水稻原生质体后Pns6和P8蛋白的表达动态
为明确RDV侵染水稻原生质体后Pns6和P8蛋白的表达情况,对病毒侵染不同时间后的原生质体提取蛋白,分别利用Pns6、P8以及GAPDH蛋白抗体进行Western blot检测。结果显示,病毒侵染原生质体12 h后均可检测到Pns6和P8蛋白的表达(图2-A)。36 h左右两者表达量均达到最高,随后有递减的趋势,但仍保持较高的水平(图2-B)。总体而言,P8蛋白表达量高于Pns6蛋白(图2-B)。
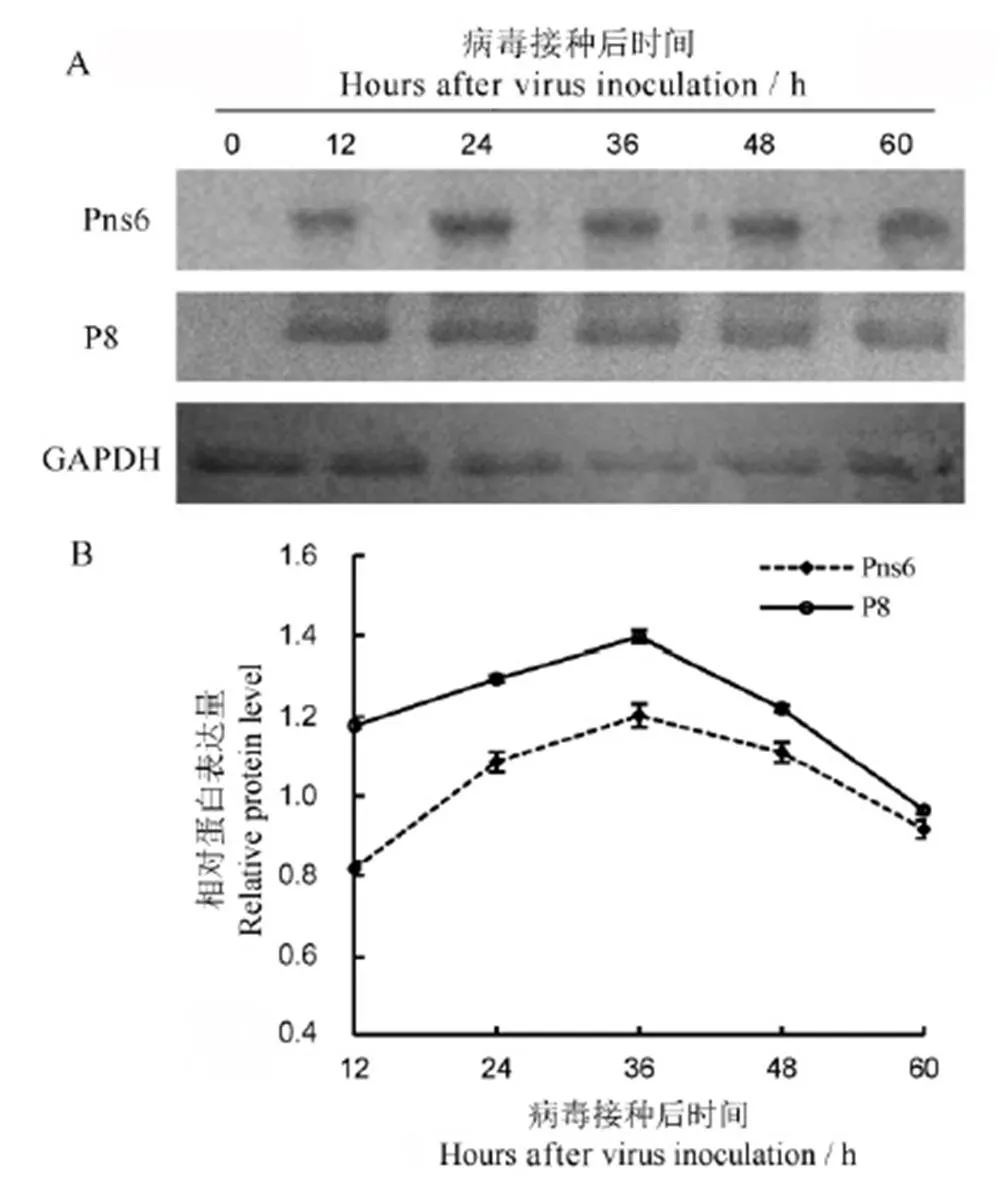
A−蛋白的Western blot; B−相对蛋白表达量。
Fig. 2. Expression of Pns6 and P8 in rice protoplasts after virus inoculation by Western blot.
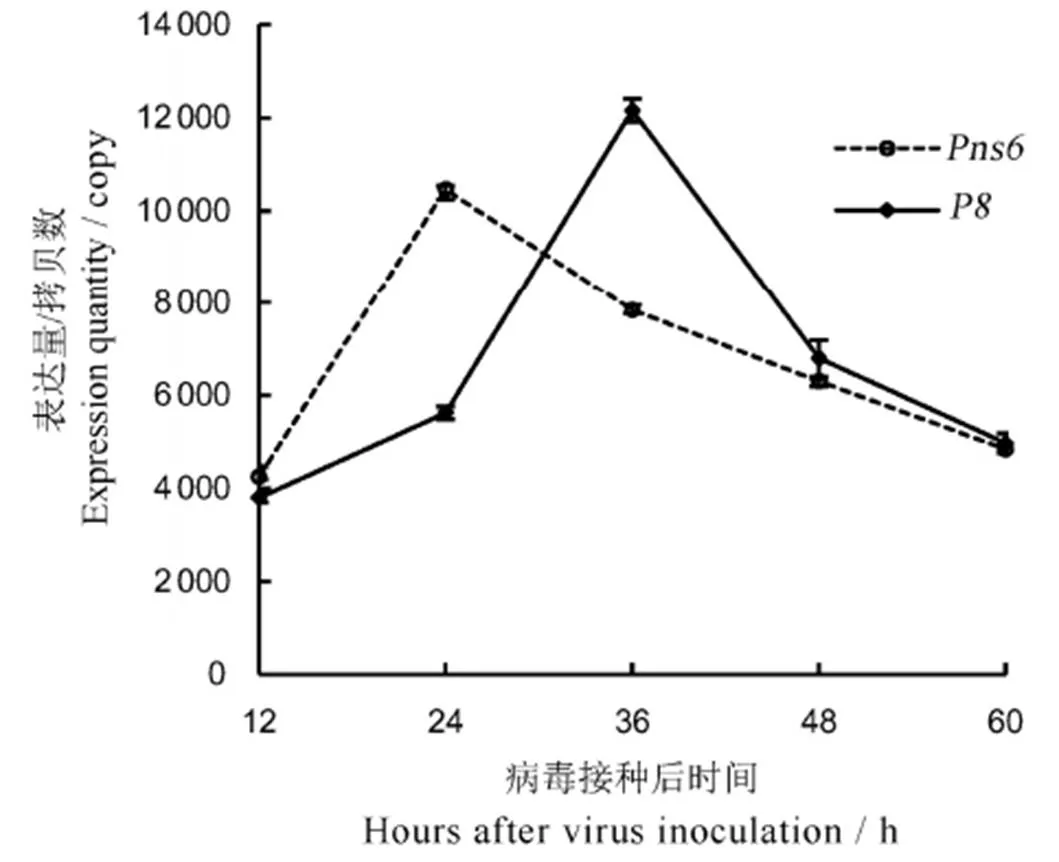
图3 实时定量PCR检测水稻矮缩病毒在侵染水稻原生质体后Pns6和P8 RNA的表达量
Fig. 3. Expression ofandRNA in rice protoplasts after virus inoculation by real-time quantitative RT-PCR.
2.3 RDV侵染水稻原生质体后Pns6和P8 RNA的表达动态
为明确RDV侵染水稻原生质体后和RNA的表达情况,以病毒侵染不同时间后的原生质体提取RNA,进行实时荧光定量PCR检测。结果表明,RNA在24 h时表达量达到最高,36 h时下降为最高值的74.9%,60 h时下降为最高值的46.2%,检测区间内均具有显著性差异(<0.05)。RNA在36 h时表达量达到最高,48 h时下降为最高值的55.9%,60 h时下降为最高值的40.9%,但最后两个检测区间无显著性差异(>0.05)。从整体趋势看,两者的表达量都是先上升后下降(图3)。
3 讨论
与水稻转基因方法相比,利用水稻原生质体瞬时表达系统,在基因表达研究上具有快速简便的特点。本研究利用原生质体体系对RDV在水稻原生质体内的复制和表达情况进行了分析,结果表明RDV侵染水稻原生质体后,在24~36 h达到复制高峰,理论上也是病毒与寄主互作最激烈的阶段。这为利用水稻原生质体研究RDV与寄主互作的最佳时间提供了依据。从整体趋势看,各基因的表达量都是先上升后下降。前期的上升符合病毒指数增长的特征,后期下降可能是因为病毒在原生质体内复制受到了限制,一方面由于寄主体内的资源有限,病毒不可能保持持续增殖;另一方面,寄主在受到病毒侵染后,细胞内的防御机制可能启动,抑制病毒的增殖。荧光定量结果发现RNA先于RNA达到最高值,由此推测病毒优先进行非结构蛋白基因的复制然后再进行结构蛋白基因的复制。研究结果与水稻齿叶矮缩病毒(, RRSV)非结构蛋白Pns10和Pns7以及结构蛋白P8基因的表达保持一致[29, 30, 35]。蛋白定量结果显示P8蛋白表达量要稍高于Pns6蛋白,可能与病毒装配需要大量的结构蛋白有关。Wei等[16]利用昆虫介体细胞培养体系对RDV所有结构蛋白和Pns12蛋白进行共定位,发现除了共定位的黄色荧光还存在大量的标示结构蛋白的绿色荧光,从另一个侧面说明结构蛋白的表达量高于非结构蛋白的表达,我们的结果与之一致。
同时,Wei等[16]发现RDV所有结构蛋白在昆虫介体细胞中均呈弥散状排列,跟Pns12共定位发现,病毒核心蛋白P1、P3、P5和P7等主要定位在病毒原质内部,而外层衣壳蛋白P2、P8和P9等主要定位在病毒原质周边。本研究发现,RDV Pns6呈点状均匀定位在细胞质中,P8呈弥散状定位在细胞质中,并部分聚集为颗粒状结构,这与RDV侵染昆虫培养细胞一致。昆虫介体中,Pns12是形成病毒原质必不可少的,推测P3和Pns11与Pns12直接互作,Pns6通过与Pns11互作而同时被招募到病毒原质中[15, 16]。植物寄主中,RDV Pns6是一个病毒运动蛋白,并具有RNA结合活性,可能参与组织病毒mRNA到病毒原质中[13-16]。本研究结果表明,RDV病毒粒体在寄主原生质体细胞中可能也通过内含体状结构进行复制和装配。然而寄主水稻中,RDV组成病毒原质的主要组分及其功能行使跟昆虫介体是否完全一致有待进一步研究。
谢辞:特别感谢福建农林大学植物病毒研究所的王海涛和杨文婷同学在电镜技术上的指导!
[1] Omura T, Yan J. Role of outer capsid proteins in transmission ofby insect vectors., 1999, 54(1): 15-43.
[2] 谢联辉, 林奇英, 魏太云, 吴祖建. 水稻病毒. 北京: 科学出版社, 2016: 158-182.
Xie L H, Lin Q Y, Wei T Y, Wu Z J. Rice Viruses. Beijing: Science Press, 2016: 158-182. (in Chinese)
[3] 谢联辉, 林奇英. 我国水稻病毒病研究的进展. 中国农业科学, 1984, 17(6): 58-65.
Xie L H, Lin Q Y. Advances in the studies of rice virus disease in China., 1984, 17(6): 58-65. (in Chinese with English abstract)
[4] Suzuki N, Tanimura M, Watanabe Y, Kusano T, Kitagawa Y, Suda N, Kudo H, Uyeda I, Shikata E. Molecular analysis of rice dwarf phytoreovirus segment S1: Interviral homology of the putative RNA-dependent RNA polymerase between plant- and animal-infecting reoviruses., 1992, 190(1): 240-247.
[5] Omura T, Yan J, Zhong B, Wada M, Zhu Y, Tomaru M, Maruyama W, Kikuchi A, Watanabe Y, Kimura I, Hibino H. The P2 protein of rice dwarf phytoreovirus is required for adsorption of the virus to cells of the insect vector., 1998, 72(11): 9370-9373.
[6] Zhou F, Pu Y, Wei T, Liu H, Deng W, Wei C, Ding B, Omura T, Li Y. The P2 capsid protein of the nonenveloped rice dwarf phytoreovirus induces membrane fusion in insect host cells., 2007, 104(49): 19547-19552.
[7] Zhu S, Gao F, Cao X, Chen M, Ye G, Wei C, Li Y. The rice dwarf virus P2 protein interacts with ent-kaurene oxidases in vivo, leading to reduced biosynthesis of gibberellins and rice dwarf symptoms., 2005, 139(4): 1935-1945.
[8] Jin L, Qin Q, Wang Y, Pu Y, Liu L, Wen X, Ji S, Wu J, Wei C, Ding B, Li Y.P2 protein hijacks auxin signaling by directly targeting the rice OsIAA10 protein, enhancing viral infection and disease development., 2016, 12(9): e1005847.
[9] Hagiwara K, Higashi T, Miyazaki N, Naitow H, Cheng RH, Nakagawa A, Mizuno H, Tsukihara T, Omura T. The amino-terminal region of major capsid protein P3 is essential for self-assembly of single-shelled core-like particles of., 2004, 78(6): 3145-3148.
[10] Wei T, Kikuchi A, Suzuki N, Shimizu T, Hagiwara K, Chen H, Omura T. Pns4 of rice dwarf virus is a phosphoprotein, is localized around the viroplasm matrix, and forms minitubules., 2006, 151(9): 1701-1712.
[11] Chen Q, Zhang L, Chen H, Xie L, Wei T. Nonstructural protein Pns4 of rice dwarf virus is essential for viral infection in its insect vector., 2015, 12: 211.
[12] Suzuki N, Kusano T, Matsuura Y, Omura T. Novel NTP binding property of rice dwarf phytoreovirus minor core protein P5., 1996, 19(2): 471-474.
[13] Ji X, Qian D, Wei C, Ye G, Zhang Z, Wu Z, Xie L, Li Y. Movement protein Pns6 of rice dwarf phytoreovirus has both ATPase and RNA binding activities., 2011, 6(9): e24986.
[14] Li Y, Bao Y M, Wei C H, Kang Z S, Zhong Y W, Mao P, Wu G, Chen Z L, Schiemann J, Nelson R S. Rice dwarf phytoreovirus segment S6-encoded nonstructural protein has a cell-to-cell movement function., 2004, 78: 5382-5389.
[15] Chen Q, Chen H, Jia D, Mao Q, Xei L, Wei T. Nonstructural protein Pns12 of rice dwarf virus is a principal regulator for viral replication and infection in its insect vector., 2015, 210: 54-61.
[16] Wei T, Shimizu T, Hagiwara K, Kikuchi A, Moriyasu Y, Suzuki N, Chen H, Omura T. Pns12 protein of Rice dwarf virus is essential for formation of viroplasms and nucleation of viral-assembly complexes., 2006, 87(2): 429-438.
[17] Ueda S, Uyeda I. The rice dwarf phytoreovirus structural protein P7 possesses non-specific nucleotide acids binding activity in vitro., 1997, http://www.bspp.org.uk/mppol/1997/0123Ueda/.
[18] Zhong B, Shen Y, Omura T. RNA-binding domain of the key structural protein P7 for the Rice dwarf virus particle assembly., 2005, 37(1): 55-60.
[19] Miyazaki N, Hagiwara K, Naitow H, Higashi T, Cheng RH, Tsukihara T, Nakagawa A, Omura T. Transcapsidation and the conserved interactions of two major structural proteins of a pair of phytoreoviruses confirm the mechanism of assembly of the outer capsid layer., 2005, 345: 229237.
[20] Zhou F, Wu G, Deng W, Pu Y, Wei C, Li Y. Interaction of rice dwarf virus outer capsid P8 protein with rice glycolate oxidase mediates relocalization of P8., 2007, 581(1): 34-40.
[21] Zhong B, Kikuchi A, Moriyasu Y, Higashi T, Hagiwara K, Omura T. A minor outer capsid protein, P9, of Rice dwarf virus., 2003, 148(11): 2275-2280.
[22] 尹哲, 吉栩, 吴云峰. 水稻矮缩病毒外壳蛋白P9具有体内转录激活活性. 中国农业科技导报, 2007, 9(3): 61-65.
Yin Z, Ji X, Wu Y F. Minor outer capsid protein P9 of Rice dwarf virus shows transcriptional activation in vivo., 2007, 9(3): 61-65. (in Chinese with English abstract)
[23] Cao X, Zhou P, Zhang X, Zhu S, Zhong X, Xiao Q, Ding B, Li Y. Identification of an RNA silencing suppressor from a plant double-stranded RNA virus., 2005, 79(20): 13018.
[24] Wei T, Kikuchi A, Moriyasu Y, Suzuki N, Shimizu T, Hagiwara K, Chen H, Takahashi M, Ichiki-Uehara T, Omura T. The spread ofamong cells of its insect vector exploits virus-induced tubular structures., 2006, 80(17): 8593-8602.
[25] Wei T, Shimizu T, Omura T. Endomembranes and myosin mediate assembly into tubules of Pns10 of rice dwarf virus and intercellular spreading of the virus in cultured insect vector cells., 2008, 372(2): 349-356.
[26] Xu H, Li Y, Mao Z, Li Y, Wu Z, Qu L, An C, Ming X, Schiemann J, Casper R, Chen Z. Rice dwarf phytoreovirus segment S11 encodes a nucleic acid- binding protein., 1998, 40(2): 267-272.
[27] 吴建国. 水稻矮缩病毒非结构蛋白Pns11的核仁定位及其与核仁蛋白Fibrillarin的互作. 福州: 福建农林大学, 2010.
Wu J. Rice dwarf virus non-structural protein Pns11 localized in nucleolus and interacted with the major nucleolar protein Fibrillarin. Fuzhou: Fujian Agriculture and Forestry University, 2010. (in Chinese with English abstract)
[28] Zhao S, Hong W, Wu J, Wang Y, Ji S, Zhu S, Wei C, Zhang J, Li Y. A viral protein promotes host SAMS1 activity and ethylene production for the benefit of virus infection., 2017, 6: e27529.
[29] 张洁, 陈晓敏, 吴锦鸿, 朱重庆, 丁新伦, 吴祖建. 水稻齿叶矮缩病毒Pns10蛋白在水稻原生质体内的表达. 中国水稻科学, 2017, 31(3): 232-237.
Zhang J, Chen X M, Wu J H, Zhu C Q, Ding X L, Wu Z J. Expression of Pns10 protein of rice ragged stunt virus in rice protoplasts., 2017, 31(3): 232-237. (in Chinese with English abstract)
[30] 张洁, 陈晓敏, 宛柏杰, 吴锦鸿, 林文武, 吴祖建. 水稻齿叶矮缩病毒非结构蛋白Pns7在水稻原生质体内的表达动态. 植物病理学报, 2017, 47(1): 61-67.
Zhang J, Chen X M, Wan B J , Wu J H , Lin W W, Wu Z J. Expression dynamics ofnonstructural protein Pns7 in rice protoplast., 2017, 47(1): 61-67. (in Chinese with English abstract)
[31] 段炼, 钱君, 郭小雨, 朱英. 一种快速高效的水稻原生质体制备和转化方法的建立. 植物生理学报, 2014, 50(3): 351-357.
Duan L, Qian J, Guo X Y, Zhu Y. A rapid and efficient method for isolation and transformation of rice protoplast., 2014, 50(3): 351-357. (in Chinese with English abstract)
[32] Kikkert M, van Poelwijk F, Storms M, Kassies W, Bloksma H, van Lent J, Kormelink R, Goldbach R. A protoplast system for studying tomato spotted wilt virus infection., 1997, 78(7): 1755-1763.
[33] 贾东升. SRBSDV和RRSV在介体飞虱体内的侵染机理. 福州: 福建农林大学, 2013.
Jia D S. Infection mechanisms of SRBSDV and RRSV in vector planthoppers. Fuzhou: Fujian Agriculture and Forestry University, 2013. (in Chinese with English abstract)
[34] 郑胜兰. SRBSDV非结构蛋白P6在病毒侵染白背飞虱过程中的功能分析. 福州: 福建农林大学, 2014.
Zheng S L. The functional analysis of P6 encoded by SRBSDV during virus infecting the white backed planthopper. Fuzhou: Fujian Agriculture and Forestry University, 2013. (in Chinese with English abstract)
[35] 陈晓敏, 宛柏杰, 吴锦鸿, 林文武, 吴祖建, 张洁. 水稻齿叶矮缩病毒P8蛋白的抗体制备及其在水稻原生质体内的表达动态. 中国科技论文, 2016, 11(6): 670-674.
Chen X M, Wan B J, Wu J H, Lin W W, Wu Z J, Zhang J. Preparation of polyclonal antibody against P8 protein of rice ragged stunt virus and its expression dynamic trends in rice protoplast., 2016, 11(6): 670-674. (in Chinese with English abstract)
Expression of Pns6 and P8 Proteins ofAfter Virus Infecting Rice Protoplasts
ZHANG Jie1,#, WAN Baijie1, 2,#, SHANG Pengxiang1, DING Xinlun1, DU Zhenguo1, WU Zujian1,*
(Institute of Plant Virology,//,,;,,;#;*,)
【Objective】In order to clarify expression dynamics of Pns6 and P8 proteins ofafter virus infecting rice protoplasts, 【Method】subcellular localization of Pns6 and P8 proteins as well as viral particles in rice protoplasts were conducted with a PEG mediated virus infecting protoplast system by immunofluorescence and electron microscope. Meanwhile, accumulation of Pns6 and P8 proteins and their RNAs in rice protoplasts were measured by Western blot and real-time fluorescence quantitative PCR. 【Result】Pns6 protein could form viroplasm-like punctate inclusion bodies in cytoplasm 48 h after virus inoculation, and P8 protein was also expressed in large quantities. Meanwhile, viral particles could forminclusion body-like structure in rice protoplasts. Expression of Pns6 and P8 proteins was both detected at 12 h after virus inoculation, and reached the maximum level after 36 h. At the same time, the expression level ofRNA peaked at 24 h and that ofRNA at 36 h after virus inoculation. 【Conclusion】Pns6 and P8 proteins were both expressed after virus infection, andmay also formed viroplasm-like inclusion bodies to complete virus replication and assembly in host cells.
; rice protoplast; Pns6 protein; P8 protein
10.16819/j.1001-7216.2019.8109
S435.111.4+9; S511.034
A
1001-7216(2019)02-0118-06
2018-09-29;
2018-11-12。
国家自然科学基金资助项目(31672005);福建农林大学科技创新专项(CXZX2017324, CXZX2016132)。

