制霉菌素对褐飞虱若虫解毒酶、尿酸酶含量的影响
张珏锋 李芳 钟海英 陈建明
制霉菌素对褐飞虱若虫解毒酶、尿酸酶含量的影响
张珏锋 李芳 钟海英 陈建明*
(浙江省农业科学院 植物保护与微生物研究所,杭州 310021;*通讯联系人,E-mail:chenjm63@163.com)
【目的】为明确取食制霉菌素处理的水稻对褐飞虱[(Stål)]相关生理指标的影响,【方法】以不同浓度制霉菌素处理的水稻饲养褐飞虱,检测虫体内相关解毒酶含量与活性以及尿酸酶基因相对含量的变化。【结果】结果显示,取食制霉菌素处理的水稻,褐飞虱体内芳香基酰胺酶(aromatic amidase,AAD)含量前期下降,后期抑制作用逐渐消失,酶含量回升;虫体内O-脱乙基酶(O-deethyl enzyme,ODEE)含量在72 h的处理时长内显著低于对照;羧酸酯酶(carboxylesterase,CarE)和谷胱甘肽S-转移酶(glutathione S-transferase,GST)的活性在不同浓度制霉菌素的处理下呈现不同的动态变化,高浓度制霉菌素(600 U/mL)处理的褐飞虱种群体内的CarE和GST的活性在处理时间段内均呈现诱导-抑制-诱导的现象,而中(300 U/mL)、低浓度(150 U/mL)处理种群中两种酶则随着处理时间的延长呈上升趋势。取食不同浓度制霉菌素处理水稻的褐飞虱种群体内类酵母共生菌尿酸酶基因在24 h、48 h之后与对照相比均无显著差异。取食48 h后,包括对照在内的4个处理尿酸酶基因相对转录水平均有下调趋势,当处理时长达72 h时,尿酸酶基因相对转录水平呈现上调趋势,但取食不同浓度制霉菌素处理水稻的褐飞虱种群体内含量显著低于对照。【结论】取食不同浓度制霉菌素处理的水稻对褐飞虱3龄若虫的4种主要的解毒酶具有不同的影响;制霉菌素处理可通过减少类酵母共生菌数量从而降低尿酸酶的含量。
褐飞虱;制霉菌素;解毒酶;尿酸酶基因
褐飞虱[(Stål)]属半翅目(Hemiptera)飞虱科(Delphacidae)、r-对策迁飞性害虫,通过取食水稻韧皮部汁液为害。褐飞虱因具有繁殖速度快、生长周期短、内禀增长率高等特点而极易暴发成灾。化学杀虫剂是目前褐飞虱田间防治的主要手段,然而化学杀虫剂的滥用,不但对粮食安全造成隐患,而且导致田间褐飞虱抗药性连年上升,这已成为褐飞虱防治中的瓶颈。
褐飞虱体内存在类酵母共生菌(yeast-like symbiotes,YLS),能合成虫体所需氨基酸、固醇等物质[1-3]。其中,YLS合成固醇类营养的功能归因于该菌中存在的尿酸氧化酶(urate oxidase, EC1.7.3.3),这是生物体内嘌呤降解代谢途径中的一种酶,可以将尿酸进一步分解为尿囊素和其它含氮化合物,从而供给YLS作为原料合成胆固醇,因而消除或降低褐飞虱体内的YLS数量可能导致尿酸酶含量降低;尿酸囤积而减少对褐飞虱的营养供给。制霉菌素(nystatin)是一种多烯类抗真菌药,医学上主要用于内服治疗消化道真菌感染或外用于表面皮肤真菌感染[4]。张珏锋[5]、王国超[6]等发现用制霉菌素处理褐飞虱后会引起虫体内YLS数量减少、必需氨基酸含量降低、死亡率升高等;同时相对于化学杀虫剂所还具有毒性低,不易残留等特点。因而研究取食制霉菌素之后褐飞虱体内相关生理指标的变化对于寻求田间褐飞虱防控的安全有效措施具有重要意义。
昆虫体内细胞色素P450酶(P450)、羧酸酯酶(carboxylesterase,CarE)、谷胱甘肽硫转移酶(glutathione S-transferase,GST)以及芳基酰胺酶(arylacylamidase,AAD)等解毒代谢酶在虫体代谢化学杀虫剂等物质的过程中发挥着重要作用[7-8]。解毒酶系活性的增强是害虫对杀虫剂产生高水平抗性和交互抗性的主要原因之一[9-10],而解毒酶的表达和代谢能力,易被包括化学杀虫剂的外源化合物所诱导。孙璟琰[11]等发现芳基酰胺酶参与了小菜蛾对呋喃虫酰肼的抗性的形成;邢静等[12]在用氯虫苯甲酰胺连续处理小菜蛾之后发现其体内的羧酸酯酶和细胞色素P450 O-脱乙基酶的比活力有明显的诱导增强作用,因而推测该两种酶的比活力增强可能与小菜蛾对氯虫苯甲酰胺的敏感性下降有关。除化学杀虫剂之外,茉莉酸甲酯[13]、增效醚[14]等外源化学物质也能激活昆虫体内羧酸酯酶、O-脱乙基酶以及P450 酶等与解毒化学物质相关的代谢酶的表达。本研究通过不同浓度制霉菌素处理的水稻饲养褐飞虱后,检测褐飞虱体内相关解毒酶含量与活性以及尿酸酶基因相对含量的变化,以明确取食制霉菌素处理的水稻对褐飞虱相关生理指标的影响,为进一步研究利用制霉菌素控制褐飞虱为害提供理论基础。
1 材料与方法
1.1 材料
供试水稻品种TN1种子催芽后播种,至秧龄30~40 d时,移栽至塑料盆钵中,7~10 d后用于饲养褐飞虱。
供试褐飞虱采集杭州田间种群的褐飞虱高龄若虫和成虫,用上述TN1稻苗连续饲养2代后,取褐飞虱初孵若虫进行试验。
所用的实验材料包括制霉菌素(上海生工生物技术有限公司)、柱式酵母总RNA抽提纯化试剂盒(上海生工生物技术有限公司)、反转录试剂盒(PrimeScript RT reagent Kit, TaKaRa)、昆虫O-脱乙基酶酶联免疫分析试剂盒(上海裕平生物科技有限公司)、昆虫芳基酰胺酶酶联免疫分析试剂盒(上海裕平生物科技有限公司)、谷胱甘肽S-转移酶试剂盒(苏州科铭生物技术有限公司)、羧酸酯酶试剂盒(苏州科铭生物技术有限公司)。
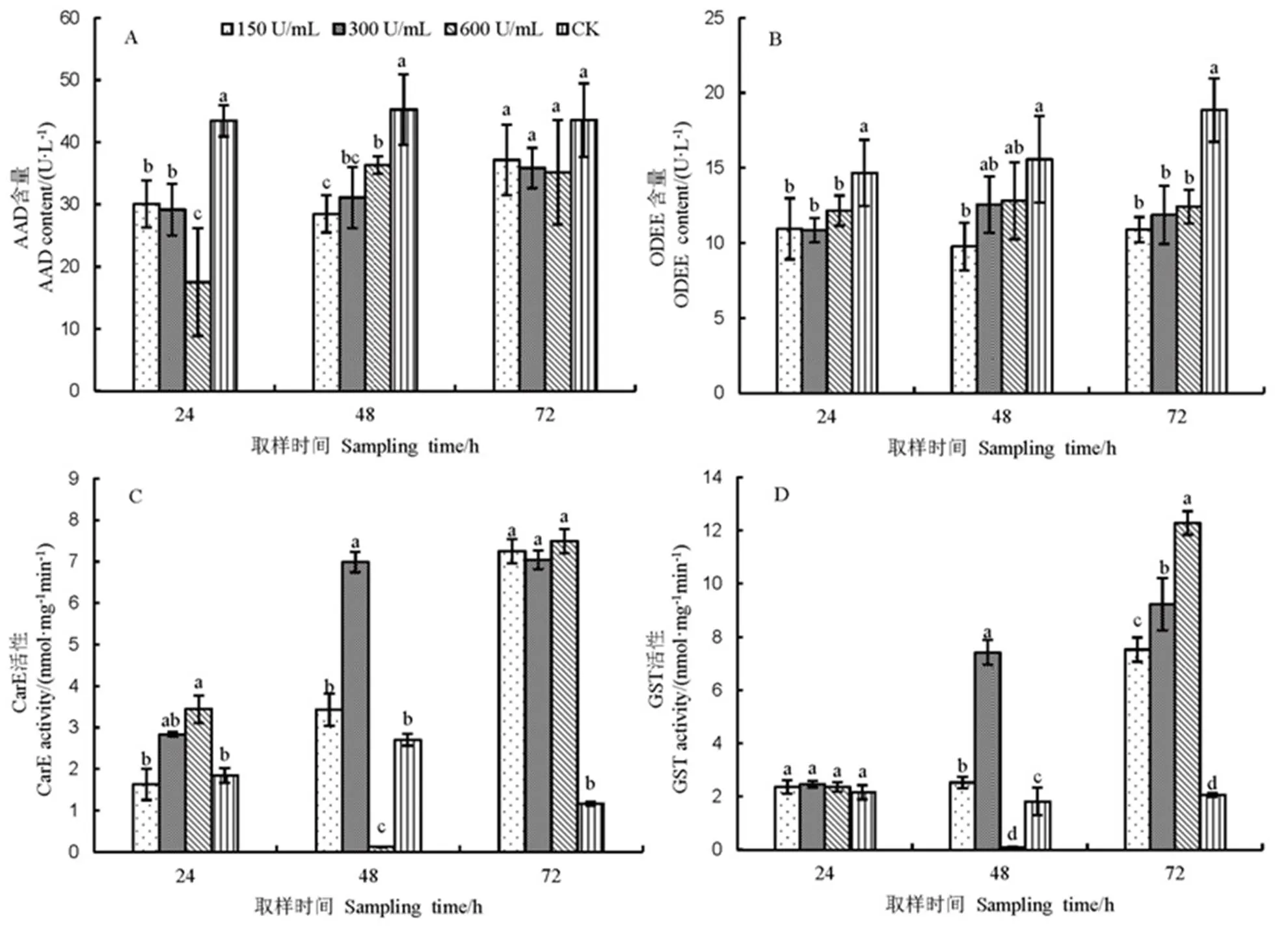
A-芳基酰胺酶(AAD);B-O-脱乙基酶(ODEE);C-羧酸酯酶(CarE);D-谷胱甘肽S-转移酶(GST)。图中数据为3次独立重复的平均值±标准差,同一时间点不同处理间标注不同小写字母表示在P=0.05水平上差异显著。
Fig. 1. Effect of nystatin on detoxifying enzymes in the
1.2 方法
1.2.1 制霉菌素处理水稻
水稻品种TN1催芽后,播于瓷盆中,7 d后将稻苗移至直径15 mm、长150 mm试管中,每管1株,分别用150、300、600 U/mL的制霉菌素溶液培养,每个浓度设置250个重复,清水为对照。每管接入2头褐飞虱3龄若虫,每24 h、48 h、72 h取样。
1.2.2 解毒酶活性测定
不同时间段取样褐飞虱20头,加入5 mL PBS (pH 7.4)研磨,3000下离心20 min取上清,根据各个试剂盒步骤进行测定。
1.2.3 尿酸酶基因的RT-PCR分析
各处理褐飞虱20头,液氮研磨后,用Ambion公司酵母RNA提取试剂盒进行总RNA 提取操作。
按照TaKaRa 公司反转录试剂盒(PrimeScript RT reagent Kit)使用说明,将总RNA反转录成cDNA。反应体系如下:5×PrimeScript 缓冲液(for Real Time) 4 µL;逆转录酶I 1 µL;寡核苷酸(50 µmol/L)1 µL;6核苷酸随机引物(100 µmol/L)1 µL;总RNA 5 µL。ddH2O(无RNA酶) 加至20 µL。反转录反应条件: 37℃,15 min,85℃,5 s,反转录得到的cDNA保存于−20℃。
qRT-PCR验证: 应用 Light Cycler Real Time PCR扩增仪(罗氏) 的操作方法,使用TaKaRa公司的 SYB Premix Ex试剂盒,以5'-TCATCTTT GCTTGGCTAT-3';5'-TCTTGTTACCCTTATGTT TG-3'为引物,按照使用说明进行RT-PCR检测。条件如下:50.0℃下3 min;95.0℃下3 min;95.0℃下10 s;60.0℃下30 s(40次循环);溶解曲线 60℃ to 95℃ : 增量为 0.5℃下10 s 读板。
所有结果以均值±标准误值的形式呈现,并制成表格。使用Graphpad prism (Graphpad Software, San Diego, CA)进行数据统计分析和制图。
2 结果与分析
2.1 不同处理下褐飞虱体内各解毒酶活性变化
取食制霉菌素处理的水稻,褐飞虱体内AAD含量前期下降,后期抑制作用逐渐消失,含量回升;虫体内ODEE含量在72 h内显著低于对照,仅在48 h时,300 U/mL及600 U/mL处理短暂上升至12.57 U/L与12.82 U/L,与对照无显著差异,至72 h时长3处理ODEE含量又呈现显著低于对照处理的状态。CarE和GST的活性在不同浓度制霉菌素的处理下呈现不同的发展趋势,高浓度制霉菌素(600 U/mL)处理的褐飞虱种群体内的CarE和GST的活性在处理时间段内均呈现诱导-抑制-诱导的现象,而中、低浓度处理种群中两种酶则随着处理时间的延长呈上升趋势。产生该现象的原因推测可能600U/mL的高浓度,在短期内易对虫体内解毒酶产生了抑制作用,但抑制现象随着处理时间延长会解除,且酶活升高数值高于中、低浓度处理。
2.2 不同处理褐飞虱体内尿酸酶基因相对含量转录水平的变化
表1显示了褐飞虱体内类酵母共生菌尿酸酶基因在寄主取食制霉菌素处理水稻不同时长之后相对于对照种群的表达情况。取食不同浓度制霉菌素处理水稻24 h、48 h之后,褐飞虱种群体内尿酸酶基因相对转录水平与对照均无显著差异。取食48 h时,包括对照在内的4个处理尿酸酶基因相对转录水平相对于24 h时均有下调趋势,其中600 U/mL处理下调近69.70%。而当处理时长达72 h时,尿酸酶基因相对转录水平呈现上调趋势,150、300及600 U/mL处理的尿酸酶基因相对转录水平分别上升为48 h的1.71倍、6.22倍及1.78倍,而对照处理在取食72 h之后,尿酸酶基因相对转录水平上升至17.53倍,显著高于其余处理。产生72 h尿酸酶基因相对转录水平上升推测与实验中所用的3龄若虫在饲养72 h之后,向高龄若虫转化,体内共生菌的数量快速增长有关。
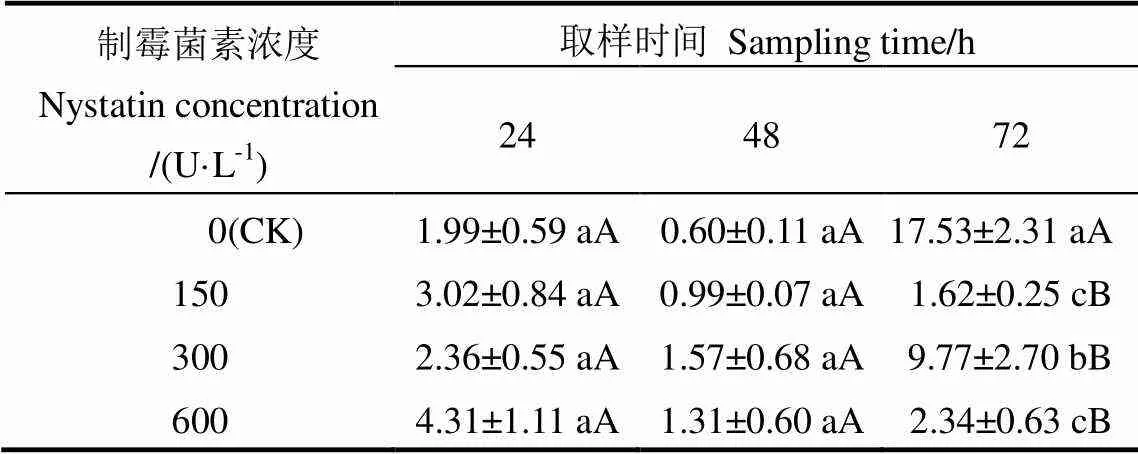
表1 取食不同处理水稻后褐飞虱体内尿酸酶基因相对转录水平
表中数据为平均数±标准误。同一列数据后不同小写字母表示经邓肯新复极差法检测在0.05水平上差异显著。
Data in the table are mean±SE. Different letters in the same row indicate significant difference among different concentrations at 0.05 level by the Duncan’s new multiple range test.
3 讨论
制霉菌素是一种多烯型抗生素,具有共轭多烯大环内酯结构。制霉菌素的处理可以抑制褐飞虱体内的YLS的数量,降低部分氨基酸的含量[5-6]。昆虫在外源化学物质的选择压力下,会通过增加体内代谢解毒酶活力,加快对外源物质的代谢解毒过程。本研究中发现取食制霉菌素处理的水稻对褐飞虱体内ODEE酶含量具有显著的抑制作用,对AAD酶含量前期具有先抑制后诱导的作用;CarE和GST的活性在不同浓度制霉菌素的处理下呈现不同的发展趋势,高浓度(600 U/mL)处理褐飞虱种群体内的CarE和GST的活性在处理时间段内均呈现诱导-抑制-诱导的现象,而中、低浓度处理种群中两种酶则随着处理时间的延长呈上升趋势。可见,取食不同浓度制霉菌素处理的水稻对褐飞虱3龄若虫的4种主要的解毒酶具有不同的影响。GST和CarE作为重要的解毒酶,也是昆虫代谢化学药剂的重要酶系,在有机磷、拟除虫菊酯和有机氯等化学药剂的代谢中发挥了重要作用[15]。但同一昆虫不同时期对外界化学药剂的敏感性存在差异,因为不同时期昆虫中靶标酶和解毒酶的活性不同,因而可能会形成中低浓度制霉菌素处理对GST酶与CarE酶有诱导作用,而高浓度处理具有不同的时间效应产生诱导-抑制-诱导的现象,李阳等[14]增效醚处理二化螟4龄幼虫发现虫体内ECOD和CarE的活性变化也具有不同的时间效应,呈现诱导与抑制交错的现象[16-17]。芳基酰胺酶(AAD)是生物体内农药及其他外源物质的重要水解酶之一,由于芳基酰胺酶参与了昆虫对含有酰胺基团的化学药剂的水解代谢[11],所以芳基酰胺酶对含有酰胺键的有机磷类、苯甲基酰基脲类及双酰肼类杀虫剂的代谢中起着重要作用[18-19]。制霉菌素属于共轭多烯大环内酯结构,不含有酰胺基团,因此,可能对AAD的含量无影响,但本研究中随着处理时间的延长,AAD酶的活性已呈现逐渐上升的趋势,此现象可能与实验中所用试虫在实验过程中龄期的增长有关。ODDE属于细胞色素P450酶系,与 CarE酶、GST酶是昆虫中不同功能的解毒酶,该类酶主要运用-脱烷基作用、烷基和芳基的羟基化作用、环氧化作用等作用来进一步代谢有毒化合物,而该类功能可能对制霉菌素的共轭多烯大环内酯结构的降解并无效果,因而本实验结果显示取食霉菌素处理水稻对褐飞虱3龄若虫的ODDE酶具有显著的抑制作用影响。
尿酸酶存在于褐飞虱体内的YLS中,不属于解毒酶系,但由于该酶具有降解尿酸,提供合成寄主必需氨基酸原材料的功能,因而对寄主具有重要意义。由于昆虫尿酸酶的测定缺少成熟的方法,本研究中采用测定尿酸酶基因的相对转录水平的方法[20]。包括对照在内的4个褐飞虱种群在72 h之后体内尿酸酶相对转录水平都显著升高,但3个处理种群体内尿酸酶基因相对转录水平显著低于对照降低。产生此现象的原因推测可能为制霉菌素处理对低龄若虫体内的类酵母菌含量影响不显著[5],而实验中所用的3龄若虫在饲养72 h之后,向高龄若虫转化,体内共生菌的数量快速增长有关,尿酸酶含量随之增长,制霉菌素对尿酸酶的抑制作用随之逐渐显现。由此可推测制霉菌素处理可能通过减少YLS数量从而降低尿酸酶的含量,使褐飞虱虫体内尿酸分解被抑制,从而减少寄主所需合成胆固醇、必需氨基酸等必需营养元素的原料供给。
[1] Tokuda G, Elbourne L D H, Kinjo Y, Saitoh S, Sabree Z, Hojo M, Yamada A, Hayashi Y, Shigenobu S, Bandi C, Paulsen I T, Watanabe H, Lo NMaintenance of essential amino acid synthesis pathways in thesymbiont of a wood-feeding cockroach., 2013, 9(3): 20121153.
[2] Thompson B M, Grebenok R J, Behmer S T, Gruner D SMicrobial symbionts shape the sterol profile of the xylem-feeding woodwasp,, 2013, 39(1): 129-139.
[3] Price D R G, Feng H, Baker J D, Bavan S, Luetje C W, Wilson A CAphid amino acid transporter regulates glutamine supply to intracellular bacterial symbionts. PNAS, 2014, 111(1): 320-325.
[4] Martín M J, Calpena A C, Fernández F, Mallandrich M, Galvez P, Clares B. Development of alginate micros pheres as nystatin carriers for oral mucosa drug delivery., 2015, 117: 140-149.
[5] 张珏锋, 何月平, 陈建明. 制霉菌素对褐飞虱取食行为, 营养及共生菌数量的影响. 植物保护学报, 2015 (2): 264-270.
Zhang J F, He Y P, Chen J M. Effects of nystatin on the feeding behavior, nutrition and yeast-like symbiont number of the brown planthopper,(Stål)., 2015, 42(2): 264-270. (in Chinese with English abstract)
[6] 王国超.褐飞虱体内类酵母共生菌的营养功能及其分子基础的研究.北京: 中国农业科学院, 2005.
Wang G C. The nutritional function and its molecular basis of yeast like symbiotes in rice brown planthopper(Stål). Beijing: Chinese Academy of Agricultural Sciences. (in Chinese with English abstract)
[7] Bao H B, Gao H L, Zhang Y X, Fan D Z, Fang J C, Liu Z W. The roles of CYP6AY1 and CYP6ER1 in imidacloprid resistance in the brown planthopper: Expression levels and detoxification efficiency., 2016, 129: 70-74.
[8] Zhang X L, Liao X, Mao K K, Yang P, Li D Y, Alia E, Wan H, Li J HThe role of detoxifying enzymes in field-evolved resistance to nitenpyram in the brown planthopperin China., 2017, 94: 106-114.
[9] Liu N N, Zhu F, Xu Q. Pridgeon J W, Gao X W. Behavioral change, physiological modification, and metabolic detoxification: Mechanisms of insecticide resistance., 2006, 49(4): 671-679.
[10] 邱星辉. 细胞色素 P450 介导的昆虫抗药性的分子机制. 昆虫学报, 2014, 57(4): 477-482.
Qiu X H. Molecular mechanissms of insecticide resistance mediated by cytochrome P450s in insects.,2014, 57(4): 477-482.(in Chinese with English abstract)
[11] 孙璟琰, 梁沛, 高希武. 小菜蛾芳基酰胺酶表达及其与呋喃虫酰肼抗性的关系. 应用昆虫学报, 2012, 49(2): 396-402.
Sun J Y, Liang P, Gao X W. The distribution of aryl-acylamidase in the diamondback moth,and its relationship to fufenozide resistance.,2012, 49(2): 396-402.(in Chinese with English abstract)
[12] 邢静, 梁沛, 高希武. 亚致死浓度氯虫苯甲酰胺对小菜蛾药剂敏感度和解毒酶活性的影响. 农药学学报, 2011, 13(5): 464-470.
Xing J, Liang P, Gao X W. Effects of sublethal concentrations of chlorantraniliprole on insecticide susceptibility and detoxifying enzyme activity in Plutella xylostella., 2011, 13(5): 464-470. (in Chinese)
[13] 范银君, 康志娇, 王志超, 史雪岩,高希武. 茉莉酸甲酯处理对棉铃虫生长和解毒能力的影响. 昆虫学报, 2014, 3: 007.
Fan Y J, Kang Z J, Wang Z C, Shi X Y, Gao X W. Effects of methyl jasmonate treatment on the growth and detoxifyingabilities of(Lepid optera: Noctuidae)., 2014, 57(3): 315-322. (in Chinese with English abstract)
[14] 李阳, 史雪岩, 高希武. 增效醚对二化螟幼虫 7-乙氧基香豆素-O-脱乙基酶和羧酸酯酶活性的影响. 昆虫学报, 2016, 59(11): 1159-1165.
Li Y, Shi X Y, Gao X W.effects of piperonyl butoxide on the activities of 7-ethoxycoumarin O- deethylase and carboxylesterase in larval(Lepidoptera: Pyralidae).,2016, 59(11): 1159-1165. (in Chinese with English abstract)
[15] Cao G C,Lu Q,Zhang L L, Guo F, Liang G M, Wu K M, Wyckhuys K A G, Guo Y Y. Toxicity of chlorantraniliproleto Cry1Ac-susceptible andresistant strains of., 2010, 98(1): 99-103.
[16] Campanhola C, Plapp F W. Pyrethroid resistance in the tobacco budworm (Lepidoptera: Noctuidae): Insecticide bioassays and field monitoring., 1989, 82(1): 22-28.
[17] 吴青君, 张文吉, 张友军, 徐宝云, 朱国荣. 表皮穿透和 GABAA 受体不敏感性在小菜蛾对阿维菌素抗性中的作用. 昆虫学报, 2002, 45(3): 336-340.
Wu Q J, Zhang W J, Zhang Y J, Xu B Y, Zhu G R. Cuticular penetration and desensitivity of GABA Areceptor in abamectin resistantL., 2002, 45(3): 336-340.(in Chinese with English abstract)
[18] Yu S J, Nguyen S N, Abo-elghar G E. Biochemical characteristics of insecticide resistance in the fall armyworm,(JE Smith)., 2003, 77(1): 1-11.
[19] Masson P, Froment M T, Gillon E, Nachon F, Darvesh S, Schopfer L M. Kinetic analysis of butyrylcholinesterase -catalyzed hydrolysis of acetanilides., 2007, 1774(9): 1139-1147.
[20] Chen Z Y, Wang Z Y, He X P, Guo X N, Li W W, Zhang B R. Uricase production by a recombinant Hansenula polymorpha strain harboring Candida utilis uricase gene., 2008, 79(4): 545-554.
Effects of Nystatin Treatment on Detoxification Enzymes andUricase Content in Nymphs of the Brown Planthopper [(Stål)]
ZHANG Juefeng, LI Fang, ZHONG Haiying, CHEN Jianming*
(,,,;,:)
s:【Objective】To illuminate theeffect of concentrations of nystatin on physiological indicators of brown planthoppers [(Stål)],【Method】detoxifying enzymes and uricase gene relative transcriptional level in brown planthoppers () were measured after treatment with different concentrations of nystatin. 【Result】The content of aromatic amidase (AAD) in the brown planthopper(BPH) populationfed on nystatin treated rice was decreased in the early stage, and increased gradually in the late stage. Nystatin treatment could significantly decrease the content of O-deethyl enzyme (ODEE).Activity of carboxylesterase(CarE) and glutathione S-transferase(GST) in BPH showed different trends under the treatment of nystatin. The activities of CarE and GST in 600 U/mL nystatin treated BPH population was induced-inhibited-induced during the treatment period, while there has been general uptrend of activities of two enzymes in the 300 U/mL and 150 U/mL nystatin treated populations within 72 h.The relative transcriptional level of uricase gene in different concentrations nystatin treated BPH populations had no significant difference with control by treatment with 24 h and 48 h. After feeding 48 h, the transcriptional level in three nystatin treated BPH populations and control population all decreased. To 72 h, the relative transcriptional level of uricase gene increased and transcriptional level in treated population was significantly lower than that in control population. 【Conclusion】Four detoxifying enzymesshowed different trends after BPH was fed on rice treated with nystatin at different concentrations, nystatin treatment also reduce the content of uricase by reducing the number of yeast-like symbiotes.
; nystatin; detoxifying enzymes; uricase gene
10.16819/j.1001-7216.2019.7129
S435.112+.3; S482.2
A
1001-7216(2019)02-0186-05
2017-10-26;
2018-04-01。
浙江省公益科技计划资助项目(2016C32100)。

