伴有破骨细胞样巨细胞的胰腺未分化癌病理特征
邓露露 张允硕 蒋慧 赵静 张丽 徐晶晶 郑建明
海军军医大学附属长海医院病理科,上海 200433
胰腺未分化癌是一种少见的胰腺外分泌恶性肿瘤,占胰腺恶性肿瘤的2%~7%[1-4]。而伴有破骨细胞样巨细胞的胰腺未分化癌(undifferentiated pancreatic carcinoma with osteoclastic giant cells,UOC)更为罕见,不到胰腺恶性肿瘤的1%[5]。此类肿瘤最先由Rosai报道,以肿瘤组织内含有单核肿瘤细胞和破骨细胞样巨细胞(osteoclast-like giant cells,OGCs)为特征[6],且OGCs表达CD68、lysozyme等间叶标志物,而不表达上皮性标志物,类似于吸收骨中的破骨细胞。UOC可单独发生,也可伴随胰腺导管腺癌[7]或黏液性囊腺癌[7-8],组织来源是上皮细胞还是间充质细胞仍有争议[9-12]。本研究采用免疫组织化学及分子生物学方法分析UOC的病理特征,探讨其对肿瘤的诊断及鉴别诊断、组织来源判定的价值。
资料与方法
一、一般资料
收集2011年4月至2017年12月间海军军医大学附属长海医院胰腺手术患者的档案资料,运用关键词“破骨细胞样巨细胞”、“破骨细胞瘤”、“多形性巨细胞癌”、“未分化癌”、“巨细胞癌”检索出13例UOC,通过对所有病例的切片复习,按2010版WHO标准[1]共纳入6例UOC,其中男性3例,女性3例,年龄49~81岁,平均62岁。并对6例患者行电话随访,随访截至2018年9月30日。
二、方法
1.组织病理学检查:取石蜡包埋的组织块,连续切片,厚3 μm,常规苏木精-伊红(HE)染色,光镜下观察组织病理学改变。
2.蛋白表达检测:采用免疫组织化学SP法检测Cam5.2、EMA、CD68、vimentin、lysozyme 、E-cad、C-erbB-2、p53、MUC1、MLH1、MSH2、MSH6、Osteoponin、Ki-67的表达,DAB显色。以PBS代替一抗作为阴性对照,已知该抗体阳性的切片标本作为阳性对照。其中Cam5.2、EMA、CD68、vimentin、MUC1、lysozyme、E-cad、Osteoponin以胞质内出现棕黄色颗粒为阳性染色。p53、MLH1、MSH2、MSH6、Ki-67以胞核内出现棕黄色颗粒为阳性染色。C-erbB-2以胞膜上出现棕黄色颗粒为阳性染色。一抗的来源及工作浓度见表1。
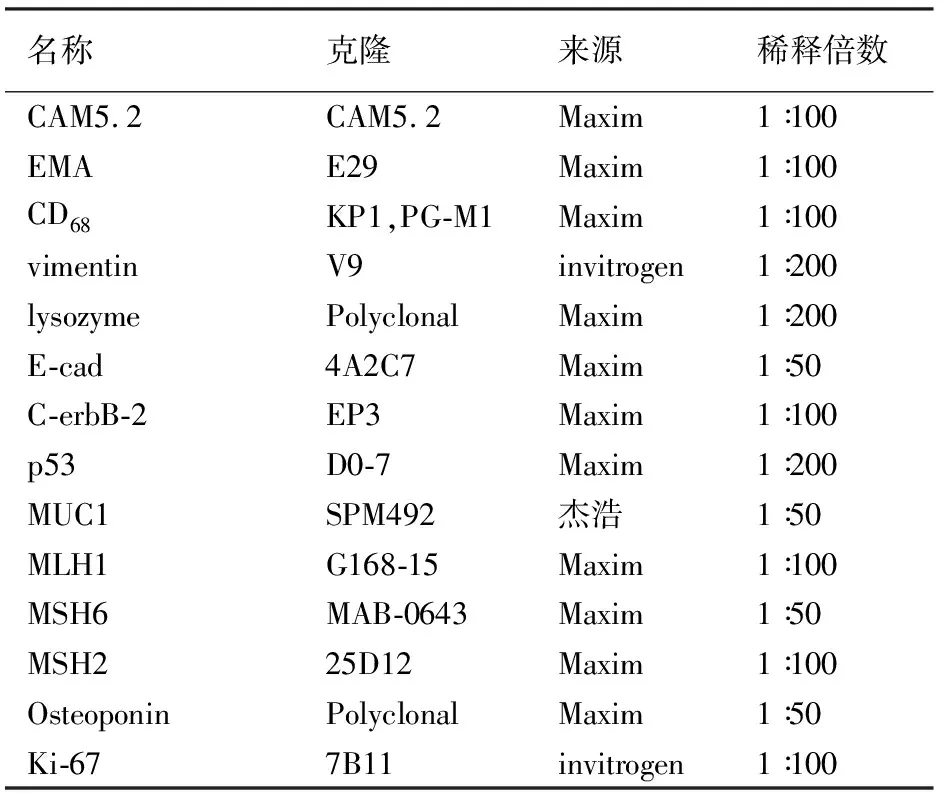
表1 抗体特性
3.K-ras基因突变检测:采用荧光定量PCR法检测K-ras突变。比照HE染色切片中的肿瘤区域,将以上石蜡包埋的肿瘤组织连续切片,厚10 μm。用QIAGEN石蜡组织DNA提取试剂盒(厦门艾德生物医药科技有限公司,Cat NO.56404)提取组织DNA,按说明书操作,确保样本A260/A280为1.8~2.0。以DNA为模板,用人类K-ras基因7种突变检测试剂盒(厦门艾德生物医药科技有限公司)检测,在Mx3000p实时荧光PCR仪上扩增。
结 果
一、临床及随访资料
6例UOC患者的临床症状及相关随访结果见表2。患者均以上腹胀痛不适为首发症状,多见于老年患者,男女发病率无明显差别。1例带瘤生存6年,后因出现多发转移治疗无效死亡。1例发现时即已出现肝内多发转移,并在术中发现肿瘤已侵犯肠系膜上静脉、胃、十二指肠动脉、肝总动脉及腹腔干,术后6个月死亡。1例术后18个月出现肝脏转移,未切除,术后22个月死亡。1例术后发现胰周及胃周淋巴结转移,行6个疗程化疗,随访26个月因出现肝脏转移死亡。另外2例无淋巴结、远处转移及相邻器官侵犯,分别随访28、15个月后仍存活。
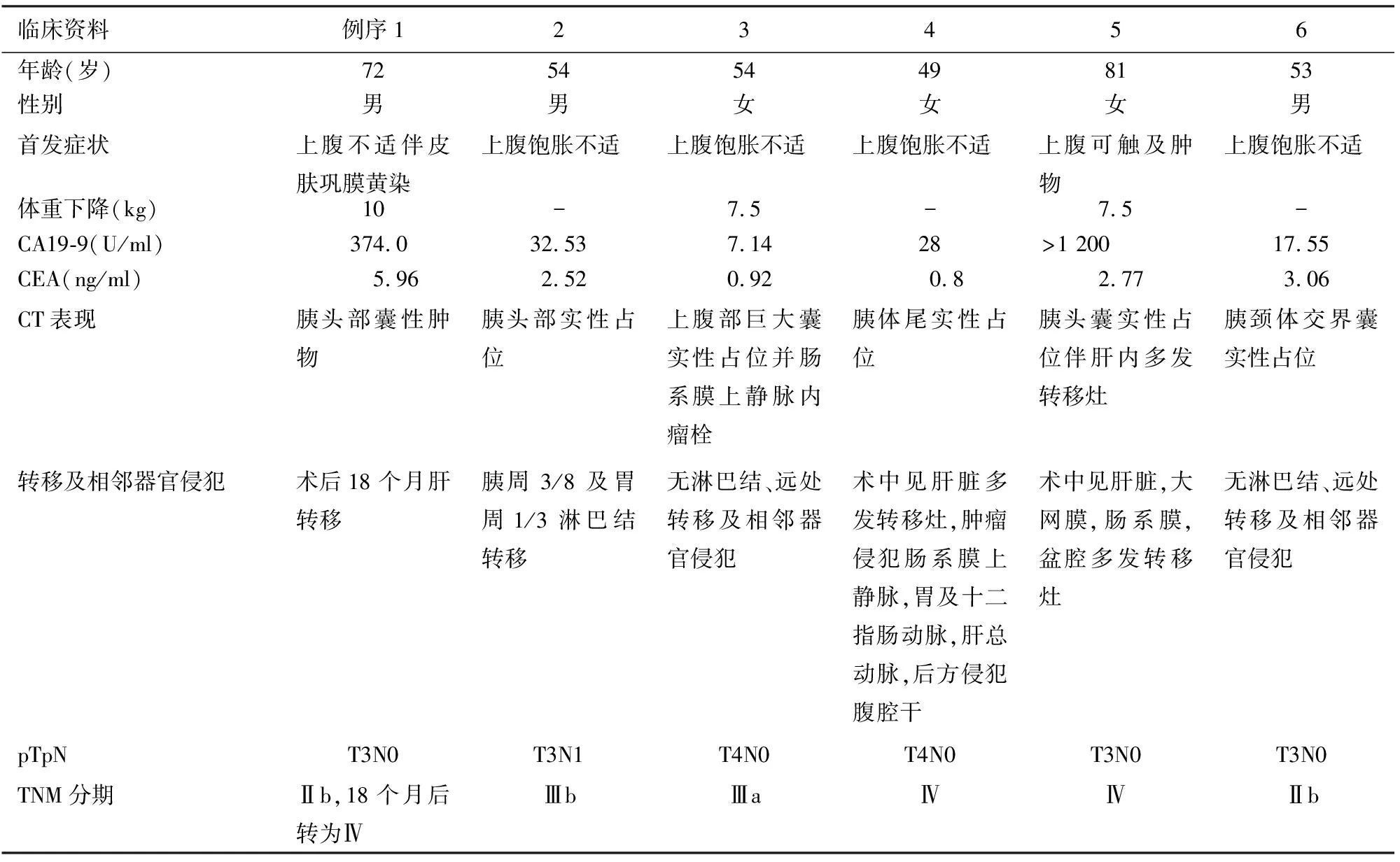
表2 6例UOC患者的临床及随访资料
注:-:资料不详
二、病理学特征
6例中4例肿瘤位于胰头部,2例位于胰体尾部;肿物最大径3~16 cm,平均7.8 cm;切面灰白、灰黄色,部分区域暗红色,部分肿物切面见囊性变,质地中等,有坏死;肿物与胰腺界限尚清楚。镜下见肿瘤组织由两类细胞组成:一类为卵圆形或梭形(图1A)的单核肿瘤细胞,胞核梭形或卵圆形,染色质细颗粒状,胞质嗜酸性或空泡状;另一类为破骨细胞样巨细胞,胞内含数个至数十个卵圆形核,大小一致,染色质细,含1~2个核仁,胞质嗜酸性,部分空泡状,无病理性核分裂象(图1B),两类细胞混杂散在分布于单核梭形细胞中。部分肿瘤尚可见骨样基质(图1C),肿瘤内可见出血坏死,部分肿瘤侵及神经及脉管。6例肿瘤除典型的UOC成分外,均可见导管腺癌的成分(图1D)。
三、免疫标志物的表达
6例肿瘤内的导管腺癌上皮标志物Cam5.2、EMA、E-cad、MLH1、MSH2、MSH6、Ki-67均呈阳性表达,间叶标志物vimentin、CD68、lysozyme和肿瘤相关标志物Her2、p53、MUC1均阴性表达;破骨细胞样巨细胞vimentin(图2A)、CD68(图2B)、lysozyme 、osteoponin均呈阳性表达,Cam5.2、EMA、E-cad、MLH1、MSH2、MSH6均呈阴性表达。
四、K-ras基因突变
6例肿瘤均有K-ras基因12密码子突变,其中1例为双突变(GGT>TGT及GGT>GTT),3例为GGT>GTT,1例为GGT>TGT, 1例为GGT>GCT。13密码子均无突变。
讨 论
UOC是胰腺导管腺癌的亚型,很罕见。光镜下主要有两类细胞,一类为卵圆形或梭形的单核肿瘤细胞,另一类为散布于单核细胞间的OGCs。肿瘤内可见骨样、软骨样结构或片状坏死、出血、囊性变等表现,可伴随普通的导管腺癌、导管内乳头状黏液性肿瘤、黏液性囊腺瘤或恶性间质瘤发生。但不能将其与胰腺未分化癌混淆,前者的OGCs没有核异型性,而后者的瘤巨细胞具有显著核异型[12]。
关于UOC的来源,大多数研究支持其起源于胰腺导管上皮,属于胰腺未分化癌的一个亚型[12-16],基因分析显示K-ras基因第12号密码子突变。K-ras基因突变发生在胰腺上皮内瘤变进展的早期,中期则有p16的突变失活,在肿瘤恶性转化的晚期则有p53、SMAD4(DPC4)、BRCA 2等肿瘤抑制基因的失活。多数未分化癌的单核肿瘤细胞存在K-ras基因的突变,支持肿瘤为导管上皮来源[17-20]。本组病例均存在K-ras基因第12密码子突变。免疫组织化学染色结果显示单核肿瘤细胞EMA、CEA及vimentin阳性表达,在导管样肿瘤细胞到未分化的肿瘤细胞的移行区伴随着E-cadherin的表达缺失,提示肿瘤为导管上皮起源伴有不同程度的去分化,支持UOC是胰腺导管腺癌的亚型的观点。此外有研究认为UOC与家族性非典型多痣黑素瘤综合征都拥有相同的p16种系突变[21]。
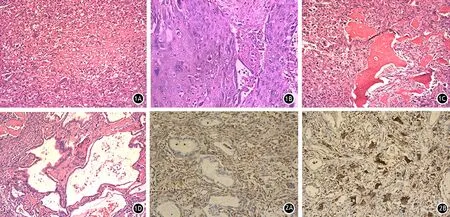
图1 卵圆形或梭形的单核肿瘤细胞(1A),破骨细胞样巨细胞(1B),胞质内含铁血黄素,骨样基质(1C)及导管腺癌成分(1D)(HE ×200或 ×400) 图2 肿瘤内破骨细胞样巨细胞vimentin(2A)和CD68(2B)阳性表达(SP法 ×400)
OGCs与骨的巨细胞样肿瘤具有类似的免疫表型,表达CD68、lysozyme和vimentin,而不表达上皮标记,支持其是胰腺肿瘤中的反应性成分,无异型性,增殖活性低,且无K-ras和p53的突变[9-10]。Hur等[14]分析3例OGCs患者均无K-ras基因突变,但CD68表达阳性,而多形性单核细胞及导管癌细胞常出现K-ras基因突变,据此认为有K-ras基因突变的多形性单核细胞是肿瘤细胞,可能起源于导管细胞,而OGCs为非肿瘤细胞,可能为间叶细胞起源。本组病例OGCs的间叶标志物CD68、lysozyme和vimentin阳性,而上皮标志物阴性,也支持OGCs可能为反应性多核巨细胞,而非肿瘤性成分。
有学者认为OGCs的发生可能与出血或肿瘤坏死有关,也有学者认为肿瘤内出血和坏死与OGCs之间缺乏因果关系,两者常伴随出现,可能同属于该肿瘤的反应性改变[14-15]。由于OGCs靠近癌细胞分布,提示还可能与肿瘤细胞的刺激存在某种关联[13-16]。本组6例OGCs均可见吞噬含铁血黄素现象,且靠近癌细胞分布,提示可能是肿瘤产生的趋化因子和生长因子诱导具有吞噬功能的单核细胞聚集,最终转化为OGCs。本组病例单核细胞和OGCs免疫表型一致也支持这一观点。
胰腺的未分化癌比低分化癌预后更差[22-24],3年生存率低于3%,平均为5个月[2,4,19]。与低分化癌相比,未分化癌表达的表面黏附分子如E-cadherin、β-catenin表达更低,易发生淋巴结和远处转移[23]。但大多数研究认为UOC恶性程度较低,预后较好[4,17],因此应给予重视并将它们区别出来。因该病罕见,尚缺乏有统计学依据的诊断治疗指南,目前主要依靠经验治疗。伴有OGCs的胰腺未分化癌可囊性变,很难在术前正确诊断,因此对胰腺的囊性肿瘤建议手术完全切除,术后可行5~6个月疗程化疗,定期复查。相信随着临床病例资料的积累和医疗技术的发展,人们对UOC会有更加全面和深入的认识。
利益冲突所有作者声明不存在利益冲突

