破骨细胞能量代谢的研究进展
王银博 孙维佳 李玉恒 凌树宽 李英贤1,*
1.空军军医大学航天航空医学系,陕西 西安 710038 2.中国航天员科研训练中心航天医学基础与应用国家重点实验室,北京 100094
能量代谢对于维持机体的生理功能具有重要意义,一方面,机体的任何有机活动都需要能量参与,另一方面,能量代谢的异常会导致机体生理功能的异常。在骨骼生长发育以及不断重塑的过程中,破骨细胞发挥重要功能[1-3],在其分化过程以及发挥功能的不同阶段,能量代谢无时无刻不参与其中,并且能量代谢的方式也发生转变[4],积极适应细胞在不同阶段对能量的需求。近年来,破骨细胞能量代谢的研究主要集中在破骨细胞分化过程中的线粒体生物发生(新的线粒体DNA和蛋白质的产生)及其意义,以及破骨细胞在分化和发挥噬骨功能不同阶段主要的代谢方式及其意义。本文将结合近年的研究,对这些方面进行概述。
1 破骨细胞分化伴随线粒体生物发生
线粒体生物发生的转录调控主要是通过过氧化物酶体增殖物激活受体-γ共激活因子-1(peroxisome proliferator-activated receptor-γ coactivator-1,PGC-1)家族发挥作用[5]。PGC-1能够对细胞营养状况作出响应,例如烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)与还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotid,NADH)以及一磷酸腺苷(adenosine monophosphate,AMP)与ATP比率的变化,进而通过调控PGC-1自身的乙酰化和去乙酰化灵活地控制线粒体生物发生[6]。PGC-1能够与特定转录因子之间的相互作用调节线粒体的主要功能,包括脂肪酸β-氧化、三羧酸循环(tricarboxylic acid cycle,TCA cycle)、mtDNA复制和氧化磷酸化以及电子传递[7]。研究显示,核因子κB受体激活剂配体(NF-κB receptor activator ligand,RANKL)诱导骨髓巨噬细胞(bone marrow macrophages,BMMs)生成破骨细胞,线粒体大小和数量随之增加,成熟的破骨细胞含有大量线粒体[8-10]。在RANKL诱导破骨细胞形成过程中,PGC-1β的表达增加,体外敲低PGC-1β,线粒体基因表达受到抑制,破骨细胞分化受到抑制。并且,PGC-1β全KO小鼠由于成熟破骨细胞形态异常,骨吸收功能受损,μCT显示,骨量增加[11]。另有研究显示,RANKL诱导PGC-1β敲除型和野生型 BMMs破骨向分化未出现明显差异,而PGC-1β敲除的成熟破骨细胞功能受抑制,这种功能的缺陷是由于破骨细胞肌动蛋白环的形成障碍以及细胞骨架功能障碍引起,并且这种破骨细胞PGC-1β特异性敲除的小鼠出现骨硬化症[12]。这些研究表明线粒体生物发生对破骨细胞的分化和功能具有重要意义。
PGC-1β敲除的破骨细胞出现的肌动蛋白环缺失可通过过表达GPCR激酶2相互作用蛋白1(GPCR kinase 2 interacting protein1,GIT1)得到明显的改善,过表达GIT1显著增加了线粒体酶Cox1、Cox3、ND4和Cytb的表达。这项研究说明,PGC-1β以线粒体/GIT1依赖性方式调节破骨细胞的细胞骨架,调节破骨细胞的骨吸收能力[12]。ASXL2是Trithorax和Polycomb增强子(enhancers of trithorax and polycomb,ETP)家族的一种蛋白,调节组蛋白甲基化,ASXL2能够调控PGC-1β表达和破骨细胞分化,并且ASXL2基因敲除小鼠出现骨硬化表型[13]。与PGC-1β共同协调发挥作用的还有氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptorγ,PPARγ,转录因子核受体家族成员之一)和雌激素相关受体α(estrogen-related receptorα,ERRα)。破骨细胞分化过程中,PPARγ的激活可通过下调β-Catenin和降低c-jun的含量间接诱导PGC-1β表达。反过来,PGC-1β充当PPARγ共激活剂,刺激破骨细胞分化。另外,PPARγ还诱导ERRa表达,ERRa与PGC-1β协调以增强线粒体的生物发生和破骨细胞功能。ERRa基因敲除小鼠破骨细胞功能出现缺陷[14]。这些研究充分说明了PGC-1β参与破骨细胞分化的重要过程(图 1)。
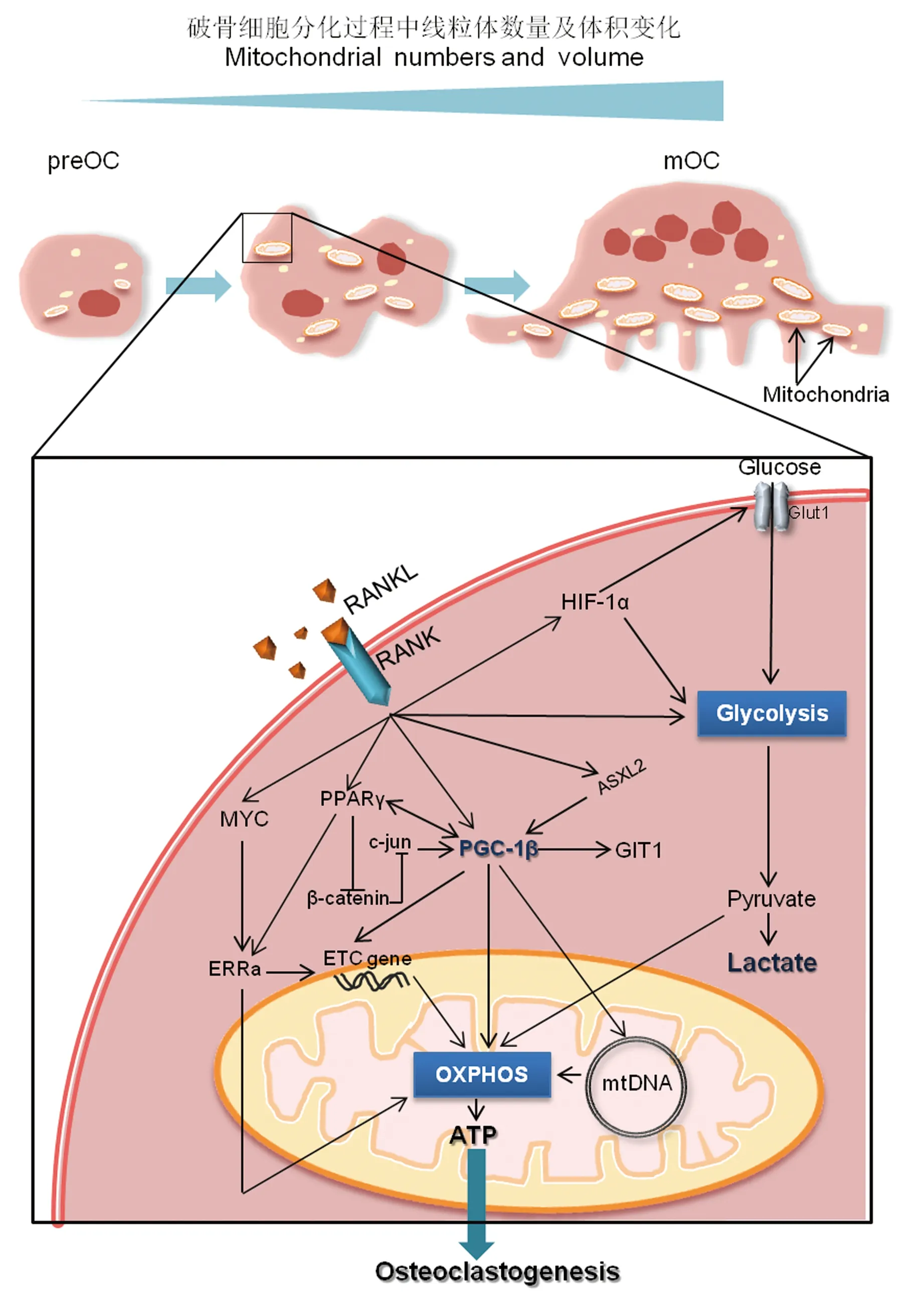
图1 破骨细胞的能量代谢及调控机制示意图Fig.1 Model for energy metabolism and regulatory mechanism of osteoclasts
线粒体具有自身的基因组,人类线粒体基因能够编码合成定位于线粒体内膜上的13种蛋白,这些蛋白是线粒体呼吸链复合体Ⅰ至复合体Ⅳ的核心组成部分[15]。线粒体转录因子A(Tfam)调节mtDNA的转录和修复,并控制mtDNA的拷贝数,是线粒体生物发生的重要调控因子[16-17]。Tfam特异性敲除的破骨细胞mtDNA减少,ATP的产生降低,凋亡加快。但是体内研究显示,破骨细胞Tfam选择性敲除的小鼠骨量与WT小鼠相似,而且该基因型小鼠的破骨细胞凋亡加快,骨吸收活性增强[18]。这些结果表明线粒体的生物发生似乎并不是破骨细胞形成和发挥功能的关键决定因素。
2 氧化磷酸化及调控机制
葡萄糖氧化磷酸化已被确定为破骨细胞分化形成的主要能量来源[19]。RANKL诱导破骨细胞分化前期(48 h以内,未成熟破骨细胞),线粒体呼吸作用增强,用线粒体复合物抑制剂(如鱼藤酮和抗霉素A)或ATP合酶抑制剂(寡霉素)阻断ATP的产生,破骨细胞的生成受到了阻碍[20-21]。与破骨前体细胞(未成熟破骨细胞)相比,RANKL诱导破骨细胞分化后,线粒体呼吸链蛋白表达升高,完全分化的破骨细胞显示出更高量的电子传递链酶[8]。全身敲除线粒体复合体Ⅰ亚基Ndufs4的小鼠,呈现骨量增加的表型。Ndufs4敲除小鼠的BMMs,体外RANKL诱导培养显示,多核抗酒石酸酸性磷酸酶阳性(anti-tartaric acid phosphatase positive,TRAP+)细胞(破骨细胞)数量减少、体积变小、骨吸收活性降低[22]。MYC能够诱导ERRα和电子传递链(electron transfer chain,ETC)基因的表达,在激活氧化磷酸化中起重要作用。破骨细胞特异性MYC敲除的小鼠骨量增加,并能够有效地对抗卵巢切除术(ova -riectomy,OVX)诱导的骨丢失[23]。但是与破骨细胞分化相反,体外研究成熟破骨细胞发挥骨吸收功能代谢特点时发现,氧化磷酸化作用降低,骨吸收反而增强。用不产生毒性计量的鱼藤酮(线粒体复合体I的抑制剂)处理破骨细胞,破骨细胞骨吸收活性增强[8]。这些研究说明破骨细胞分化和发挥骨吸收功能的不同阶段能量代谢方式不同。除了氧化磷酸化外还存在其他的重要代谢途径,现在研究比较多的是糖酵解途径。
3 糖酵解及调控机制
葡萄糖代谢被证明是破骨细胞的主要能量来源[19,24-25]。研究显示,与未进行诱导的BMMs相比,RANKL诱导的前期破骨细胞(48 h以内,未成熟破骨细胞),糖酵解速率增加[20],糖酵解作用增强[26]。破骨细胞分化过程中6-磷酸果糖-2-激酶/果糖-2,6-双磷酸酶3(PFKFB3)被上调,它是糖酵解过程的一种限速酶。PFKFB3在BMMs中的遗传缺陷和药理抑制能够抑制破骨细胞的分化和功能,腹腔注射PFKFB3抑制剂PFK15可防止卵巢切除术引起的骨丢失,其作用机制是抑制破骨细胞分化过程中重要信号通路分子NF-κB和MAPK的活化[21]。在破骨细胞分化形成过程中,RANKL激活HIF-1α并诱导Glut1和糖酵解酶的表达[27],Glut1是破骨细胞分化所必需的[19]。乳酸脱氢酶(lactate dehydrogenase,LDH)催化丙酮酸转化为乳酸,体内和体外实验均证明,LDHA或LDHB的敲低会降低代谢水平,下调NFATc1表达,抑制破骨细胞前体的融合[26]。这些结果说明在破骨细胞分化阶段,糖酵解作用增强,并且发挥重要的作用。
体外BMMs诱导为破骨细胞过程中,在BMMs、前破骨细胞和成熟破骨细胞(mature osteoclast,mOC)3个不同阶段,应用全基因表达分析技术解析代谢变化,结果显示,在mOC中,Glut1的表达明显高于BMMs。糖酵解过程限速酶,包括己糖激酶(hexokinase,HK)、磷酸果糖激酶(phosphofructo-kinase,PFK)和丙酮酸激酶在mOC中的表达同样升高,乳酸脱氢酶A和B以及血管内皮生长因子A和B在mOC中的表达也明显增加[28]。相对于静止的前体细胞,成熟的破骨细胞拥有更高的糖酵解速率[8]。当成熟的破骨细胞暴露于仅有葡萄糖的培养基中时,Ⅰ型胶原蛋白的降解活性明显增强,免疫组织化学分析发现与糖酵解途径相关的丙酮酸激酶2(pyruvate kinase 2,PKM2)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)位于成熟破骨细胞的封闭区域,该区域是发挥骨吸收的重要部位。这些结果表明糖酵解是成熟破骨细胞骨吸收阶段的主要能量来源[8]。
破骨细胞中谷氨酰胺能够转化为谷氨酸,进而转化为α-KG提供能量,缺失谷氨酰胺,破骨细胞分化受到抑制,但是添加可透膜的a-KG类似物能够缓解分化抑制,突显了谷氨酰胺分解供应a-KG在破骨细胞分化中的重要性[28]。
破骨细胞分化过程伴随着线粒体的生物发生,并且在分化前期氧化磷酸化和糖酵解作用都呈上升趋势,而糖酵解作用在破骨细胞成熟阶段作为主要能量来源。总之,破骨细胞的能量代谢是一个复杂的系统,其如何影响破骨细胞的分化和功能还有待进一步研究。
4 展望
骨质疏松症的主要特征是成骨细胞与破骨细胞共同作用下骨量下降和骨三维结构破坏[29]。骨质疏松性骨折严重影响老年人生活质量, 也是导致老年人死亡的常见原因之一[30]。研究破骨细胞的能量代谢,是为了从能量代谢的角度来寻找潜在的靶点,通过影响破骨细胞的分化和功能调节骨平衡,即对骨质疏松症的发生进行有效的干预。

