根瘤菌对Cu胁迫下白三叶生长和Cu含量的影响
邹萌萌, 周卫红,2, 张静静, 陶春柳, 刘晓青, 李建龙,①
(1. 南京大学生命科学学院, 江苏 南京 210093; 2. 江苏科技大学苏州理工学院, 江苏 张家港 215600;3. 苏州健雄职业技术学院, 江苏 苏州 215411; 4. 南京农业大学草业学院, 江苏 南京 210095)
Cu是植物生长发育必需的微量元素,能够影响植物蛋白质结构,参与细胞氧化还原反应,并调节植物体重要代谢过程;Cu还是叶绿体中质体蓝素的组成成分,参与光电子传递过程,利于叶绿素的合成和稳定。然而,随着中国工业化和城市化进程的快速推进,土壤Cu污染问题日益突出。在农业生产过程中,大量或长期使用含Cu杀菌剂导致土壤Cu含量急剧升高,远远超过植物生长需要的土壤Cu含量的阈值,致使植物叶片光合作用受阻,不利于植株生长[1-3],因此,亟待修复Cu污染土壤。
植物修复技术是指利用重金属超积累或耐受植物修复重金属污染土壤,具有成本低廉、美化环境、提高土壤有机质含量和土壤肥力等优点,受到国内外学者的广泛关注[4]。但是,目前发现的耐受植物对土壤重金属污染的耐受性均较低,而超富集植物又存在植株矮小、生长缓慢和修复土壤周期长等问题,均难以满足修复高污染土壤和快速修复污染土壤的需要[5-6]。牧草具有生长快、生物量大、重金属吸收量多且易于栽培管理等特点,近年来成为修复重金属污染土壤的研究热点[7]。白三叶(TrifoliumrepensLinn.)又名白车轴草,为普遍栽种的豆科(Fabaceae)多年生优良牧草,对土壤Cu污染具有一定的耐受性和富集能力[8-9]。
根瘤菌是广泛分布于土壤中的革兰氏阴性杆状细菌,常与豆科植物共生,形成根瘤并固定空气中的氮,从而促进植物生长,增强植物的抗病性和抗逆性。根瘤菌与豆科植物形成的共生体系在重金属污染土壤修复中的应用及潜力逐渐受到研究者的关注[10]。研究发现,接种根瘤菌Bradyrhizobiumsp. (vigna)能显著提高绿豆〔Vignaradiata(Linn.) Wilczek〕的产量及N和P的吸收量[11];接种根瘤菌SinorhizobiummelilotiCCNWSX0020使天蓝苜蓿(MedicagolupulinaLinn.)的生物量和Cu含量分别增加了78.2%和39.3%[12]。
为了探究根瘤菌对Cu污染土壤中白三叶Cu耐受性的影响,作者采用盆栽法比较了Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中对照组(接种灭菌的2.7×109CFU·mL-1RhizobiumtrifoliiACCC18017菌悬液)和接菌组(先后接种2.7×109和2.3×109CFU·mL-1R.trifoliiACCC18017菌悬液)白三叶的株高、根长、地上部和地下部的鲜质量和干质量、叶片叶绿素含量及地上部和地下部的Cu含量,以期明确根瘤菌对Cu污染土壤中白三叶生长和Cu吸收的影响,为利用根瘤菌-白三叶共生体系修复Cu污染土壤提供参考依据。
1 材料和方法
1.1 材料
实验使用的白三叶种子购自北京百绿集团。挑选籽粒饱满、大小均匀的种子,先用蒸馏水浸泡24 h,再用体积分数75%乙醇灭菌3~5 min,最后用无菌水冲洗3次,备用。
实验使用的根瘤菌为三叶草根瘤菌R.trifoliiACCC18017,由中国农业微生物菌种保藏管理中心提供。实验前,对根瘤菌的耐Cu能力进行检测,该菌株在Cu浓度为0.6 mmol·L-1的酵母甘露醇(YMA)固体培养基上能够正常生长。
实验使用的土壤取自南京大学生命科学学院后山。取0~20 cm土层的土壤,过筛(孔径0.8 mm),室温放置3~4 d,待土壤自然风干后,将其与营养土(购自南京斑马实验耗材有限公司)按照质量比2∶1的比例混合均匀后作为栽培基质。栽培基质中有机质含量为32.70 g·kg-1,全氮含量为2.43 g·kg-1,碱解氮含量为74.26 mg·kg-1,速效磷含量为0.18 g·kg-1,速效钾含量为0.18 g·kg-1,Cu含量为33.36 mg·kg-1,pH 7.15。
1.2 方法
1.2.1 菌悬液制备 使用YMA固体培养基先将三叶草根瘤菌R.trifoliiACCC18017活化,再将活化的根瘤菌接种至YMA液体培养基中,置于28 ℃条件下150 r·min-1振荡培养至对数生长期,分别获得浓度为2.7×109和2.3×109CFU·mL-1的菌悬液。
1.2.2 盆栽实验 于2017年9月5日在南京大学生命科学学院露天阳台进行盆栽实验。称取适量CuSO4固体粉末,加水制成浓度分别为0.011 8、0.023 6和0.035 4 mol·L-1的CuSO4溶液;分别取上述CuSO4溶液各200 mL,逐层喷洒到栽培基质中,并搅拌均匀,使栽培基质中的Cu添加量分别为500、1 000和1 500 mg·kg-1,Cu添加量为0 mg·kg-1的栽培基质喷洒200 mL蒸馏水。将各组栽培基质分别装入直径16 cm、高20 cm的塑料花盆中,每盆装入栽培基质1.5 kg,室温下静置2周。将供试白三叶种子平均分成2组,一组置于2.7×109CFU·mL-1菌悬液中浸泡10 min,作为接菌组;另一组用灭菌的2.7×109
CFU·mL-1菌悬液浸泡10 min,作为对照组。将白三叶种子均匀撒播在栽培基质中,覆土厚度0.5~1.0 cm,每组播种6盆,每盆30粒种子,各3个重复。待幼苗高2~3 cm时,对接菌组幼苗进行2次接菌,用注射器沿植株根部注入2.3×109CFU·mL-1菌悬液,每盆注入8 mL。待幼苗高10 cm时间苗,每盆保留长势良好的幼苗15株。实验期间定期浇水,保持栽培基质的含水量为田间最大持水量的60%~70%。用托盘收集渗出的水,将渗出的水重新浇入花盆中。
1.2.3 根瘤菌-白三叶共生体系检测 为了确保接菌组白三叶植株根部接种上根瘤菌,培养结束后,每盆选取1株白三叶植株,采集植株根部根瘤,先用无菌水冲洗干净,再用体积分数95%乙醇浸泡30 s,接着用质量体积分数0.1%AgCl2溶液杀菌5 min,最后用无菌水冲洗6次。将灭菌的根瘤置于2片无菌载玻片之间,用力挤压使根瘤破碎,用接种环沾取适量汁液,在YMA固体培养基上划线,置于28 ℃条件下培养2 d;待长出菌落后,将培养基上的菌落与R.trifoliiACCC18017进行形态学对比。此外,对接菌组白三叶根部的根瘤菌进行耐Cu能力检测,比较该根瘤菌的耐Cu能力与R.trifoliiACCC18017的耐Cu能力是否相同。若培养菌落的形态特征和耐Cu能力与R.trifoliiACCC18017均相同,则认为培养出的菌株为R.trifoliiACCC18017。
1.2.4 生长指标测定 种植12周后,每盆随机选取6株白三叶植株,使用直尺(精度1 mm)测量植株的株高,结果取平均值;挖出完整植株,尽量避免破坏根瘤,先用自来水轻轻冲洗,洗净根瘤和根部表面的泥土和杂质,再用去离子水浸泡30 min,使用直尺测量植株的主根长度,结果取平均值。
将每盆的所有植株挖出,自来水冲洗干净,吸水纸吸干表面水分,将植株分成地上部和地下部2个部分,使用电子天平(精度0.01 g)分别称量每盆所有植株地上部和地下部的总质量,即地上部和地下部的鲜质量;分别将每盆所有植株地上部和地下部装入信封中,先在105 ℃条件下杀青30 min,再在75 ℃条件下烘干至恒质量,分别称量每盆所有植株地上部和地下部的总质量,即地上部和地下部的干质量。
1.2.5 叶片叶绿素含量测定 随机选取白三叶成熟叶片,每盆约0.1 g,准确称量后剪碎,放入具塞玻璃试管中;加入10 mL丙酮-乙醇混合液,黑暗条件下提取14 h;用756MC紫外-可见分光光度计(上海菁华仪器科技有限公司)测定提取液在波长645和663 nm下的OD值。参照文献[13],根据公式“叶绿素a含量=(12.70OD663-2.69OD645)·(V/1 000m)”、“叶绿素b含量=(22.99OD645-4.68OD663)·(V/1 000m)”和“总叶绿素含量=(20.20OD645+8.02OD663)·(V/1 000m)”分别计算叶绿素a、叶绿素b和总叶绿素的含量。式中,OD645和OD663分别为提取液在波长645和663 nm下的OD值,V为提取液体积,m为叶片鲜质量。并且,计算叶绿素a含量与叶绿素b含量的比值。
1.2.6 Cu含量测定 将烘干的地上部和地下部样品粉碎,分别取0.2 g样品,放入聚四氟乙烯消解罐中;依次加入5 mL浓HNO3和2 mL H2O2,微波(功率1 600 W)消解20 min;待溶液澄清后,定容至50 mL;过滤,使用ICAP6300电感耦合等离子发射光谱仪(美国Thermo Fisher公司)测定地上部和地下部的Cu含量。
1.3 数据处理和统计分析
采用EXCEL 2010软件计算相关数据的平均值和标准差,采用SPSS 20.0软件进行LSD单因素方差分析,采用Origin Pro 9.1软件绘图。
2 结果和分析
2.1 根瘤菌对Cu胁迫下白三叶生长的影响
2.1.1 对株高和根长的影响 根瘤菌对Cu胁迫下白三叶株高和主根长的影响见表1。由表1可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中接菌组(先后接种2.7×109和2.3×109CFU·mL-1R.trifoliiACCC18017菌悬液)白三叶的株高均高于对照组(接种灭菌的2.7×109CFU·mL-1R.trifoliiACCC18017菌悬液),分别较对照组增加了19.5%、12.6%、27.7%和14.1%;其中,Cu添加量为0和1 000 mg·kg-1土壤中接菌组白三叶的株高显著(P<0.05)高于对照组。Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的株高显著高于Cu添加量为0 mg·kg-1的土壤;Cu添加量为500、1 000和1 500 mg·kg-1土壤中对照组白三叶的株高随着Cu添加量提高而显著降低,而Cu添加量为500 mg·kg-1土壤中接菌组白三叶的株高显著高于Cu添加量为1 000和1 500 mg·kg-1的土壤,但Cu添加量为1 000和1 500 mg·kg-1土壤中接菌组白三叶的株高差异不显著。
由表1还可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中接菌组白三叶的主根长均大于对照组,分别较对照组增加了2.0%、7.3%、9.7%和12.4%,但不同Cu添加量土壤中对照组和接菌组白三叶的主根长差异均不显著。Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的主根长均最长,Cu添加量为500、1 000和1 500 mg·kg-1土壤中对照组和接菌组白三叶的主根长均随着Cu添加量提高而降低,且不同Cu添加量土壤中对照组和接菌组白三叶的主根长差异均不显著。



土壤Cu添加量/(mg·kg-1)Cu addition in soil株高/cm Height主根长/cm Main root lengthCKTCKT08.95±0.50Bb10.66±0.73Ab17.03±1.78Aa17.33±2.43Aa50012.04±1.07Aa13.56±1.07Aa19.61±0.40Aa21.03±2.50Aa1 0009.03±0.65Bb11.53±0.63Ab17.22±1.57Aa18.89±1.05Aa1 5006.95±0.41Ac10.22±0.79Ab14.73±1.40Aa16.57±0.41Aa
1)CK: 对照组(接种灭菌的2.7×109CFU·mL-1RhizobiumtrifoliiACCC18017菌悬液) The control group (inoculated with sterilized 2.7×109CFU·mL-1RhizobiumtrifoliiACCC18017 suspension); T: 接菌组(先后接种2.7×109和2.3×109CFU·mL-1R.trifoliiACCC18017菌悬液) Inoculation group (successively inoculated with 2.7×109and 2.3×109CFU·mL-1R.trifoliiACCC18017 suspensions). 同行中不同大写字母表示同一指标在对照组和接菌组间差异显著(P<0.05) Different capitals in the same row indicate the significant (P<0.05)difference in the same index between the control group and inoculation group; 同列中不同小写字母表示同一指标在不同Cu添加量土壤间差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference in the same index among soils with different Cu additions.
2.1.2 对鲜质量和干质量的影响 根瘤菌对Cu胁迫下白三叶地上部和地下部的鲜质量和干质量的影响见图1。由图1可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中接菌组白三叶的地上部鲜质量均高于对照组,分别较对照组增加了28.8%、32.1%、29.0%和7.2%;其中,Cu添加量为0、500和1 000 mg·kg-1土壤中接菌组白三叶的地上部鲜质量显著高于对照组。Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的地上部鲜质量显著高于Cu添加量为0 mg·kg-1的土壤;Cu添加量为500、1 000和1 500 mg·kg-1土壤中对照组和接菌组白三叶的地上部鲜质量随着Cu添加量提高而降低,其中,Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的地上部鲜质量显著高于Cu添加量为1 000和1 500 mg·kg-1的土壤,Cu添加量为1 000和1 500 mg·kg-1土壤中对照组白三叶的地上部鲜质量则低于或显著低于Cu添加量为0 mg·kg-1的土壤,而Cu添加量为1 000和1 500 mg·kg-1土壤中接菌组白三叶的地上部鲜质量显著低于Cu添加量为0 mg·kg-1的土壤。

: 对照组(接种灭菌的2.7×109 CFU·mL-1 Rhizobium trifolii ACCC18017菌悬液) The control group (inoculated with sterilized 2.7×109 CFU·mL-1 Rhizobium trifolii ACCC18017 suspension); : 接菌组(先后接种2.7×109和2.3×109 CFU·mL-1 R. trifolii ACCC18017菌悬液) Inoculation group (successively inoculated with 2.7×109 and 2.3×109 CFU·mL-1 R. trifolii ACCC18017 suspensions). 不同大写字母表示同一指标在对照组和接菌组间差异显著(P<0.05) Different capitals indicate the significant (P<0.05) difference in the same index between the control group and inoculation group; 不同小写字母表示同一指标在不同Cu添加量土壤间差异显著(P<0.05) Different lowercases indicate the significant (P<0.05) difference in the same index among soils with different Cu additions.
由图1还可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中接菌组白三叶的地下部鲜质量均高于对照组,分别较对照组增加了37.8%、29.8%、43.5%和22.8%;其中,Cu添加量为0、500和1 000 mg·kg-1土壤中接菌组白三叶的地下部鲜质量显著高于对照组。Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的地下部鲜质量显著高于Cu添加量为0 mg·kg-1的土壤;Cu添加量为500、1 000和1 500 mg·kg-1土壤中对照组和接菌组白三叶的地下部鲜质量随着Cu添加量提高而降低,其中,Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的地下部鲜质量显著高于Cu添加量为1 000和1 500 mg·kg-1的土壤,Cu添加量为1 000和1 500 mg·kg-1土壤中对照组白三叶的地下部鲜质量显著低于Cu添加量为0 mg·kg-1的土壤,而Cu添加量为1 000和1 500 mg·kg-1土壤中接菌组白三叶的地下部鲜质量则低于或显著低于Cu添加量为0 mg·kg-1的土壤。
由图1还可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中接菌组白三叶的地上部干质量均高于对照组,分别较对照组增加了91.3%、81.8%、52.1%和24.1%;其中,Cu添加量为0、500和1 000 mg·kg-1土壤中接菌组白三叶的地上部干质量显著高于对照组。Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的地上部干质量显著高于Cu添加量为0 mg·kg-1的土壤;Cu添加量为500、1 000和1 500 mg·kg-1土壤中对照组和接菌组白三叶的地上部干质量随着Cu添加量提高而降低,其中,Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的地上部干质量显著高于Cu添加量为1 000和1 500 mg·kg-1的土壤,而Cu添加量为1 000和1 500 mg·kg-1土壤中对照组和接菌组的白三叶地上部干质量与Cu添加量为0 mg·kg-1的土壤差异不显著。
由图1还可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中接菌组白三叶的地下部干质量均高于对照组,分别较对照组增加了29.0%、44.4%、6.3%和8.3%;其中,Cu添加量为0和500 mg·kg-1土壤中接菌组白三叶的地下部干质量显著高于对照组。Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶的地下部干质量高于或显著高于Cu添加量为0 mg·kg-1的土壤;Cu添加量为500、1 000和1 500 mg·kg-1土壤中对照组和接菌组白三叶的地下部干质量随着Cu添加量提高而降低,而Cu添加量为1 000 mg·kg-1土壤中对照组和接菌组白三叶的地下部干质量与Cu添加量为1 500 mg·kg-1的土壤差异不显著。
2.1.3 对叶片叶绿素含量的影响 根瘤菌对Cu胁迫下白三叶叶片叶绿素含量的影响见表2。由表2可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中接菌组白三叶叶片的叶绿素a含量均高于对照组,分别较对照组增加了33.0%、12.7%、4.3%和27.4%,但无显著差异。Cu添加量为500 mg·kg-1土壤中对照组和接菌组白三叶叶片的叶绿素a含量最高,Cu添加量为500、1 000和1 500 mg·kg-1土壤中对照组和接菌组白三叶叶片的叶绿素a含量基本上随着Cu添加量提高而降低,并且,对照组和接菌组白三叶叶片的叶绿素a含量在不同Cu添加量土壤中无显著差异。
由表2还可以看出:Cu添加量为0 mg·kg-1土壤中对照组和接菌组白三叶叶片的叶绿素b含量相同;Cu添加量为500 mg·kg-1土壤中接菌组白三叶叶片的叶绿素b含量低于对照组;而Cu添加量为1 000和1 500 mg·kg-1土壤中接菌组白三叶叶片的叶绿素b含量均高于对照组,分别较对照组增加了39.3%和16.7%。对照组和接菌组白三叶叶片的叶绿素b含量随Cu添加量提高而波动。不同Cu添加量土壤中及对照组和接菌组间白三叶叶片的叶绿素b含量差异均不显著。
由表2还可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中对照组和接菌组白三叶叶片的总叶绿素含量和叶绿素a含量与叶绿素b含量的比值(Chla/Chlb)的变化趋势与叶绿素a含量变化基本一致,并且,不同Cu添加量土壤中及对照组和接菌组白三叶叶片的总叶绿素含量和Chla/Chlb值差异均不显著。


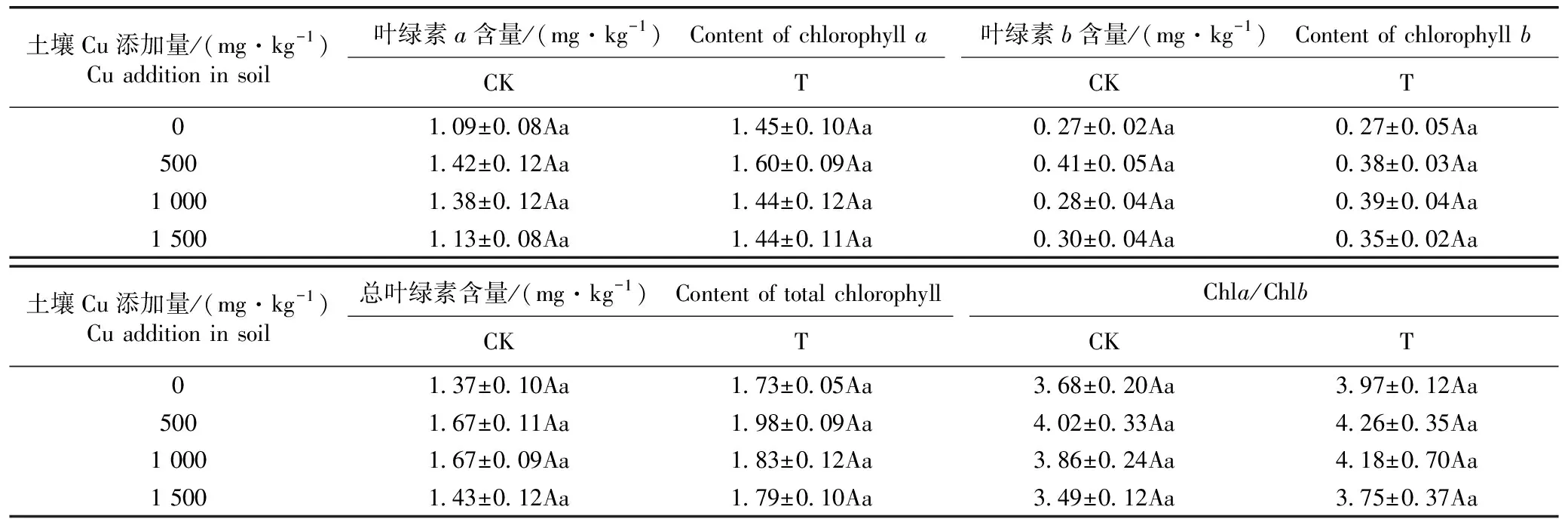
土壤Cu添加量/(mg·kg-1)Cu addition in soil叶绿素a含量/(mg·kg-1) Content of chlorophyll a叶绿素b含量/(mg·kg-1) Content of chlorophyll bCKTCKT01.09±0.08Aa1.45±0.10Aa0.27±0.02Aa0.27±0.05Aa5001.42±0.12Aa1.60±0.09Aa0.41±0.05Aa0.38±0.03Aa1 0001.38±0.12Aa1.44±0.12Aa0.28±0.04Aa0.39±0.04Aa1 5001.13±0.08Aa1.44±0.11Aa0.30±0.04Aa0.35±0.02Aa土壤Cu添加量/(mg·kg-1)Cu addition in soil总叶绿素含量/(mg·kg-1) Content of total chlorophyllChla/ChlbCKTCKT01.37±0.10Aa1.73±0.05Aa3.68±0.20Aa3.97±0.12Aa5001.67±0.11Aa1.98±0.09Aa4.02±0.33Aa4.26±0.35Aa1 0001.67±0.09Aa1.83±0.12Aa3.86±0.24Aa4.18±0.70Aa1 5001.43±0.12Aa1.79±0.10Aa3.49±0.12Aa3.75±0.37Aa
1)CK: 对照组(接种灭菌的2.7×109CFU·mL-1RhizobiumtrifoliiACCC18017菌悬液) The control group (inoculated with sterilized 2.7×109CFU·mL-1RhizobiumtrifoliiACCC18017 suspension); T: 接菌组(先后接种2.7×109和2.3×109CFU·mL-1R.trifoliiACCC18017菌悬液) Inoculation group (successively inoculated with 2.7×109and 2.3×109CFU·mL-1R.trifoliiACCC18017 suspensions); Chla/Chlb: 叶绿素a含量与叶绿素b含量的比值 Ratio of content of chlorophyllato content of chlorophyllb. 同行中不同大写字母表示同一指标在对照组和接菌组间差异显著(P<0.05) Different capitals in the same row indicate the significant (P<0.05) difference in the same index between the control group and inoculation group; 同列中不同小写字母表示同一指标在不同Cu添加量土壤间差异显著(P<0.05) Different lowercases in the same column indicate the significant (P<0.05) difference in the same index among soils with different Cu additions.
2.2 根瘤菌对Cu胁迫下白三叶Cu含量的影响
根瘤菌对Cu胁迫下白三叶地上部和地下部Cu含量的影响见图2。由图2可以看出:Cu添加量为0、500、1 000和1 500 mg·kg-1土壤中接菌组(先后接种2.7×109和2.3×109CFU·mL-1R.trifoliiACCC18017菌悬液)白三叶的地上部Cu含量均高于对照组(接种灭菌的2.7×109CFU·mL-1R.trifoliiACCC18017菌悬液),分别较对照组增加了19.9%、34.5%、40.1%和7.0%;其中,Cu添加量为500和1 000 mg·kg-1土壤中接菌组白三叶的地上部Cu含量显著(P<0.05)高于对照组。对照组白三叶的地上部Cu含量随着Cu添加量提高而显著升高;接菌组白三叶的地上部Cu含量在Cu添加量为0~1 000 mg·kg-1土壤中随着Cu添加量提高而显著升高,在Cu添加量为1 000 mg·kg-1土壤中达到最大值,但在Cu添加量为1 500 mg·kg-1土壤中显著降低。
由图2还可以看出:Cu添加量为500、1 000和1 500 mg·kg-1土壤中接菌组白三叶的地下部Cu含量均高于对照组,分别较对照组增加了55.4%、36.4%和8.5%;其中,Cu添加量为500和1 000 mg·kg-1土壤中接菌组白三叶的地下部Cu含量显著高于对照组。对照组和接菌组白三叶的地下部Cu含量基本上随着Cu添加量提高而升高;Cu添加量为1 500 mg·kg-1土壤中对照组白三叶的地下部Cu含量显著高于其他Cu添加量土壤,而接菌组白三叶的地下部Cu含量显著高于Cu添加量为0和500 mg·kg-1的土壤,但不显著高于Cu添加量为1 000 mg·kg-1的土壤。

: 对照组(接种灭菌的2.7×109 CFU·mL-1 Rhizobium trifolii ACCC18017菌悬液) The control group (inoculated with sterilized 2.7×109 CFU·mL-1 Rhizobium trifolii ACCC18017 suspension); : 接菌组(先后接种2.7×109和2.3×109 CFU·mL-1 R. trifolii ACCC18017菌悬液) Inoculation group (successively inoculated with 2.7×109 and 2.3×109 CFU·mL-1 R. trifolii ACCC18017 suspensions). 不同大写字母表示同一指标在对照组和接菌组间差异显著(P<0.05) Different capitals indicate the significant (P<0.05) difference in the same index between the control group and inoculation group; 不同小写字母表示同一指标在不同Cu添加量土壤间差异显著(P<0.05) Different lowercases indicate the significant (P<0.05) difference in the same index among soils with different Cu additions.
3 讨论和结论
本研究结果显示:Cu添加量为500 mg·kg-1土壤中对照组白三叶的株高、地上部和地下部的鲜质量及地上部干质量均显著(P<0.05)高于Cu添加量为0 mg·kg-1的土壤,其主根长和地下部干质量也高于Cu添加量为0 mg·kg-1的土壤;Cu添加量为1 000 mg·kg-1土壤中不接菌白三叶的株高、地上部鲜质量及地上部和地下部干质量与Cu添加量为0 mg·kg-1的土壤无显著差异。另外,Cu添加量为500、1 000和1 500 mg·kg-1土壤中对照组白三叶的主根长,叶片的叶绿素a、叶绿素b和总叶绿素含量及Chla/Chlb值与Cu添加量为0 mg·kg-1的土壤无显著差异;对照组白三叶的地上部和地下部Cu含量均随着Cu添加量提高而显著升高。说明白三叶对Cu胁迫具有较好的耐受性,能够适应一定程度的Cu污染土壤环境,因此,可将白三叶作为修复Cu污染土壤的备选植物。
相关研究结果[14-16]表明:适量的Cu能够促进植物生长,但当植物体内Cu含量过高时,Cu2+将替代叶绿素中心的Mg2+,破坏植物的光合作用,干扰植物体内的营养平衡,对植物产生毒害作用。本研究中, Cu添加量为500 mg·kg-1Cu土壤中对照组白三叶的株高、主根长、地上部和地下部的鲜质量和干质量以及叶片叶绿素含量(包括叶绿素a、叶绿素b和总叶绿素含量及Chla/Chlb值)均最高,说明在该Cu胁迫条件下白三叶生长良好,很可能是Cu对白三叶生长起到了一定的促进作用,具体作用机制有待深入研究。
根瘤菌能够通过多种方式促进植物生长,包括通过固氮作用提供植物生长所需的N、促进植物对P及其他营养元素的吸收[9]、分泌植物激素(如IAA)和特异性酶及改变土壤理化性质等[17-18]。本研究中,不同Cu添加量土壤中接菌组白三叶的株高、主根长、地上部和地下部的鲜质量和干质量均高于对照组,尤其是Cu添加量为0、500和1 000 mg·kg-1土壤中接菌组白三叶的株高及地上部和地下部的鲜质量和干质量基本上显著高于对照组,说明根瘤菌R.trifoliiACCC18017能够促进白三叶生长。
植物中的重金属含量是评价植物修复重金属污染土壤能力及其对重金属胁迫耐受性的重要指标。本研究中,Cu添加量为500和1 000 mg·kg-1土壤中接菌组白三叶的地上部和地下部Cu含量较对照组显著升高,说明根瘤菌R.trifoliiACCC18017能够促进Cu添加量为500和1 000 mg·kg-1土壤中白三叶对Cu的吸收。韦革宏等[19]认为,根瘤菌不但能通过促进共生植物生长、提高共生植物生物量的方式增强植物对重金属污染土壤的修复,还能通过分泌有机酸和酶等改变土壤中重金属元素的生物有效性,促进植物对重金属元素的吸收和累积。植物对土壤中重金属元素的去除率主要取决于体内重金属元素的总量,即植株干质量与重金属含量的乘积[20]。总体来看,Cu添加量为500和1 000 mg·kg-1土壤中接菌组白三叶地上部和地下部的干质量及Cu含量显著高于对照组,并且Cu添加量为500 mg·kg-1土壤中接菌组白三叶地上部和地下部的干质量显著高于Cu添加量为1 000 mg·kg-1的土壤,而Cu添加量为500 mg·kg-1土壤中接菌组白三叶地上部和地下部的Cu含量显著低于Cu添加量为1 000 mg·kg-1的土壤,说明根瘤菌R.trifoliiACCC18017利于白三叶修复一定程度的Cu污染土壤。
通常情况下,重金属元素对植物的毒害作用主要表现为植物体内的活性氧和膜脂过氧化物等理化指标的变化[21-22],而本研究仅对Cu胁迫下白三叶的株高、主根长、地上部和地下部的鲜质量和干质量、叶片叶绿素含量及地上部和地下部的Cu含量进行了研究,并未研究Cu胁迫对白三叶抗氧化系统的影响,因此,本研究结果并不能全面反映白三叶对Cu胁迫的响应,有待后续深入研究。此外,本研究土壤中Cu添加量的最大值为1 500 mg·kg-1,远远高于GB 15618—2018 《土壤环境质量农用地土壤污染风险管控标准(试行)》中农用地土壤污染风险Cu筛选值的最大值(200 mg·kg-1),因此,本研究模拟的Cu污染土壤与实际Cu污染土壤差异明显,研究结果在实际Cu污染土壤修复中具有局限性。
综上所述,接种根瘤菌R.trifoliiACCC18017能够促进白三叶生长及其对土壤中Cu的吸收,利于白三叶修复一定程度的Cu污染土壤。

