基于紫外—可见、红外及物理方法联用的参附注射液指纹图谱方法学建立
刘 涛,杨 丹,郑 燕,贺桢翔,张文静,罗 虹,潘春晖,杨红玉
(1.成都大学 药学与生物工程学院,四川 成都 610106;2.四川德成动物保健品有限公司,四川 德阳 618000)
0 引 言
参附注射液主要由红参、黑附片提取物组成,其有效成分为人参皂苷、乌头生物碱,主要用于治疗元气大亏、手足厥冷与头晕气短等症[1].参附注射液于1987年上市,并于1992年被国家中医药管理局批准为医院急诊必备中成药[2].据文献报道,参附注射液在临床应用过程中,通常会出现轻微不良反应.根据《卫生部药品标准中药成方制剂》规定,参附注射液评定标准仅局限于薄层鉴别、乌头类生物碱限量检查及人参皂苷含量测定等,并没有对其多个成分的全面评价.研究表明,中药指纹图谱可以较充分地反映中药复杂混合体系中各种化学成分量分布的整体状况,已广泛应用于中药的质量评价中[3-5].其中,紫外—可见指纹图谱是中药及其制剂质量分析中常用的一种方法,具有灵敏性高、精密度好和操作简单等优点[6],红外指纹图谱中建立的共有峰率和变异峰率两个独立指标,在二维参数空间中从相似性和差异性两个方面可同时对中药的质量进行分析,较一维参数空间具有更强的分辨能力[7];物理指纹图谱可对中药注射液的质量及稳定性进行评价[8].故本研究拟采用紫外—可见、红外、物理指纹图谱联用的方法,以全面、直观、有效地对参附注射液的质量及稳定性进行评价.
1 材料与仪器
1.1 材 料
实验所用材料包括:参附注射液(效期内批号,160609、160611、161102、160601、161011、170702、160612、170105;效期外批号,150501、130719、130718),由四川雅安三九药业有限公司提供;溴化钾(批号,20170526),购自天津市卒越化学品有限公司;水为怡宝纯净水.
1.2 仪 器
实验所用仪器包括:Spectrum-II型红外光谱仪(Pekin Elmer公司);PHS-3C型精密pH计、DDS-307型电导率仪(上海日岛科学仪器有限公司);E-201-C pH型复合电极(上海仪电科学仪器股份有限公司);101-1-S型电热鼓风干燥箱(成都雅源科技有限公司);TU-1810PC型紫外—可见分光光度计(北京普析通用仪器有限责任公司);SMC-30C型渗透压摩尔浓度测定仪(天津天河医疗仪器有限公司);WAY-2S型数字阿贝折射仪(上海申光仪器仪表有限公司).
2 方法与结果
2.1 紫外—可见指纹图谱
2.1.1 供试品溶液的制备.
精密量取2.00 mL参附注射液(批号,160612)于50 mL量瓶中,加纯净水至刻度,摇匀,制得供试品溶液.
2.1.2 光谱扫描条件.
用水作为空白对照,在波长200~800 nm下,以光谱带宽2.00 nm,光度模式为Abs,扫描间隔为1.0 nm,进行全波长扫描.
2.1.3 方法学考察.
按“2.1.1”项下方法制备供试品溶液,按“2.1.2”项所确定的光谱扫描条件进行扫描,得到图谱后,用样品的吸收波长对应的吸光度计算相对标准偏差RSD.测得精密度、重复性、稳定性考察项下紫外—可见图谱在297 nm、269 nm、243 nm波长处吸光度的RSD均小于5.0%.结果表明,方法的精密度、稳定性、重复性均符合要求.
2.1.4 样品图谱的采集及对照图谱的建立.
取8批参附注射液,按“2.1.1”项下所确定的方法制备供试品溶液,按“2.1.2”项所确定的光谱扫描条件进行扫描,得到8批参附注射液的紫外—可见叠加图谱,结果见图1,并取其吸光度的平均值得到对照紫外—可见指纹图谱,结果见图2.
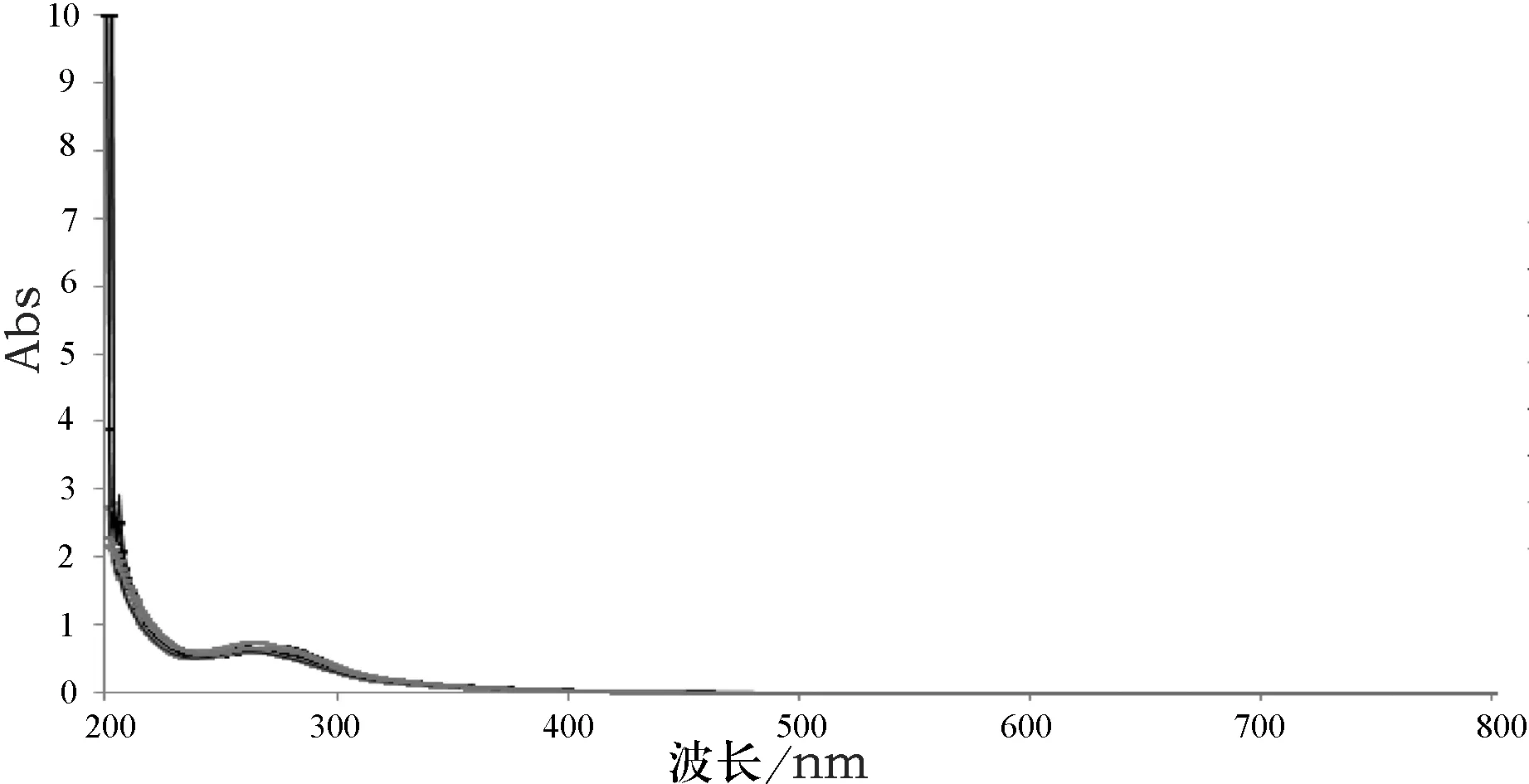
图1 8批参附注射液紫外—可见光谱叠加图
2.1.5 吸光度值限度.
8批有效期内的参附注射液的紫外—可见图谱于297 nm、269 nm、243 nm波长下的吸光度值结果见表1.
由表1可知,有效期内的参附注射液,按照“2.1.1”项所确定的方法制备供试品溶液,按“2.1.2"项所确定的光谱扫描条件扫描,所得紫外—可见图谱吸光度值应同时分别满足297 nm(0.330~0.460)、269 nm(0.587~0.734)、243 nm(0.520~0.630).

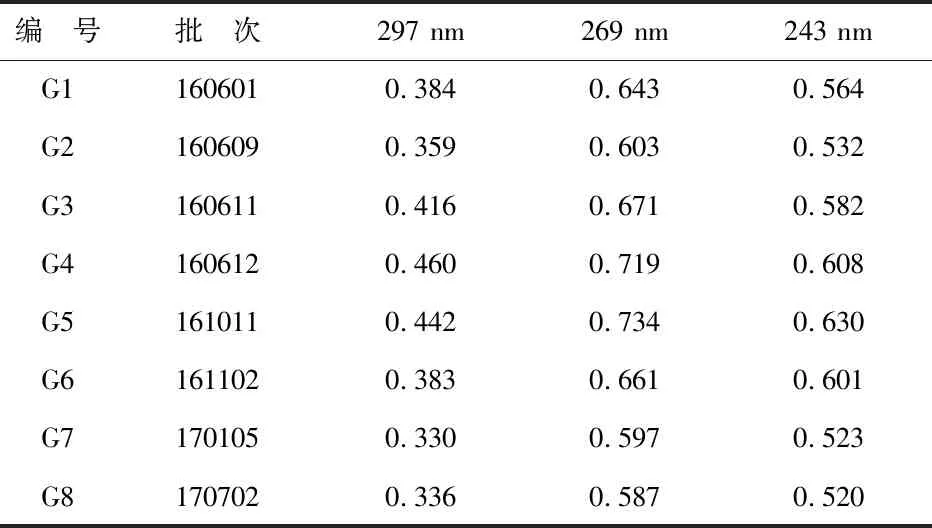
图2 参附注射液对照紫外—可见指纹图谱
2.1.6 验证实验.
按照“2.1.1”项所确定的方法制备供试品溶液,按“2.1.2”项所确定的光谱扫描条件扫描.结果表明,3批效期外参附注射液样品中,其吸光度值不符合限度要求.
2.2 红外指纹图谱
2.2.1 测试条件.
精密吸取参附注射液50 μL于玛瑙研钵中,挥干,加入0.1 g溴化钾,研磨均匀后,压片,在红外光谱仪中测定,测定区域为4 000~450 cm-1.
2.2.2 方法学考察.
按照“2.2.1”项下的测试条件进行测定,计算图谱中4个特征吸收波数处透光率的相对标准偏差RSD.经考察,测得精密度、稳定性、重复性项下4个特征吸收波数所对应透光率RSD均小于5.0%.结果表明,方法的精密度、稳定性、重复性均符合要求.
2.2.3 不同批次参附注射液红外指纹图谱的采集.
11批不同批次参附注射液的红外指纹图谱如图3所示.
2.2.4 红外指纹图谱共有峰和变异峰的确定.
在红外指纹图谱中,对于不同图谱的共有峰可以采用正态分布进行检验.通过检验后,若组内吸收峰的波数最大差异显著小于其相邻组之间的平均波数差,可将其确定为是一组共有峰,相反则为变异峰.共性识别指标为:共有峰率,P=(Ng/Nd)×100%;变异峰率,Pva=(na/Ng)×100%;Pvb=(nb/Ng)×100%,Nd=Ng+na+nb.其中Pva、Pvb、Ng、Nd、na、nb分别为a图谱的变异峰率、b图谱的变异峰率、2图谱中共有峰数、独立峰数、a图谱的变异峰数、b图谱的变异峰数.
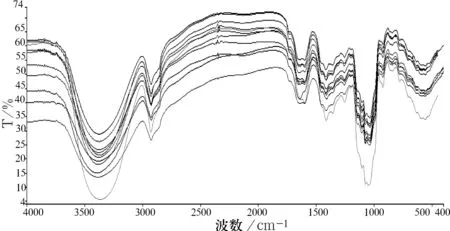
图3 11批参附注射液红外光谱叠加图
2.2.5 指纹图谱共有峰识别及双指标标准建立.
根据红外指纹图谱测定数据,以各样品为参考,利用红外指纹图谱变异峰率及共有峰率计算公式计算出样品之间的变异峰率及共有峰率,按照不同批次参附注射液共有峰率大小排成n维序列片段,该系列称为共有峰率和变异峰率的双指标序列.通过该双指标序列可以衡量不同批次样品之间相似度,选取效期内的8批参附注射液,建立共有峰率及变异峰率标准范围,结果如表2所示.
由表2可知,参附注射液的共有峰率为54.83%~91.67%,变异峰率为0.00%~52.94%.
2.2.6 验证实验.
取3批效期外参附注射液,根据红外指纹图谱测定数据,以各样品为参考,利用红外指纹图谱变异峰率及共有峰率计算公式计算出样品之间的变异峰率及共有峰率,按照不同批次参附注射液共有峰率大小排成n维序列片段.结果表明,效期外3批参附注射液共有峰率最低为51.72%,变异峰率最高为53.33%,其中,1批不符合限度要求,其余2批均符合限度要求.
2.3 物理指纹图谱
2.3.1 物理质量指标的测定方法.
参附注射液物理指纹图谱中参数的测定首选法定标准收载方法[8-9],其相关指标包括:氢离子浓度指数(pH)、电导率(G)、相对密度(d)、运动黏度(v)、固含物(M)、浊度(T)、渗透压摩尔浓度(O)、折光率(n).
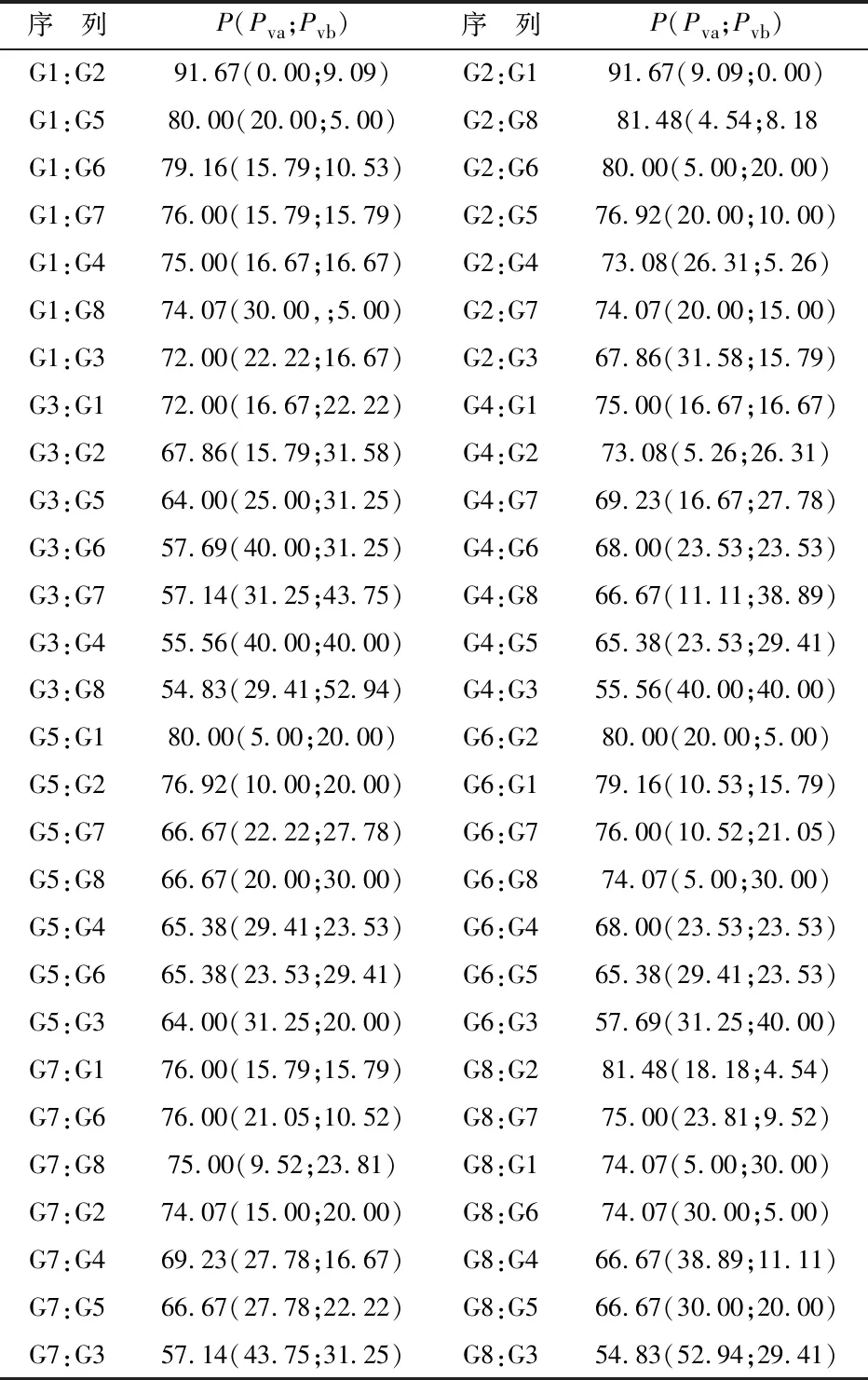
表2 8批参附注射液红外指纹图谱共有峰及变异峰率/%
2.3.2 物理质量指标的标准化转换.
由于用于构建物理指纹图谱的8个物理参数的数值和量纲不同,为了方便定量直观地利用雷达图进行展示,参考药典标准和物理化学参数手册,确定每个指标的可能数值范围,然后将其标准化至同一尺度,即0~10.参附注射液物理参数标准转换见表3.
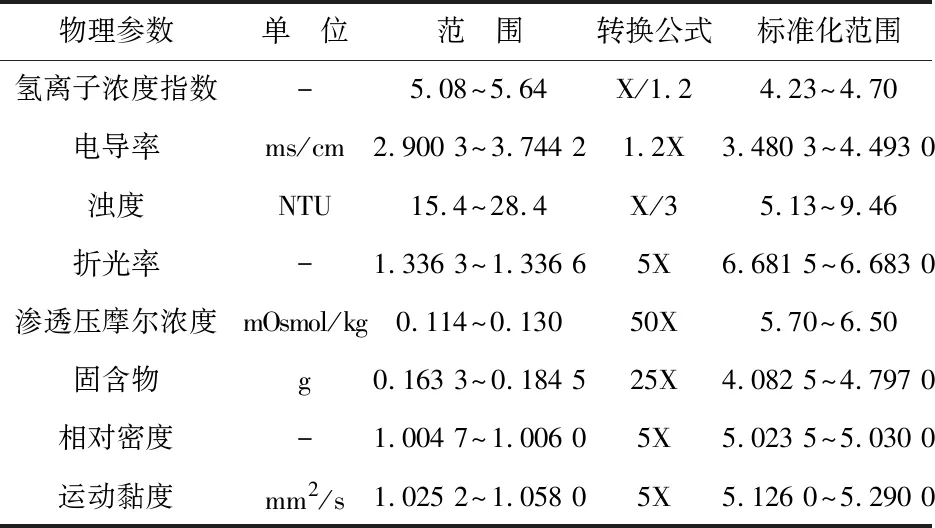
表3 参附注射液物理参数标准
2.3.3 参附注射液对照物理指纹图谱的构建.
8批效期内参附注射液,按照“2.3.1”项下确定的方法测定供试品各物理参数,并对其数值进行标准化,结果见表4,并以8批参附注射液各个标准化物理参数的平均值作雷达图,即得到对照物理指纹图谱,结果见图4.
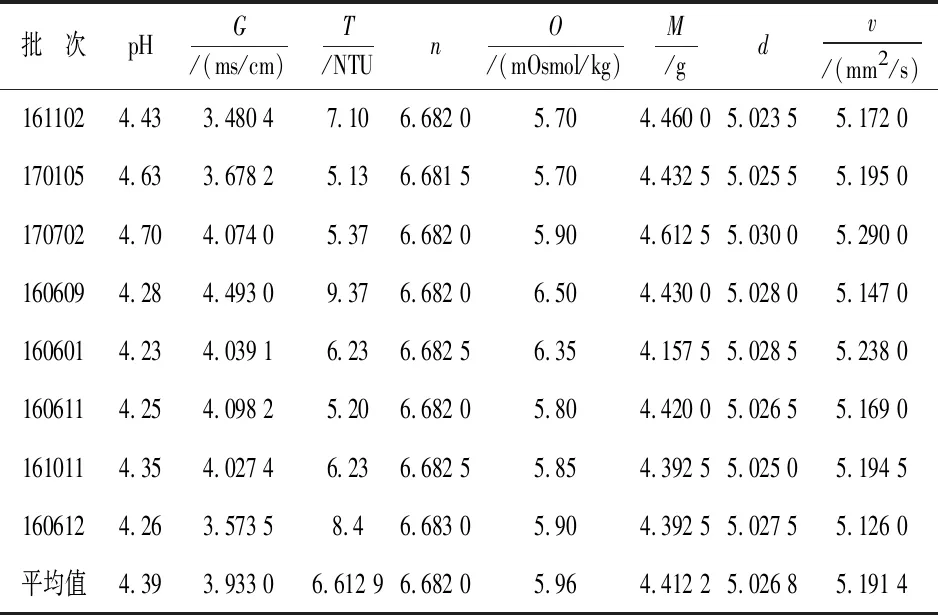
表4 参附注射液物理参数标准转换

图4参附注射液对照物理指纹图谱
2.3.4 物理参数限度要求.
8批效期内参附注射液的8 个物理参数值及标准化值的范围如表3所示.这8批效期内的参附注射液,按照“2.3.1”项所确定的方法测定供试品,所得物理指纹谱,可用于评价其他批次参附注射液的各个指标是否同时满足表4中的标准化范围.
2.3.5 验证实验.
按照“2.3.1"项所确定的方法测定3批效期外样品,所得物理指纹图谱8个参数值.结果表明,3批效期外参附注射液样品的物理指纹图谱8个物理参数值基本不在标准化值范围内,因此不符合标准.
3 讨 论
目前,参附注射液由雅安三九药业有限公司独家生产,因此不能比较不同厂家的质量差异,此外在建立其指纹图谱时,8批参附注射液中生产批次时间相近.其中,紫外—可见指纹图谱,其吸光度值可以规定其范围,红外指纹图谱中发现共有峰率最低可达54.83%,最高可达91.67%,变异峰率最高为52.94%,物理指纹图谱中标准范围较广.研究表明,参附注射液即使由同一个厂家生产且生产批次相近,也可能存在质量上的差异,其原因可能是参附注射液中的某一成分不稳定而造成的,具体成分还有待进一步验证.
在本研究的指纹图谱方法学建立采用的是8批效期内参附注射液,而批次数量也能从一定程度上反应样品的整体情况.3批效期外参附注射液的验证发现,紫外—可见指纹图谱吸光度值均不符合要求,红外指纹图谱中有1批样品的共有峰率与变异峰率超出其允许范围,物理指纹图谱中3批样品均不符合要求.由此可见,紫外—可见、红外、物理指纹图谱均能全面地反应过期与非过期样品的质量差异.
本研究将紫外—可见、红外、物理指纹图谱运用到参附注射液质量评价中,初步确定了其标准范围,以从整体上控制参附注射液质量,改变了以单一化学成分的定性及定量控制产品质量模式,提升了参附注射液的质量标准.研究结果也表明,紫外—可见、红外、物理指纹图谱法联用的方法对液体药物质量评价具有一定的研究意义.

