脑脊液肿瘤坏死因子-α和干扰素-γ对髓母细胞瘤患儿的预后评价分析
张 金 任思其 李舒婷 李 苗 龚小军 孙艳玲 武万水 孙黎明 杜淑旭
(首都医科大学附属北京世纪坛医院儿科,北京 100038)
髓母细胞瘤(medulloblastoma, MB) 是最常见的儿童中枢神经系统恶性肿瘤,约占儿童期颅内肿瘤的20%~25%[1]。近年来由于手术治疗、放射治疗、化学药物治疗等多学科联合治疗的开展,5年无病生存率已由20世纪70年代的20%提高到70%~80%[2-3]。但因其易沿脑脊液或脑膜播散,仍有约30%的患儿出现早期复发或播散转移,且复发患儿3年存活率不足20%[4],故复发播散者为难治性髓母细胞瘤。肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和干扰素-γ(interferon-γ, IFN-γ)是体内重要的细胞因子[5-6],在肿瘤的发生、发展中发挥着重要作用。本研究通过测定MB患儿脑脊液TNF-α和IFN-γ浓度,探讨TNF-α和IFN-γ对MB患儿预后的评估价值。
1 对象与方法
1.1 研究对象
将2016年11月至2018年6月期间确诊髓母细胞瘤且无合并感染、无免疫、无血液系统等疾病的患儿167例作为研究对象,所有患儿均于手术后接受放射治疗或化学药物治疗。其中男性113例,女性54例,中位年龄7.6(1.1~17.0)岁;经典型111例,促纤维增生/结节型37例,广泛结节型12例,间变型4例,大细胞型3例。根据Chang’s M分期分为3组,无播散组(M0期) 66例,播散组(M+期) 54例及复发组 47例。本研究获得首都医科大学附属北京世纪坛医院伦理委员会批准(2015伦理其他第12号),患儿法律监护人签署知情同意书。
1.2 治疗原则
1)无播散组:>3岁患儿,于术后3~4周行放射治疗,放射治疗结束6周行维持化学药物治疗;≤3岁患儿,于术后3~4周行3个周期诱导化学药物治疗,根据危险分层及基因特点决定是否行放射治疗。
2)播散组:患儿于术后3~4周行2个周期诱导化学药物治疗,之后行放射治疗,放射治疗结束6周行维持化学药物治疗。
3)复发组:根据个体化原则决定治疗方案,加强化学药物治疗方案或靶向治疗[7-8]。
1.3 检测分析
1.3.1 标本采集
所有患儿均于化学药物治疗前常规腰椎穿刺检查,留取脑脊液标本,其中无播散组有48例曾接受放射治疗。室温下1 000 g离心20 min,留取上清液,置于-20 ℃保存。
1.3.2 标本检测
采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测脑脊液TNF-α和IFN-γ浓度,试剂盒均购自兰博利德生物技术有限公司。所有操作均严格按照说明书进行。
1.4 统计学方法
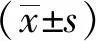
2 结果
2.1 各组间脑脊液TNF-α和IFN-γ的比较
无播散组脑脊液TNF-α和IFN-γ的浓度明显高于播散组和复发组,差异有统计学意义(P<0.05);播散组和复发组之间TNF-α浓度差异无统计学意义 (P>0.05),IFN-γ浓度差异有统计学意义 (P<0.05),其中播散组脑脊液IFN-γ浓度高于复发组,详见表1。同时,将无播散组根据是否接受放射治疗分为2组,2组间TNF-α和IFN-γ的浓度差异无统计学意义(P>0.05),详见表2。

表1 各组脑脊液TNF-α和IFN-γ的质量浓度Tab. 1 TNF-α and IFN-γ in CSF of the three groups [M(P25, P75),ng/L]


GroupNumber of caseTNF-αIFN-γRadiotherapy4823.47±7.40263.22±219.69Non-radiotherapy1819.67±9.90245.35±102.31t1.4790.331P0.1520.742
TNF-α:tumor necrosis factor-α;IFN-γ:interferon-γ.
2.2 TNF-α和IFN-γ对判断预后的ROC曲线分析
本研究将播散组和复发组合并为难治组,无播散组为非难治组。ROC曲线分析结果显示,TNF-α曲线下面积(AUC)大于IFN-γ,差异有统计学意义(P<0.05),以约登指数最大值所对应的样本值为截断值,TNF-α和IFN-γ截断值分别为12.73 ng/L和136.53 ng/L,此时TNF-α的敏感度和特异度均高于IFN-γ。详见表3和图1。

表3 肿瘤预后的评价指标Tab. 3 Indexes for evaluating prognosis of tumor

图1 评估肿瘤预后的ROC曲线Fig.1 ROC curves for evaluating prognosis of tumor
ROC:receiver operating characteristic;IFN-γ:interferon-γ;TNF-α:tumor necrosis factor-α.
3 讨论
TNF-α和IFN-γ是人体内重要的细胞因子。TNF-α能够诱导细胞凋亡、影响肿瘤血管系统和增强机体免疫力,具有抵抗和促进肿瘤生长的双重作用[9]。过量的TNF-α能够破坏机体对肿瘤免疫应答,促进肿瘤的生长和扩散,TNF-α在一定范围内升高往往与转移、复发、预后差和恶病质相关[10]。Jaime-Pérez 等[11]发现中枢神经系统白血病患者脑脊液中的TNF-α是明显升高的,且在诊断中枢神经系统复发前就已检测到TNF-α的升高。多项研究[12-13]表明,TNF-α与脑胶质瘤的发生、发展密切相关,病理分级越高,TNF-α的浓度越高。IFN-γ是最先被发现的细胞因子,具有免疫调节、诱导细胞凋亡、抑制癌基因表达等功能,文献[14]显示将INF-γ应用于多种肿瘤如乳腺癌、肝细胞癌、恶性淋巴瘤、宫颈癌等的治疗,可降低复发,提高患者生存率。
本研究显示无播散组脑脊液TNF-α和IFN-γ的浓度明显高于播散组和复发组,不同于中枢神经系统白血病和脑胶质瘤,在MB中肿瘤高负荷状态下TNF-α和IFN-γ浓度降低,与国外研究[15-16]中二者在MB患者外周血的结果一致。脑脊液TNF-α和IFN-γ浓度升高患儿预后较好,提示TNF-α和IFN-γ的表达在MB的发病过程中发挥抗肿瘤作用。而IFN-γ在播散组和复发组之间差异无统计学意义,考虑IFN-γ可能参与MB的播散复发。
本研究中根据治疗效果和预后分为难治组和非难治组,TNF-α和IFN-γ的ROC曲线下面积分别为0.958和0.809(均>0.7),提示TNF-α和IFN-γ浓度对判断MB的预后具有诊断价值,TNF-α和IFN-γ的最佳临界值分别为12.73 ng/L和136.53 ng/L,具有很高的敏感度、特异度及准确度且TNF-α优于IFN-γ。TNF-α>12.73 ng/L提示无肿瘤转移播散、预后较好。
TNF-α和IFN-γ参与肿瘤发病机制的研究较多,Wiegering等[15]对MB患者外周血T淋巴细胞的TH1细胞因子进行了检测,发现在自体干细胞移植后早期TNF-α和IFN-γ的升高提示较好的预后。Sandén等[16]发现MB患者在肿瘤切除术后,外周血TNF-α和IFN-γ浓度较术前升高,接近健康对照组浓度。TNF-α和IFN-γ浓度升高预后较好,考虑机制为肿瘤细胞可被由TNF-α、IFN-γ等TH1相关因子和局部促炎因子介导的免疫效应细胞清除。
本研究中部分患儿接受了放射治疗,研究显示放射治疗组患儿脑脊液中TNF-α和IFN-γ浓度高于未接受放射治疗组,但差异无统计学意义(P>0.05),考虑为放射治疗结束时间较长(6周),放射治疗对脑脊液内细胞因子的影响趋于恢复,或样本量偏少,不能反映总体水平,需进一步增加时间点或扩大样本量进行研究。
尽管近年来MB的治疗已经取得了很大进展,但部分患儿治疗效果仍不理想,高危组患儿长期生存率较低,复发组患儿存活率则更低[17-18]。目前临床工作中主要依据定期复查全脑全脊髓磁共振及腰椎穿刺明确脑脊液有无肿瘤细胞,来判断有无肿瘤播散及复发,但均较疾病本身的进展滞后。本研究发现TNF-α和IFN-γ可以作为MB判断预后的指标,采用合理的方法检测并调控其水平,有助于临床及早采取适当的治疗措施,提高治疗效果,降低复发风险。

