血管紧张素Ⅱ1型受体自身抗体阳性雌鼠孕后出现妊娠期高血压样症状
边经纬 尹晓辰 李 浩 张苏丽 王美丽 刘慧荣
(首都医科大学生理学与病理生理学系 代谢紊乱相关心血管疾病北京市重点实验室 代谢紊乱相关心血管疾病国际合作实验室,北京 100069)
妊娠期高血压疾病是妊娠与血压升高并存的一组疾病,该组疾病严重影响母婴健康,是孕产妇和围产儿病死率升高的主要原因。妊娠期高血压疾病包括妊娠期高血压、子痫前期、子痫、慢性高血压并发子痫前期和慢性高血压合并妊娠[1]。前3种疾病与后两种有些不同,主要表现为患者妊娠前血压正常,妊娠后出现血压升高的临床症状,前3种疾病的严重程度逐渐增加。但目前临床上除使用对症药物减轻症状外,终止妊娠仍旧是唯一有效的治疗手段[2]。因此疾病的预防和治疗显得尤为重要。
近年来的研究[3]显示,一种存在于子痫前期患者血清中的病理性自身抗体,即血管紧张素Ⅱ 1型受体(angiotensin Ⅱ type 1 receptor,AT1R)自身抗体(angiotensin Ⅱ type 1 receptor autoantibody,AT1-AA)可能是导致子痫前期发展的重要因素。临床调查[4]显示,AT1-AA与子痫前期具有高度的相关性,且疾病的严重程度随抗体效价的升高而逐渐升高。Zhou等[5]将AT1-AA注入妊娠小鼠体内后引发孕鼠出现血压升高,尿蛋白含量增加等症状,提示AT1-AA是妊娠期高血压疾病重要的发病原因。随后越来越多的临床研究显示,AT1-AA不仅存在于子痫前期患者体内,还广泛分布于妊娠期高血压,以及其他疾病如原发性醛固酮增多症,恶性高血压,肾移植排斥,以及系统性硬化症相关性肺动脉高压等疾病[4]。值得注意的是,本课题组在部分健康人血清中也检测到AT1-AA,但其潜在的病理意义不清。鉴于此,本研究目的在于探究AT1-AA阳性是否会增加妊娠后出现类似妊娠期高血压症状的风险,以及引发症状的可能原因。
1 对象与方法
1.1 临床样本的收集
本实验相关研究程序均经首都医科大学伦理委员会批准,符合人体标本收集标准。受试者均已签订知情同意书。收集健康未妊娠女性、正常孕妇和子痫患者的血清用于AT1-AA检测。子痫前期的诊断符合国际标准:正常妇女在妊娠20周后出现血压升高(收缩压>140 mmHg或舒张压>90 mmHg, 1 mmHg=0.133 kPa)的临床现象,并伴有以下一个或两个以上症状:①蛋白尿;②孕妇器官功能障碍; ③子宫胎盘功能障碍。分娩时的孕周37~40周,平均孕周为(38.6±1.7)周;正常孕妇为妊娠期间体检正常的孕妇,正常分娩,孕周37~40周,平均孕周为(39.3±1.2)周;健康非妊娠女性为健康体检志愿者。3组在年龄、体质量、身高等方面尽可能一致。所有参与者均排除心血管疾病、肿瘤、自身免疫病、内分泌疾病等合并症。依据以前研究[6]计算出最小样本量为33 (OR=16.04,α=0.05,β=0.1)或18(OR=7.74,α=0.05,β=0.1)。本研究共收集48例健康未妊娠女性、56例正常孕妇和82例子痫前期患者。受试者基本情况详见表1。
1.2 AT1-AA阳性大鼠模型构建
本实验的所有研究程序均经首都医科大学伦理委员会批准,符合“动物使用和护理指导原则”标准。合成纯度为98%的人源AT1受体细胞外第二环抗原表位肽段(I-H-R-N-V-F-F-I-E-N-T-N-I-T-V-C-A-F-H-Y-E-S-Q-N-S-T)。通过数字表法将14只正常的SD雌性大鼠随机分为溶剂对照组和主动免疫组。按照0.4 μg/g大鼠体质量的剂量和每只鼠注射0.5 mL总液体的标准计算出所用抗原溶液的体积,剩余液体用0.9%(质量分数)氯化钠注射液补齐。首次免疫时,使用等体积的弗氏完全佐剂混合包含抗原的水溶液,背部皮下梅花点注射。后续加强免疫时,用等体积的弗氏不完全佐剂混合抗原溶液,背部皮下注射,2周1次。每次免疫前采血,并将所采血样进行酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测。溶剂对照组以0.9%(质量分数)氯化钠注射液代替抗原溶液,免疫方法同实验组。免疫8周后AT1-AA稳定表达,届时将溶剂对照组和主动免疫组的雌性大鼠分别与正常雄性SD大鼠交配,以见雌鼠阴道栓为妊娠0.5 d。整个过程中通过尾套法(BP-98A,Softron公司,日本)测量大鼠收缩压。
1.3 酶联免疫吸附实验
将合成的AT1受体细胞外第二环抗原肽段(10 μg/mL)包被到96 孔板中,100 μL/孔,4 ℃过夜。第二天,使用含0.1%(体积分数)Tween-20的磷酸盐缓冲液(PBST,mmol/L: NaCl 137, KCl 2.7,Na2PO4·12H2O 10, KH2PO41.76;pH值为7.4)洗板3次。每孔加入400 μL由PBST配制的5%(质量分数)脱脂奶粉,37 ℃水浴中封闭1 h后,洗板3次。使用5%(质量分数)脱脂奶粉稀释待测血清样品(1∶10),100 μL/孔,37 ℃水浴1 h,洗板。加入5%(质量分数)脱脂奶粉稀释的辣根酶标记人或大鼠二抗(1∶500),100 μL/孔,37 ℃水浴1 h,洗板。以1.1 mg ABTS加入1 mL双蒸水的比例配制底物显色液,用前混合3%(体积分数)H2O2(0.5 mL/L),100 μL/孔,避光,37 ℃水浴30 min。用酶标仪在波长405 nm处读取样品A值。
在使用传统ELISA方法检测人血清中的AT1-AA时,有些样品即使未包被抗原也会呈现阳性显色,但在检测大鼠血清时却未发现此问题。因此,推测人血清中可能包含某些特殊物质与ELISA板结合。为排除此类因素造成的假阳性,实验室针对人来源样本的特殊性改进了ELISA方法,区别在于包被抗原的同时设置未包被抗原的空白孔(即只加抗原稀释缓冲液)。P/N 值计算AT1-AA阳性率:P/N=(样品A值-相应的未包被抗原孔A值)/(阴性对照A值-相应的未包被抗原孔A值)。样品P/N≥2.1 为阳性。
1.4 肠系膜动脉血管环
妊娠第18天,大鼠麻醉后腹主动脉插管收集血液。剪取肠系膜组织浸泡在冰冷的HEPES缓冲液(mmol/L:NaCl 144,KCl 5.8,CaCl22.5,MgCl21.2,HEPES 5,葡萄糖 11.0;pH值7.4)中。小心游离肠系膜三级分支血管,清除周围的脂肪和结缔组织,并将血管剪成2 mm长的环。血管环被固定在微血管环仪器(DMT 610 M, Danish Myo Technology, Denmark)中,浴槽提前备有HEPES缓冲液。实验全程保持浴槽中的缓冲液通有95%(体积分数)O2+ 5%(体积分数)CO2的混合气,温度恒定在37 ℃。血管在平衡1 h后加入60 mmol/L K+-HEPES缓冲液(mmol/L:NaCl 29.8,KCl 120.1,MgCl2·6H2O 1.2,CaCl22.5,葡萄糖 11.1,HEPES 5;pH值为7.4)。待血管收缩达到平台期后,重新更换为HEPES缓冲液。通过Power Lab系统记录血管张力。加入10-5mol/L的去甲肾上腺素(norepinephrine,NE)。根据血管收缩百分比(NE和60 mmol/L K+-HEPES缓冲液诱导收缩的比值×100%)评价血管对收缩物质的反应性。使用NE预收缩血管,加入作用于内皮M受体的乙酰胆碱(acetylcholine,ACh,10-9~10-5mol/L),根据血管舒张百分比评价血管内皮依赖性舒张功能;使用NE预收缩血管,加入直接引起一氧化氮(nitric oxide,NO)释放的NO底物硝普钠(sodium nitroprusside,SNP,10-9~10-5mol/L),根据血管舒张百分比评价非内皮依赖性舒张功能。
1.5 统计学方法
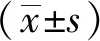
2 结果
2.1 健康未妊娠女性、正常孕妇和子痫前期患者中均存在AT1-AA阳性人群
共收集了48例健康未妊娠女性、56例正常孕妇和82例子痫前期患者的血清(表1)。使用ELISA方法检测血清中AT1-AA的浓度。子痫前期患者体内的AT1-AA含量显著高于正常孕妇和健康未妊娠女性(图1A)。69%的子痫前期患者体内AT1-AA呈阳性,其阳性率远高于正常孕妇(29.0%)。8.3%的健康未妊娠女性中也存在AT1-AA (图1B)。
2.2 AT1-AA阳性大鼠在妊娠12 d后血压显著升高
为模拟自身抗体在体产生的过程,通过主动免疫技术成功建立了AT1-AA阳性大鼠模型。结果显示其间存在分组效应(F=746.40,P=0.000)和时间效应(F=114.03,P=0.000),主动免疫大鼠血清中AT1-AA的A值自第2周(A值,0.3±0.0vs0.2±0.0,n=7,P<0.05,图2A)起逐渐升高,并于第8周达到峰值(A值,0.9±0.1vs0.2±0.1,n=7,P<0.01,图2A),并且在结束免疫后的妊娠期第18天,AT1-AA阳性孕鼠血清中的AT1-AA仍维持很高水平(A值,0.86±0.04vs0.21±0.03,n=7,P<0.01,图2B),佐剂对照组并未检测到AT1-AA。同时观察到大鼠收缩期的血压在免疫期间无明显变化(图2C)。大鼠妊娠阶段血压结果显示存在分组效应(F=79.23,P=0.000)和时间效应(F=21.45,P=0.000),与溶剂对照组相比,AT1-AA阳性孕鼠的血压自孕12 d起开始显著增加,于孕18 d达到峰值[(150±5)mmHgvs(118±7)mmHg,n=7,P<0.01,图2D]。


Clinical profilesHealthy non-pregnant women(n=48)Normal pregnancy (n=56)Preeclampsia(n=82)Age/a28.4±3.028.2±3.230.2±2.1 Gestational weeks039.3±1.2 (38-41)38.6±1.7 (37-40)Han ethnic background (yes/no)48/056/082/0Systolic blood pressure/mmHg△101.1±9.2121.4±12.2166.2±10.0∗Diastolic blood pressure/mmHg△70.3±7.371.6±8.196.2±8.0∗Proteinuria/(mg·d-1)1.5±3.63.6±4.8 398.0±5.6∗∗Family history of cardiovascular disease3 (6.3)3 (5.4)5 (6.1)Family history of hypertension3 (6.3)4 (7.1)7 (8.5)
△1 mmHg=0.133 kPa;*P<0.05,**P<0.01vsnormal pregnancy.

图1 部分健康未妊娠女性中有AT1-AA分布Fig.1 AT1-AA in healthy non-pregnant women
A:P/N value;B: positive rate.*P<0.05,**P<0.01vshealthy non-pregnant women;##P<0.01vsnormal pregnancy;H:healthy non-pregnant women;N:normal pregnancy;PE:preeclampsia.

图2 AT1-AA阳性大鼠怀孕后12天出现血压升高Fig.2 Systolic BP of AT1-AA-positive rats elevated after gestation day 12
A:Active immune model of AT1-AA-positive rats was successfully established;B: High level of AT1-AA was detected on AT1-AA-positive rats on gestation day 18;C: There was no significant difference of systolic BP between vehicle and immunized group before pregnancy;D: Systolic BP of AT1-AA-positive rats were increased after gestation day 12;BP: blood pressure.n=7,*P<0.05,**P<0.01vsvehicle group; △1 mmHg=0.133 kPa.
2.3 AT1-AA阳性孕鼠血管的收缩舒张功能异常
血压升高与阻力血管病变密切相关,为探究AT1-AA阳性孕鼠血压升高的具体原因,从血管的收缩和舒张两方面评价了孕鼠血管功能。血管收缩功能的结果显示,与对照组相比,AT1-AA阳性孕鼠对NE的血管收缩反应增强(NE/K+:130%±10%vs110±5%,n=7,P<0.05,图3A~3C)。血管舒张功能的结果显示其间存在组间效应(内皮依赖性:F=1536.20,P=0.000;非内皮依赖性:F=762.12,P=0.000)和浓度效应(内皮依赖性:F=885.32,P=0.000;非内皮依赖性:F=1138.71,P=0.000)且由ACh(图3D、E)和SNP(图3G、H)引起的血管舒张程度较溶剂对照组均显著降低(ACh:60%±7%vs90%±4%,n=7,P<0.05,图3F;SNP:75%±3%vs95%±1%,n=7,P<0.05,图3I)。

图3 AT1-AA阳性孕鼠阻力血管功能Fig.3 AT1-AA-positive rats exhibited resistance vascular dysfunction after pregnancy
A: Representative graph showed vasoconstriction of vehicle group after pregnancy upon NE stimulation;B: Representative graph showed vasoconstriction of AT1-AA-positive IgG after pregnancy upon NE stimulation;C: Column chart summarized the data of 7 independent experiments;D: Representative graph showed vasodilation of vehicle group after pregnancy upon ACh stimulation;E: Representative graph showed vasodilation of AT1-AA-positive IgG after pregnancy upon ACh stimulation;F: Statistics represented 7 independent experiments of vasodilation upon ACh stimulation;G: Representative graph showed vasodilation of vehicle group after pregnancy upon SNP stimulation;H: Representative graph showed vasodilation of AT1-AA-positive IgG after pregnancy upon SNP stimulation;I: Statistics represented 7 independent experiments of vasodilation upon SNP stimulation.*P<0.05vsvehicle group.NE: norepinephrine;ACh: acetylcholine;SNP: sodium nitroprusside. The arrows represented the addition of different stimulations.
3 讨论
肾素-血管紧张素系统(renin-angiotensin system,RAS)在调节妊娠过程的血压,血容量和离子平衡中起重要作用。正常女性在妊娠状态下表现出RAS的激活,但其血管对于RAS中核心作用分子血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)引起的血管收缩反应却有所降低。与之不同的是,虽然部分子痫前期患者血清中血管紧张素原,肾素活性以及Ang Ⅱ的表达降低,但其血管对于Ang Ⅱ刺激所引起的收缩反应却显著增强。提示子痫前期患者体内可能存在某种物质增强了Ang Ⅱ的敏感性[7]。Cunningham等[8]发现,AT1-AA可以增强肾动脉对Ang Ⅱ的敏感性。本研究通过微血管环实验发现,AT1-AA阳性孕鼠的血管对其他缩血管物质,如NE的敏感性同样升高。提示AT1-AA对Ang Ⅱ的增敏效果可能并非特异。
AT1-AA最早在1999年由Wallukat等[3]从子痫前期孕妇的血清中分离提纯,可特异性地识别位于AT1受体胞外第二环,发挥类Ang Ⅱ的受体激动样作用。且与Ang Ⅱ不同,AT1-AA可更持久的收缩离体血管,增加胞内钙离子浓度,提示AT1-AA较Ang Ⅱ激活AT1R时间更长[9]。本课题组前期研究发现AT1-AA可致胸主动脉,肠系膜动脉,胎盘血管等全身动脉血管收缩[9-10]。在本研究中,AT1-AA阳性大鼠在主动免疫阶段的血压与溶剂对照组相比并无明显升高。Wang等[11]将对AT1-AA主动免疫大鼠血压的观察延长至12个月,同样未发现血压的明显变化。提示单纯的血管持续收缩并非是AT1-AA导致血压升高的主要原因。而在妊娠状态下,孕妇血容量可比非妊娠时增加35%。此外,由AT1-AA刺激所致的sFlt1、sEng表达增加[12], NO生物利用度降低,胎盘缺血、缺氧时激活的免疫和炎性反应[13-14],以及本研究中AT1-AA阳性孕鼠阻力血管内皮依赖和非依赖的舒张功能受损均可能引起孕妇出现高血压症状。
综上所述,本研究发现AT1-AA阳性的雌性大鼠受孕后血压较对照组显著升高,主要原因之一是血管对收缩物质反应性增强,血管内皮依赖和非内皮依赖舒张功能损伤。本研究的创新性在于通过主动免疫技术构建AT1-AA阳性雌鼠,模拟临床上AT1-AA阳性的女性。AT1-AA阳性雌鼠妊娠后出现血压升高,血管损伤的现象,提示AT1-AA阳性的女性在妊娠后存在血压异常升高的风险,应注意提前采取有效的预防措施。

