基于电子鼻和GC-MS联用技术对不同原料酿造黄酒风味品质的比较研究
葛东颖,龙旭霞,杨成聪,赵慧君,张振东,郭壮
(湖北文理学院食品科学技术学院鄂西北传统发酵食品研究所,湖北襄阳441053)
黄酒是以稻米和黍米为主要原料,经加曲、酵母等糖化发酵剂酿制而成的发酵酒,具有口感清爽、营养丰富和香气浓郁的优点[1]。作为传统发酵食品,黄酒的制作工艺较为简单,且制作环境较为粗放,酿造原料[2]、发酵菌种[3]、发酵[4]和陈酿[5]工艺都会对其品质产生较大的影响。虽然近年来有研究人员探讨了玉米淀粉[6]、麦芽糖浆[7]、金柑[8]和薏米葛根[9]酿造黄酒的可行性,但糯米和大米仍是黄酒生产的主要原料。本研究团队采用电子舌技术对以大米、籼糯米和粳糯米为原料酿造干黄酒(含糖量<15.0 g/L)的滋味品质进行了评价,结果发现以籼糯米和粳糯米为原料酿造的黄酒其滋味品质要优于大米[10]。除滋味品质外,风味品质亦是黄酒品质的重要组成部分,然而目前关于不同原料酿造黄酒风味品质影响的评价尚少。
目前研究人员常采用电子鼻和气相色谱-质谱联用仪 (gas chromatography-mass spectrometer,GC-MS)联用技术对食品的风味品质进行评价[11]。GC-MS 技术可以快速检测和识别食品或农产品中的挥发性风味物质[12],具有迅速、准确和重复性高等优点,在产品品质判别[13]、成分分析[14]、风味图谱构建[15]和农残检测[16]中具有广泛的应用。而电子鼻技术可以迅速对食品中特定的敏感物质类型进行定性评价,具有重复性和可靠性高且不受主观因素影响等优点[17],已经在黄酒酒龄鉴定[18]、食品品质检测[19]、黄曲霉毒素B1 评价模型构建[20]和水果成熟度识别[21]方面得到了应用。
本研究采用电子鼻和GC-MS 联用技术对籼糯米、大米和粳糯米酿造黄酒风味品质进行了评价,探讨了原料种类对黄酒风味品质的影响,以期为后续黄酒品质的提升提供一定参考。
1 材料与方法
1.1 材料与仪器
大米、粳糯米、籼糯米和麦曲:市售;氯化钠(分析纯):国药集团化学试剂有限公司;黄酒专用酿酒活性干酵母:安琪酵母股份有限公司。
GCMS-QP2020 气相色谱质谱联用仪:日本岛津公司;PEN3 电子鼻:德国Airsense 公司;3-18k 离心机:德国SIGMA 实验室离心机股份有限公司;CET-Z7F1G5蒸饭柜:永康市搜玛特贸易有限公司;SPX-100B-Z 生化培养箱:上海博讯实业有限公司医疗设备厂;HH-2数显恒温水浴锅:邦西仪器科技(上海)有限公司。
1.2 试验方法
1.2.1 大米、粳糯米和籼糯米样品采集
5 个籼糯米样品分别采集自湖北省襄阳市和孝感市、江苏省泰州市、黑龙江省牡丹江市和福建龙岩市;5个大米样品分别采集自湖北省襄阳市、江苏省泰州市、宁夏回族自治区吴忠市、黑龙江省五常市和辽宁省盘锦市;5 个粳糯米样品分别采集自四川省成都市、江苏省泰州市、广州壮族自治区桂林市、黑龙江五常市和福建省龙岩市。
1.2.2 黄酒制作
取籼糯米、大米或粳糯米300 g 加入700 mL 蒸馏水,于20 ℃浸渍12 d 后蒸煮30 min 备用。采用摊饭法冷却至室温,加0.3 g 酒母、47 g 麦曲、235 mL 清水和175 mL 浆水搅拌均匀,于28 ℃发酵7 d,18 ℃发酵14 d 后离心取上清液备用[22]。
1.2.3 基于电子鼻技术对黄酒风味的评价
准确吸取20 mL 黄酒样品于120 mL 样品瓶中,45 ℃保温15 min 后插入电子鼻探头吸取顶端空气测定敏感物质类型。电子鼻参数设置:样品间隔时间1 min,自动清洗时间95 s,归零时间5 s,插入时间5 s,测定时间90 s,吸气流量180 mL/min,进样流量180 mL/min。金属传感器在60 s 后基本稳定,选定65、66 s 和67 s时响应值,并计算其平均值,重复操作5 次。
1.2.4 基于GC-MS 技术对黄酒中挥发性风味物质分析
顶空进样处理:准确吸取8 mL 黄酒样品于25 mL样品瓶中,加入2 g 氯化钠,振荡至完全溶解,55 ℃预热30 min,平衡2 min,进样1 μL,进样口解析3 min 后进入GC-MS 分析。GC 条件:色谱柱为SH-Rtx-Wax极性毛细管柱(30 m×2.25 mm×0.25 μm);升温程序:起始温度30 ℃,保持4 min,以3 ℃/min 升到45 ℃,保持10 min,然后以10 ℃/min 升到130 ℃,不保持,然后以15 ℃/min 升到200 ℃保持7 min;传输线温度150 ℃;进样口温度200 ℃;进样方式:分流进样;分流比为8∶1;载气流量:1.0 mL/min;载气为高纯He(>99.999 9%)和高纯N2(>99.999 9%)。MS 条件:EI 离子源;离子源温度230 ℃;连接口温度260 ℃;电子轰击能量:70 eV;检测器电压相对于调谐结果0.1 kV;质量扫描范围范围33.00 amu~450 amu;采集方式:Q3 Scan;采用保留指数和NIST14 标准质谱库定性,并采用峰面积归一化对样品中挥发性风味物质相对含量进行分析。每个样品平行测试3 次。
1.2.5 统计学分析
用主成分分析法(principal component analysis,PCA)、典范对应分析法(canonical correlation analyses,CCA)、聚类分析(cluster analysis,CA)和多变量方差分析法(multivariate analysis of variance,MANOVA)对不同原料酿造黄酒的整体性风味品质进行评价,采用Kruskal-Wallis 检验对造成不同原料酿造黄酒风味品质差异的关键挥发性风味物质进行甄别。除PCA 采用past 3 软件外,其他分析均采用MATLAB 2017b 软件。采用MATLAB 2017b 绘制热图,其他图均采用origin 8.5 绘制。
2 结果与分析
2.1 基于电子鼻技术评价黄酒风味
GB/T13662-2008《黄酒》中约束优级黄酒的香气应具有黄酒特有的浓郁醇香,且无异香,因此本研究首先采用电子鼻技术对不同原料酿造黄酒的风味进行了评价。由PCA 可知,第一主成分(PC1)主要是由W1S、W5S 和W6S 3 个金属传感器构成,其占所有变量权重的97.44%,而第二主成分(PC2)主要是由W2W、W1W、W3S、W1C、W5C、W3C 和W2S 7 个金属传感器构成并占所有权重的2.36%。不同原料酿造黄酒整体风味品质的PC1 与PC2 因子得分图如图1所示。

图1 不同原料酿造黄酒风味品质的主成分分析Fig.1 Evaluation of the flavor profile characterization of yellow rice wine fermented by different raw materials based on principal component analysis
由图1可知,以籼糯米为原料酿造的黄酒样品全部分布在第二象限;以大米和粳糯米为原料酿造的黄酒样品分布在第三象限和第四象限。由此可见,尽管不同原料酿造的黄酒样品在空间排布上出现了部分重合,但亦表现出一定的分离趋势,这说明不同原料酿造的黄酒其风味品质可能存在一定差异。本研究采用CCA 这一有监督的多元统计学方法对不同原料酿造黄酒的风味进行了进一步分析,其结果如图2所示。
由图2可知,不同原料酿造的黄酒样品在空间排布上显现出明显分离趋势,这说明不同原料酿造的黄酒在风味品质上存在较大差异,也进一步验证了PCA结果的正确性。本研究进一步使用CA 对不同原料酿造黄酒风味品质的相似度进行了分析,结果如图3所示。

图2 不同原料酿造黄酒风味品质的典范对应分析Fig.2 Evaluation of the flavor profile characterization of yellow rice wine fermented by different raw materials based on canonical correlation analyses

图3 不同原料酿造黄酒风味品质的聚类分析Fig.3 Evaluation of the flavor profile characterization of yellow rice wine fermented by different raw materials based on cluster analysis
由图3可知,以大米和粳糯米为原料酿造的黄酒风味品质较为相似,但是两者与以籼糯米为原料酿造的黄酒风味品质存在较大差异。采用MANOVA 对不同原料酿造黄酒的风味品质进行分析发现,以大米和粳糯米为原料酿造的黄酒差异不显著(P>0.05),但两者均与以籼糯米为原料酿造的黄酒存在极显著差异(P<0.001)。基于电子鼻技术不同原料酿造黄酒敏感类型物质差异性分析如表1所示。
由表1可知,通过Kruskal-Wallis 检验发现,传感器W5S、W6S、W1S、W1W、W2S、W2W 和W3S 对籼糯米酿造黄酒中挥发性风味物质响应值显著偏高(P<0.05),传感器W1C 和W3C 对粳糯米酿造黄酒中挥发性风味物质响应值显著偏高(P<0.05),而传感器W5C对不同原料酿造黄酒响应值差异均不显著(P>0.05)。因传感器W5S、W6S、W1S、W1W、W2S、W2W 和W3S分别对黄酒样品中的氢氧化物、氢气、甲烷、有机硫化物和萜类物质、乙醇、有机硫化物和烷烃类物质灵敏,而传感器W1C 和W3C 均对黄酒中芳香类物质灵敏[23],由此可见,以粳糯米为原料酿造的黄酒其风味要显著优于籼糯米和大米。

表1 基于电子鼻技术不同原料酿造黄酒挥发性物质差异性分析Table 1 The significance analysis of volatile components in yellow rice wine fermented by different raw materials based on electronic nose
2.2 基于GC-MS技术分析黄酒中挥发性风味物质
本研究使用GC-MS 技术对不同原料酿造黄酒中挥发性风味物质进行了定性和相对定量研究,15 个黄酒样品中共检测出34 种挥发性风味物质,其中醇类、酯类、酸类、酮类和其他类化合物分别为11 种、15 种、6 种、2 种和3 种。不同原料酿造黄酒挥发性风味物质种类及相对含量如表2所示。
由表2可知,籼糯米、大米和粳糯米酿造黄酒中醇类化合物平均相对含量分别为71.83 %、66.65 %和65.78%,酯类化合物平均相对含量分别为27.09%、31.54%和32.27%。由此可知,醇类化合物和酯类化合物为黄酒中主要挥发性物质。王旭等[24]研究结果与本研究相同,其采用GC-MS 和电子鼻联用技术对不同酒龄黄酒中挥发性风味物质进行了辨别,指出醇类化合物和酯类化合物是黄酒中主要挥发性风味物质。此外,王培璇等[25]和牟穰等[26]的研究也表明醇类和酯类化合物在黄酒挥发性风味物质中占据较大比例。不同原料酿造黄酒中平均相对含量大于0.1%的挥发性风味物质相对强度热图如图4所示。
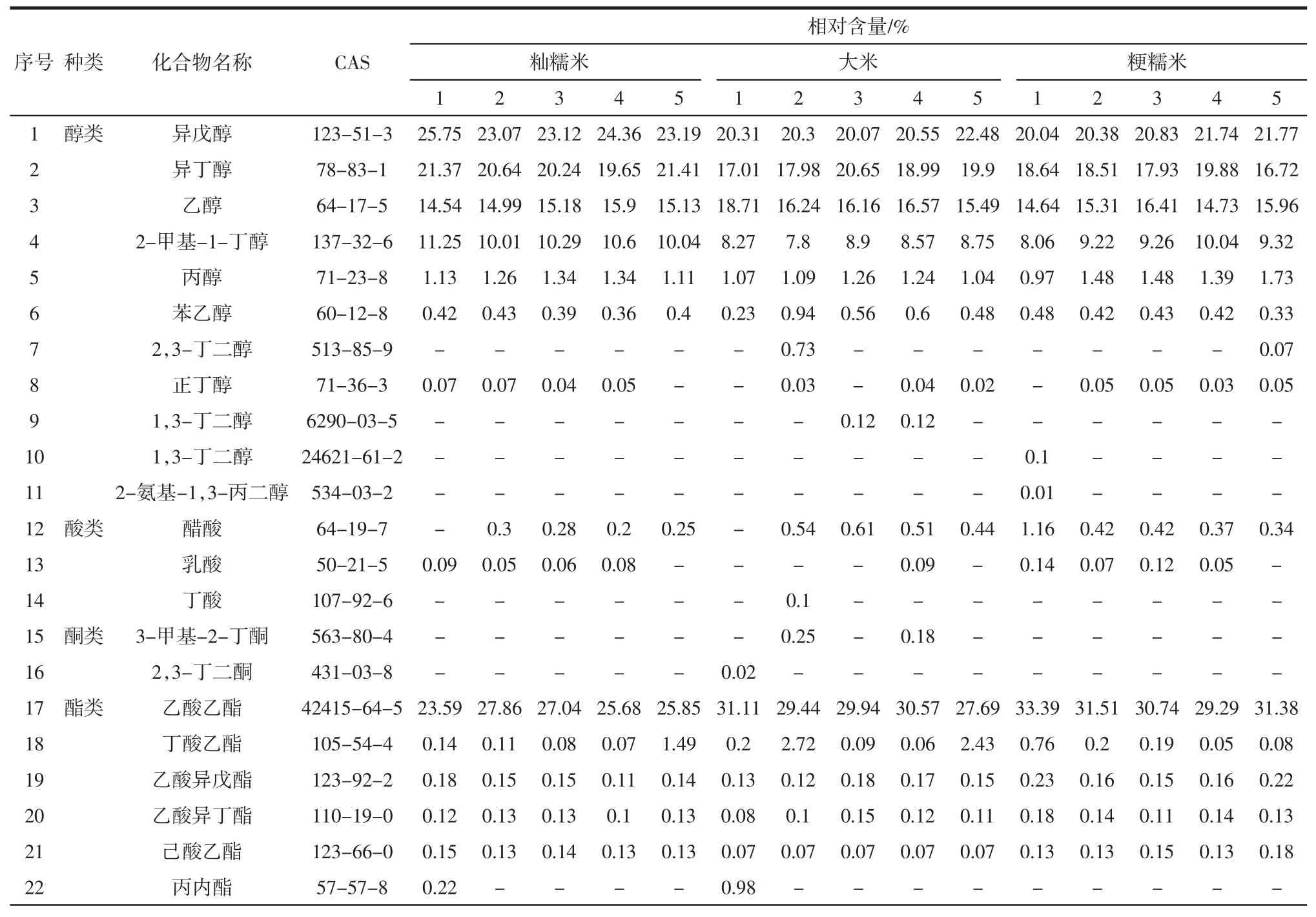
表2 不同原料酿造黄酒挥发性风味物质的相对含量Table 2 The relative abundance of volatile components in yellow rice wine fermented by different raw materials

续表2 不同原料酿造黄酒挥发性风味物质的相对含量Continue table 2 The relative abundance of volatile components in yellow rice wine fermented by different raw materials

图4 不同原料酿造黄酒平均相对含量大于0.1%挥发性风味物质的热图Fig.4 Heat map of volatile components in yellow rice wine fermented by different raw materials with the relative abundance more than 0.1%
由图4可知,相对含量高于0.1%的挥发性风味物质共计13 种,不同原料酿造黄酒中乙酸乙酯、异戊醇、异丁醇、乙醇、2-甲基-1-丁醇、2,4,5-三甲基-1,3-二氧戊环烷、醋酸和己酸乙酯等8 种挥发性风味物质均存在显著差异(P<0.05)。粳糯米酿造黄酒中的乙酸乙酯、醋酸和己酸乙酯均显著偏高(P<0.05),而籼糯米酿造黄酒中的异戊醇、异丁醇、乙醇和2-甲基-1-丁醇相对含量显著偏高(P<0.05)。酯类化合物作为黄酒发酵和陈酿过程中的重要产物,其感官阈值相对较低对黄酒的风味品质形成具有重要的影响[27],其中乙酸乙酯具有芳香和特定的水果香气,而己酸乙酯则具有曲香和菠萝香型香气,可显著提升黄酒风味品质。高级醇是黄酒发酵过程中不可避免的副产物,虽然感官阈值相对较高对黄酒风味形成的贡献较小[28],但是如果黄酒中异戊醇、异丁醇和2-甲基-1-丁醇相对含量过高,饮用后易上头、易醉和“后反功”,且对人体健康有一定的危害[29-30]。由此可见,黄酒的风味品质以粳糯米为原料酿造的最佳,这与电子鼻分析结果一致。
3 结论
在使用籼糯米、大米和粳糯米为原料进行黄酒酿造的基础上,采用电子鼻和GC-MS 技术对不同原料酿造黄酒的风味进行了评价,经电子鼻技术评价发现以粳糯米为原料酿造的黄酒其芳香类挥发性风味物质强度显著偏高,经GC-MS 技术检测发现以粳糯米为原料酿造的黄酒乙酸乙酯和己酸乙酯显著偏高,而异戊醇、异丁醇和2-甲基-1-丁醇相对含量显著偏低。由此可见,以粳糯米为原料酿造的黄酒其风味要显著优于籼糯米和大米。

