小儿紫癜疹消颗粒对过敏性紫癜患儿血清IgA1诱导人脐静脉内皮细胞炎症的抑制机制研究
朱浩宇, 段晓征, 冯晓纯
过敏性紫癜(Henoch-Schönlein purpura,HSP)是儿童时期最常见的一种系统性血管炎疾病。发病机制以IgA介导的体液免疫异常为主,病理变化表现为广泛的白细胞碎裂性小血管炎,在荧光显微镜下皮肤、胃肠道、肾脏等组织病理可见IgA为主的免疫复合物沉积,因此本病也被称为IgA血管炎[1]。这是由于HSP患儿血清IgA1分子结构糖基化异常,使其自身聚集或与IgG等结合形成大分子免疫复合物而发生清除障碍,沉积于各组织器官引起自身炎症反应和组织损伤[2-3]。新近研究发现,HSP急性期患儿的血清可刺激人脐静脉内皮细胞(human umbilical venous endothelial cells,HUVECs)合成分泌肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白细胞介素-8(interleukin-8,IL-8)等,同时核因子κB(nuclear factor-κB,NF-κB)的表达增加,参与HSP的发病过程[4]。小儿紫癜疹消颗粒为冯晓纯教授治疗HSP经验方剂,临床研究证实其疗效显著,复发率低,且无不良反应[5]。本研究以HUVECs为研究对象,给予HSP患儿血清IgA1刺激HUVECs发生炎症反应,同时加入不同浓度的小儿紫癜疹消颗粒进行干预,观察小儿紫癜疹消颗粒对HSP患儿血清IgA1诱导HUVECs炎症反应的抑制作用及其机制。
1 材料与方法
1.1 临床资料 选择2017年1月至12月长春中医药大学附属医院收治的HSP患儿30例为观察组,其中男14例,女16例;年龄5~12岁,平均年龄(7.27±3.68)岁。同期选取门诊健康体检儿童30例为对照组,其中男15例,女15例;年龄5~12岁,平均年龄(7.53±3.14)岁。两组研究对象在年龄、性别方面比较差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准 参照2006年EULAR/PReS制定的HSP诊断标准[6]。
1.3 纳入标准 (1)符合HSP的诊断标准;(2)年龄5~12岁;(3)患儿为初次发病;(4)患儿家属知情同意,本研究经本院伦理委员会审核通过。
1.4 排除标准 (1)已给予药物治疗者;(2)合并其他疾病者。
1.5 细胞、主要试剂和仪器 HUVECs购自上海细胞库;小儿紫癜疹消颗粒(主要成分:紫草、生地、牡丹皮、白薇、白鲜皮、黄芩、侧柏叶、茜草、鸡血藤)由长春中医药大学制剂中心提供;IL-8和TNF-α(美国Santa CRUZ公司);NF-κB(英国Abcam公司)。
1.6 血清IgA1的分离提取 所有儿童于清晨空腹采外周静脉非抗凝全血5 mL,室温下放置2 h后,离心机4 000 r/min离心15 min(离心半径10 cm),提取上清放于-80 ℃低温冰箱中保存。将血清样品用去离子水按照体积比为1∶1稀释后,加入固体硫酸铵使其饱和度为50%,12 000 r/min,4 ℃离心10 min(离心半径10 cm),留沉淀用磷酸盐缓冲液溶解后,透析至磷酸盐缓冲液中;用磷酸盐缓冲液平衡凝集素柱子,平衡5个柱体积;上样,以0.5 mL/min的流速过凝集素柱子;洗杂,用磷酸盐缓冲液洗脱除去未结合的蛋白;洗脱,用0.8 mol/L凝集素的磷酸盐缓冲液洗脱,根据HD-2004型紫外检测仪读数收集目的蛋白。洗脱的目的蛋白透析至磷酸盐缓冲液中;将透析好的样品以0.5 mL/min的流速过pro A柱子;用pH=3.0的50 mmol/L甘氨酸-HCl缓冲液洗脱,收集目的蛋白;取透析好的样品20 μL,加20 μL的2倍浓缩的上样缓冲液,沸水煮4 min,上样检测。
1.7 HUVECs传代培养 HUVECs用含10%胎牛血清的1%青-链霉素的RPMI-1640培养基,放入37 ℃、5%CO2温箱中培养。待细胞长至90%时,用磷酸盐缓冲液冲洗细胞2次,加入含0.02%乙二胺四乙酸的0.25%胰酶消化液,37 ℃消化1~2 min,倒置显微镜下观察细胞变圆、细胞间隙变大即加入含胎牛血清的RPMI-1640培养液终止反应。用移液管吹打瓶壁使细胞完全脱落,将细胞悬浊液置于无菌离心管中,1 000 r/min离心4 min(离心半径10 cm),弃上清,加入完全培养液将沉淀悬浮,以1∶3接种于新培养瓶中。待细胞长至致密单层时可再次传代。
1.8 实验分组 将细胞依培养条件不同随机分为6组(每组10孔):(1)空白对照组:用不含血清的培养液培养;(2)HSP组:用含HSP患儿200 mg/L血清IgA1培养液培养;(3)低、中、高浓度中药组:HUVECs于含HSP患儿200 mg/L血清IgA1培养液培养,同时分别加入浓度为25、50、100 mg/L的小儿紫癜疹消颗粒;(4)对照组:用含正常儿童200 mg/L血清IgA1培养液培养。
1.9 酶联免疫吸附实验检测IL-8、TNF-α水平 建立检测标准曲线;标本用标本稀释液1∶1稀释,加入稀释后的标本50 μL于反应孔、加入待测样品50 μL于反应孔内。再加入50 μL的生物素标记的抗体。盖上膜板,混匀,37 ℃温育60 min;用洗涤液将反应板充分洗涤5次,向滤纸上印干;每孔加入80 μL的亲和链酶素-辣根过氧化物酶,混匀,37 ℃温育30 min;再次用洗涤液充分洗涤5次;每孔加入底物A、B各50 μL,混匀,将反应板置37 ℃暗处反应10 min;每孔加入50 μL终止液混匀,在450 nm波长处测定各孔的吸光值,计算标本IL-8、TNF-α定含量。
1.10 Western blot检测HUVECs中NF-κB蛋白表达 收集各组细胞,预冷磷酸盐缓冲液洗涤细胞,加入细胞裂解液低温裂解。12 000 r/min离心5 min(离心半径10 cm),取上清,检测各样品蛋白浓度。SDS-PAGE电泳分离样品,转膜封闭,加入NF-κB抗体4 ℃孵育过夜。次日,加入辣根过氧化物酶标记的二抗(GAPDH,稀释比例为1∶2 000),室温封闭1 h。在膜表面均匀滴加化学发光液,避光反应1~2 min。用Scion Image图像分析系统对蛋白条带进行分析,蛋白质的相对含量以目的蛋白与GAPDH条带平均灰度值的比值表示,按计量资料进行统计分析。
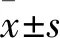
2 结果
2.1 小儿紫癜疹消颗粒对各组HUVEC分泌IL-8、TNF-α水平的影响 见表1。

表1 小儿紫癜疹消颗粒对各组HUVECs分泌TNF-α及IL-8水平的影响
注:与空白对照组比较,aP<0.05;与HSP组比较,bP<0.05。
表1结果表明,与空白对照组和正常对照组比较,HSP组TNF-α、IL-8水平升高,差异有统计学意义(P<0.001);与HSP组比较,低、中、高浓度中药组TNF-α、IL-8水平明显降低,差异有统计学意义(P<0.05)。随着小儿紫癜疹消颗粒浓度增大,TNF-α、IL-8水平逐渐下降。
2.2 小儿紫癜疹消颗粒对各组HUVECs的NF-κB(P65)蛋白表达的影响 见表2。
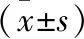
表2 小儿紫癜疹消颗粒对各组HUVECs的NF-κB(P65)蛋白表达的影响
注:与空白对照组比较,aP<0.05;与HSP组比较,bP<0.05。
表2结果表明,与空白对照组和正常对照组比较,HSP组P65蛋白显著升高,差异有统计学意义(P<0.05);与HSP组比较,高浓度中药组P65蛋白水平明显降低,差异有统计学意义(P<0.05)。
Western blot检测各组HUVECs的NF-κB(P65)蛋白电泳图见图1。

图1 Western blot检测各组HUVECs的NF-κB(P65)蛋白电泳图
3 讨论
HSP作为儿童期常见的一种自身免疫性疾病,至今仍无理想的治疗方法。HSP发生小血管炎症病变,血管内皮细胞首先受到损害。故选择性保护血管内皮细胞、调节血管内皮细胞的炎症反应以及血管内皮细胞的靶向治疗已经成为目前研究的热点。人脐静脉血管内皮细胞方便取材,充足的来源,是构建血管内皮细胞模型的常用材料。本研究通过观察小儿紫癜疹消颗粒对HSP患儿血清IgA1诱导体外培养的HUVEC炎症反应的影响,为中药治疗小儿HSP提供实验依据。
IL-8是趋化性细胞因子家族成员,是炎症性疾病的重要介质,具有抗感染、抗肿瘤以及免疫调节等重要功能。无论是特异性还是非特异性的免疫细胞,IL-8具有强烈的趋化作用,其与嗜中性粒细胞上的IL-8受体结合后,导致嗜中性粒细胞的迁移和活化,从而导致血管炎症的发生[15-17]。Yang等[18]通过临床研究发现,HSP急性期患儿血清中IL-8水平升高,并多由内皮细胞产生。本研究显示,与HSP组相比,低、中、高浓度中药组IL-8水平明显降低。随着小儿紫癜疹消颗粒浓度增大,IL-8水平逐渐下降。从实验中推测小儿紫癜疹消颗粒在人体内通过降低血管内皮细胞分泌IL-8,使中性粒细胞在炎症灶内浸润减少,抑制其释放蛋白水解酶和产生氧自由基,减轻局部炎症。
TNF-α作为一种强有力的促炎性细胞因子,能够介导多种炎症反应,能诱导多种信号通路,从而引起细胞炎症和凋亡[19-20]。TNF-α是由单核-巨噬细胞、内皮细胞等产生,可以增强中性粒细胞的吞噬和黏附作用,又可诱导血管内皮细胞表达白细胞间黏附分子,促进白细胞黏附于血管内皮,从而直接和间接导致血管内皮细胞的损伤。陈铁龙等[21]研究发现TNF-α能显著增加HUVECs的凋亡和炎症因子表达,其损伤机制可能是通过激活NF-κB、AP-1途径,并抑制eNOS的释放有关。华冉等[22]研究发现HSP患儿急性期、恢复期的NF-κB都与TNF-α呈正相关,证明TNF-α可激活NF-κB,而NF-κB活化后又进一步促进TNF-α分泌,TNF-α对NF-κB活化具有正反馈作用。本研究显示,与HSP组相比,低、中、高浓度中药组TNF-α水平明显降低。随着小儿紫癜疹消颗粒浓度增大,TNF-α水平逐渐下降。从本实验结果推测小儿紫癜疹消颗粒在人体内通过降低血管内皮细胞分泌TNF-α,从而减轻血管炎症反应。
NF-κB为参与机体炎症反应的关键转录因子,调控机体多种黏附分子、细胞因子等表达[23-24]。生理状态下NF-κB的p65亚基与其抑制蛋白IκB结合,于细胞质中以无活性状态存在。在多种因素作用下激活IκB蛋白激酶,导致IκB发生磷酸化并迅速降解,从而与NF-κB发生解离,暴露出p65亚基的核定位信号区域,导致NF-κB活化并转位入核,启动核内炎症细胞因子基因的表达。活化后的NF-κB能增强TNF-α、IL-8的转录表达,同时这些因子增多后又可以活化NF-κB,进一步加重细胞损伤。本研究显示,与HSP组相比,高浓度中药组P65蛋白水平明显降低。从本实验结果推测小儿紫癜疹消颗粒可能通过抑制血管内皮细胞中P65蛋白表达水平,进而抑制下游基因表达,达到抑制血管内皮细胞炎症的作用。
本研究表明,小儿紫癜疹消颗粒可以抑制HSP患儿血清IgA1诱导体外培养的HUVECs分泌炎症介质,并与小儿紫癜疹消颗粒的剂量呈负相关。小儿紫癜疹消颗粒抑制HSP患儿血清IgA1诱导体外培养的HUVECs分泌炎症介质的分子机制可能与下调NF-κB基因表达,从而减少细胞炎症介质因子IL-8、TNF-α等释放有关,小儿紫癜疹消颗粒能否通过其他途径抑制HUVECs炎症反应尚需进一步研究。

