PGE2及其受体在小鼠月经模型中子宫内膜崩解期的含量与表达研究
周芳,南楠,2,陈西华,贺斌,尹德东,卢文红,傅龙龙,2,张博男,2,郭士格,2,梁敏,2,王介东,徐祥波*
(1.国家卫生健康委科学技术研究所,北京 100081;2.北京协和医学院研究生院,北京 100730)
经典的月经发生假说认为,在分泌晚期,前列腺素(PGs)能促使子宫内膜螺旋小动脉收缩,加速内膜缺血、坏死及血管的破裂,进而使子宫内膜崩解脱落,导致月经的发生[1-3]。Pickles[4]首次在经血中检测到了PGs的存在,最终认为这些脂溶性物质为前列腺素E2(PGE2)和前列腺素F2α(PGF2α)。然而,有研究者认为它们是高等灵长类动物进化的“废弃物”,对月经发生不具有始动作用[5]。小鼠月经模型为月经机制的研究提供了重要的技术平台。本研究小组前期在小鼠月经模型的研究中,孕酮撤退前,COX抑制剂吲哚美辛和COX-2抑制剂Dup697能够显著抑制子宫内膜的出血和崩解[6],而COX是PGs的限速合成酶,本研究小组前期研究为PGs在月经发生中的主导作用提供了进一步的证据[7-9]。
子宫中主要PGs之一PGE2的功能主要是和血管扩张有关[10-11]。PGE2通过与其相应的受体结合在细胞内发挥作用,其受体属于G偶联蛋白受体,这些受体包括前列腺素E1受体(PTGER1)、前列腺素E2受体(PTGER2)、前列腺素E3受体(PTGER3)和前列腺素E4受体(PTGER4)[12]。其中,PTGER2主要在子宫组织的腔上皮下细胞表达,有研究表明,在妊娠大鼠子宫组织中,PTGER2在着床位点的腔上皮细胞中的第1~4天没有表达,从第5天开始,其mRNA和蛋白质的表达均升高,随后从第7天开始表达下降[13]。在人的月经周期中,早期分泌期的PTGER1是月经期的12.2倍,中期分泌期的PTGER2是增殖期的15.1倍[12]。本研究利用小鼠月经模型,探讨了月经发生子宫组织中PGE2含量及其受体PTGER2的表达变化,为揭示其在月经发生中的功能提供线索。
资料和方法
一、研究对象
实验动物:8~10周龄C57BL6雌鼠(SPFⅡ级)。实验经国家卫生健康委科学技术研究所动物伦理委员会批准。小鼠在可控的条件下给予充足的水和食物,光照8:00~20:00,温度(20±1)℃。
二、研究方法
1.建立小鼠月经模型:根据前期研究建立小鼠生理性孕酮撤退月经样模型[14]。蜕膜化49 h后,移去孕酮皮下埋置管时记为0 h。分别在0 h、8 h、12 h、16 h和24 h取材,液氮中迅速冷冻后,于-80℃长期保存。
2.PGE2蛋白质含量的ELISA检测:取不同时间点的小鼠子宫组织,称重,加入PBS缓冲液,手持匀浆器(Cole-Parmer,美国)将小鼠子宫组织匀浆。离心,取上清,采用ELISA试剂盒(Cayman,美国)检测匀浆组织中PGE2蛋白质含量,分光光度读数值(Thermal Fisher,美国)。根据标准曲线,计算出不同时间点子宫组织匀浆中PGE2的相对含量。
3.Ptger2 mRNA的实时荧光定量PCR检测:将-80℃保存的子宫组织标本,用TRIzol(Invitrogen,美国)提取总RNA,42℃孵育3~5 min,消除基因组DNA。将总RNA与随机引物及Oligo(dT)充分混合,25℃孵育10 min,42℃孵育50 min。85℃水浴孵育5 min后,冰上冷却,将RNA反转成cDNA。将各个时间点的小鼠子宫组织cDNA,用实时荧光定量PCR试剂盒(Abm,加拿大)检测Ptger2 mRNA表达,以β-Actin作为内参,利用ΔΔCt的方法统计分析mRNA的相对表达量。所用引物见表1。
4.PTGER2蛋白免疫组织化学检测:小鼠子宫组织用4%多聚甲醛固定24 h后,常规制备石蜡切片(Leica,德国)。将切片脱蜡并水化,用枸橼酸缓冲液(pH6.0)95~98℃水浴孵育20 min进行抗原修复。再加入3%H2O2室温孵育10 min,用PTGER2抗体对子宫切片进行免疫组化染色,孵育兔抗鼠PTGER2多克隆抗体(Abcam,美国),按照二抗试剂盒(北京中杉金桥)方法孵育羊抗兔多克隆抗体,二氨基联苯胺(DAB)显色,在显微镜下观察,待显色合适时终止。PBS中浸泡清洗后,用苏木精复染细胞核,中性树胶封片。

表1 实时荧光定量PCR引物序列
5.PTGER2蛋白Western blot检测:用蛋白提取试剂盒(Thermo Fisher,美国)提取小鼠子宫组织总蛋白,加入适量蛋白酶抑制剂Cocktail(Merck,美国);取20 μl蛋白溶液进行SDC-PAGE凝胶电泳(Bio-Rad,美国),随后转移至0.25 μm PVDF膜(Merck,美国);分别进行目标蛋白PTGER2(Abcam,美国)和β-Actin(北京康为世纪生物)的蛋白免疫印迹,最后用ECL发光试剂盒(北京全式金生物)检测其表达情况。
三、统计学方法
采用Excel表对实验数据进行统计分析。实验数据以(平均数±标准差)表示,多样本均数比较采用单因素方差分析(one-way ANOVA),两样本之间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
一、小鼠月经模型子宫组织中PGE2的含量
PGE2在子宫内膜崩解脱落期即孕酮撤退0~24 h子宫组织中的含量变化显示,PGE2在整个过程呈现逐渐升高的趋势(图1)。在0 h和8 h PGE2含量较低,随着时间的推移,在孕酮撤退12 h,逐渐增加(P<0.01),而在孕酮撤退16 h,PGE2含量达到最大值(P<0.01);在孕酮撤退24 h,略有下降,但仍显著高于0 h(P<0.01)。在孕酮撤退12~24 h显著高于0 h和8 h(P<0.01);孕酮撤退12~16 h是子宫内膜崩解脱落的关键期,此时PGE2含量显著增加,提示PGE2对子宫内膜的崩解脱落起重要作用。

相互比较,*P<0.01图1 小鼠月经模型孕酮撤退后0~24 h子宫组织PGE2蛋白表达
二、PGE2受体PTGER2蛋白在小鼠月经模型子宫内膜崩解期的定位
PTGER2蛋白在孕酮撤退的0~24 h定位于整个蜕膜化区域,且未呈现区域性的变化。在孕酮撤退的0 h,PTGER2的阳性信号较弱,主要定位于腔上皮下的基质细胞区域和整个蜕膜化区域;在孕酮撤退的8 h,阳性信号定位与0 h相似;在孕酮撤退的16 h,阳性信号明显增强,主要定位于蜕膜化整个区域的细胞浆中,颜色呈深棕色,虽然信号强度增强,但其定位并未呈现出区域性的特征;在孕酮撤退的24 h,阳性信号较16 h有所减弱,主要定位于中间蜕膜化剥脱坏死的区域(图2)。
三、Ptger2 mRNA与PTGER2蛋白在小鼠月经模型子宫内膜崩解期的表达
在孕酮撤退后0 h,Ptger2 mRNA表达水平相对较低;随后在孕酮撤退后8 h和16 h,虽然此时子宫内膜崩解的程度进一步加大,但是此时Ptger2 mRNA与0 h相比,无显著变化(P>0.05);在孕酮撤退后24 h,Ptger2 mRNA的表达较孕酮撤退后0~16 h显著升高(P<0.01)(图3)。
同时,对PGE2受体PTGER2在孕酮撤退0~24 h 的蛋白质表达进行了研究。发现PTGER2蛋白质在整个子宫内膜崩解过程即孕酮撤退的0~24 h中的表达并没有显著变化(P>0.05)(图4)。
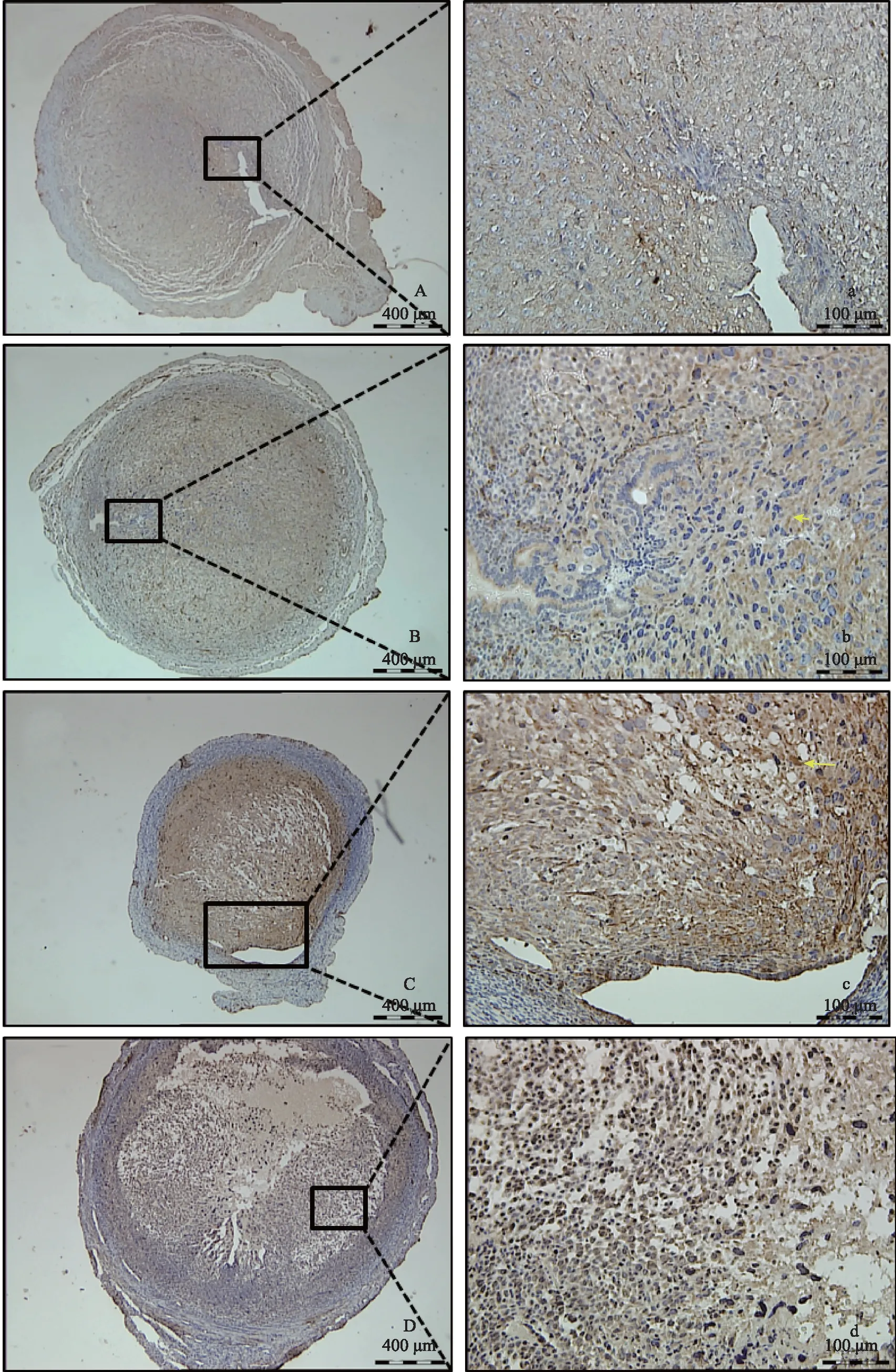
A和a:孕酮撤退后0 h;B和b:孕酮撤退后8 h;C和c:孕酮撤退后16 h;D和d:孕酮撤退后24 h左排为低倍视野(×100);右排为低倍视野中黑色方框区域的放大图像(×400);箭头示典型阳性着色图2 小鼠月经模型崩解期0~24 h的子宫组织PTGER2蛋白表达(免疫组化染色)

与其他各时间点比较,*P<0.01图3 小鼠月经模型孕酮撤退后0~24 h子宫组织Ptger2 mRNA表达

图4 小鼠月经模型孕酮撤退后0~24 h子宫组织PTGER2蛋白表达
讨 论
本研究探索了PGE2及其受体PTGER2在小鼠月经模型子宫内膜崩解期中的含量以及蛋白表达变化。本研究首先探讨PGE2在子宫内膜的崩解期即孕酮撤退的0~24 h各时间点的含量变化,发现在12~16 h时子宫内膜的崩解期显著增加,此时是子宫内膜崩解关键期,提示PGE2对子宫内膜的崩解可能起重要作用。PGE2的功能主要是和血管扩张有关。有研究表明,月经经血中的PGE2水平是血清或腹膜液体中的2~3倍[15]。PGE2和PGF2α在月经周期的分泌期增殖表达均升高,甚至贯穿表达于整个月经周期[16-17],我们的研究结果与其一致。
PTGER2作为一种刺激性G蛋白偶联受体,PGE2诱导的PTGER2激活可激活腺苷酸环化酶,导致细胞质cAMP水平升高和蛋白激酶A的激活。PTGER2也可激活糖原合酶激酶3β和β-连环蛋白途径[18]。PTGER2存在于牛的子宫内膜中,其伴随着内膜中外植体生长因子的表达和细胞增殖表达而增加,预测其与子宫内膜的生长密切相关[19]。有研究表明,在子宫内膜异位症妇女腹膜液中PGE2的含量较高,高浓度的PGE2对异位内膜的生存和生长中起着重要作用[20]。PGE2能够促进含有PTGER2的子宫内膜癌细胞Ishikawa细胞系中HIF-1αmRNA和蛋白质的表达。COX-2抑制剂可以明显地减小子宫蜕膜区的大小,但PGE2可以恢复被COX抑制剂所抑制的子宫的蜕膜化过程。有研究者发现Ptger2-/-小鼠虽然可以正常着床,但着床的位点数量明显减少。这可能由于Ptger2-/-小鼠中PGE2与其受体偶联,通过Gs激活腺苷酸环化酶,弥补了由于PTGER2缺失引起的cAMP不足。
而本研究中,PTGER2在子宫内膜崩解脱落期,mRNA的水平在除孕酮撤退的24 h之外,均无显著性变化。进一步研究发现其蛋白水平在此过程中并无显著性变化。同时免疫组化的结果显示,PTGER2在子宫内膜崩解剥脱的进程中,在子宫中的分布并没有显著的区域性特征。PGE2的含量在崩解期特别是子宫内膜崩解关键期显著增加,然而其受体PTGER2无论在mRNA还是蛋白质水平并无显著变化,这提示PGE2对子宫内膜崩解剥脱可能通过PGE2含量的增加来实现,而不是通过其受体PTGER2表达的增加来实现。
我们发现Ptger2 mRNA在孕酮撤退的24 h表达显著升高,此时子宫内膜完全脱落,新的腔上皮细胞已经被覆完全,修复启动,提示这可能与崩解后的脱落有紧密关系,而此时的蛋白质并未出现此种情况,考虑mRNA翻译到蛋白质具有一定的时间差。在本研究中并未对其后的24 h PTGER2蛋白质进行检测,在后续的实验中将进一步研究,以探讨PGE2及其受体PTGER2对修复期子宫内膜的修复作用。
子宫内膜异常出血是影响女性生殖健康的重要因素。月经从青春期后开始出现,直到更年期结束,占据女性的一生中较长时间。月经期的身体健康,对女性生活质量影响重大。临床上关于月经疾病的痛经、闭经和功能失调性子宫出血的发生机制并不明确。了解正常月经发生的作用机制,才能在临床中找到治疗靶点。

