化学动力学理论视角下实验教学心像的矫正


摘要: 教师在长期实验教学历练过程中,若缺失了化学专业理论的持续研习与高端引领,就容易形成限于个人理解惯性下的不良实验教学心像。从化学动力学等理论视角,结合具体实验教学与创新实践案例,对教师如何以专业理论学习为抓手不断完善个人化学实验教学心像等问题进行分析与探讨,提出了矫正不良实验教学心像的实施策略: (1)强化理论学习,纠正实验认知;(2)审视思维惯性,理解实验操作;(3)探寻关键要素,引领实验创新。
关键词: 实验教学心像; 化学动力学; 理解惯性; 理论学习; 化学教学
文章编号: 10056629(2019)4008405中图分类号: G633.8文献标识码: B
1 研究背景
心像就是心理图像,是每个人内心中所具有的对现实或未来世界认识与理解的内在影像。心像是对世界作出解释的源泉,主宰了我们对外部世界的解释,我们总习惯于根据自己内在的影像来赋予外在世界的意义[1]。作家对生活物象的感觉和体验达到一定程度,就自然产生了创造艺术形象的要求和冲动;化学教师对实验的实践和经验积累到一定程度,面对新的复杂实验过程、现象与结果时内心也自然会产生个人心像下的惯性理解。但通过纯粹经验输入建构的教师个体实验教学心像,在理解与解释化学实验时易限于教师个人经验来源、专业水平、教育理念、文化背景等诸多因素的影响,存在或多或少非理性的、有悖科学的成分,从而在教学中出现关于化学实验的认知偏差和实践障碍。
要矫正这种不良的非理性实验教学心像,减少教师心像与客观事实背离现象的发生,我们就必须减少个人非理性经验输入、强化学科理论指导、促进专业素养提升。本文拟从化学动力学等理论的视角,结合教学实践中具体的几则化学实验疑难探究与分析案例,对教师如何进一步通过专业理论学习矫正与完善化学实验教学心像作简要探讨,抛砖引玉供同行参考。
2 化学动力学和热力学的教学定位与内涵
經验只能把握知识点滴,理论却能撑起知识大厦。中学化学教材在介绍化学专业理论时羞答答,让人雾里看花,致使有些教师教了几年化学以后,理论水平逐步下滑,甚至慢慢退化到一个普通高中生的认知水平。如一些教师对化学热力学和动力学的认识并不深刻、理解也不透彻,容易造成认识混淆,甚至知识紊乱、逻辑不清,导致处理诸如平衡移动标志及方向判断等具体教学问题时,出现首鼠两端、张冠李戴等不当行为。因此,教师有必要坚持学习,进一步厚实理论修养,把握好热力学和动力学的教学定位、理论内涵与应用,从源头加以理解甄别,提升自身课堂驾驭能力和执教水平。
从教学定位角度看,热力学和动力学的基础内容是中学化学课程的重要组成部分,课程标准对教学目标作了明确分割。学生认识动力学理论的具体要求有: (1)知道化学反应速率的定量表示方法,能通过实验测定某些化学反应的速率;(2)知道活化能的涵义及其对化学反应速率的影响;(3)通过实验探究温度、浓度、压强和催化剂等对化学反应速率的影响,认识其一般规律。对热力学的要求则是: (1)能用焓变和熵变说明化学反应的方向;(2)能描述化学平衡建立的过程,知道化学平衡常数的涵义并利用化学平衡常数计算反应物的转化率[2]。
从理论内涵对比看,热力学和动力学是综合研究化学反应能否发生、能量变化、反应速率和程度等规律的两个不可或缺的重要组成部分,两者研究任务和侧重点不同,既有显著区别也存在必然联系。热力学着眼于反应体系状态研究,从静态角度出发通过应用基本原理研究化学反应的始终态,讨论化学变化过程中伴随的能量变化,主要回答化学反应的可能性问题。而动力学从动态观点出发,主要着眼于化学反应过程性研究,在特定条件下(温度、压强、浓度及介质等)通过对个别或少数分子、原子微观性质层面探讨来分析化学反应机理,研究指向内外因对化学反应速率大小的影响,解决实现化学反应的现实性问题,其中反应速率理论是经典化学动力学对反应历程阐释的基本理论,包括反应速率的概念和分子碰撞理论基本模型[3]。
3 动力学视角下化学实验教学心像的矫正
教师心像决定着教师的教育视野,决定着教育行为的可能性和特征,教师教育教学行为的缺陷,归根到底是其心像局限性导致的[4]。教师实验教学心像决定了教师与实验教学间的关系,若教师对专业理论知识与化学实验能力有着深刻认识与足够自信,那么就可能更积极地实施实验教学,有效开展实验探析,大胆改进与创新实验方案。而现实中很多教师因动力学理解偏废而实验教学心像不正,造成照本宣科、固步自封、不求甚解等教学惰性,展示出“不可违背教材实验内容,同行们的理解也没问题”等错误倾向,实践时很容易引发误判而导致教学行为与实验事实相违背。因此,有必要进一步加强实践反思与专业研修,提升动力学理论意识,全面审视和更新实验认识,积极矫正自身不良的实验教学心像。
3.1 强化理论学习,纠正实验认知
速率是动力学概念,平衡是热力学概念,属不同范畴,两者相关却不互为因果。因现行教材编写大多通过速率认识平衡,再基于速率变化讨论平衡移动,这种时而速率、时而平衡的展示方式,致中学里动力学理论与热力学混为一谈现象很普遍。有关实验方面,因长期受实验固有经验、同行认识传袭及教师个人惰性局限,教学时会将某些实验中的平衡建立想当然地认为是一个很慢或很快的过程,丧失了应有的全面性与深刻性,导致认识片面化,出现一些实验事实性证据张冠李戴、胡乱佐证的乱象。所以,一线教师通过加强动力学等理论学习不断纠正和完善自身实验认知是非常必要的。
随着化学教学中数字化传感设备的普及,基于传感技术进行教学研究方面的素材愈加丰富。其中,NO2和N2O4平衡的探究就是一个创意与争议并存的热题。习惯上,通过压缩(或拉伸)针筒时透光率(或压强)变化来说明压强对平衡的影响。如解读图1,一般认为t1压缩和t2扩体表现的峰a、 b,体现了变压后平衡移动并逐步建立新平衡的过程。
用注射器的传统方式是侧面观察颜色变化,即注射器活塞迅速内推后,可看到气体颜色先变深后变浅,最终比压缩前深。教学中,同行们常将以上现象分解成两个过程: 内推活塞气体体积骤减,NO2浓度变大,体系颜色加深,这是物理变化过程;后续颜色渐浅属化学变化过程,NO2浓度减小表明压缩时2NO2N2O4平衡正向移动。反之,若外拉活塞,体系颜色则先变浅后变深,最终比扩体前浅,解释与上类同。
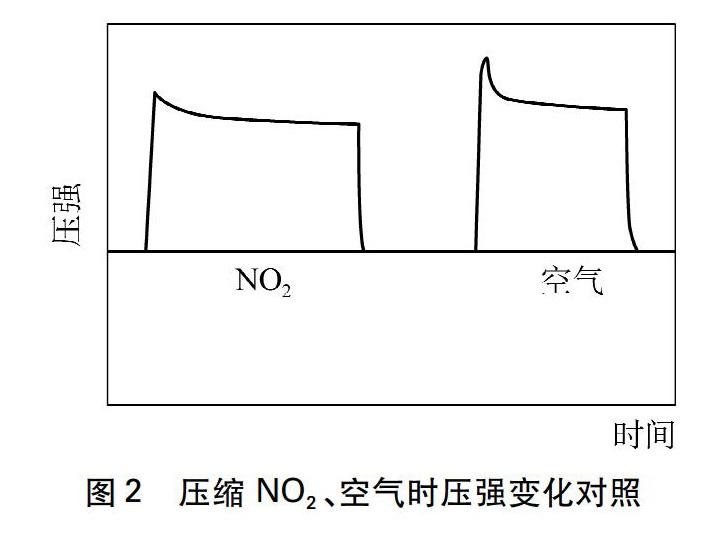
事实是否真如此?有同行证明[5],即使将对象换成空气后也会出现类似结果,如等量压缩NO2、空气时压强变化见图2。解释是,活塞迅速内推会对压强传感器感应薄膜产生一个力的冲击,瞬间压强增大会让薄膜因惯性发生过度形变,随即薄膜逐步恢复至受力平衡态才显示出压缩后
的真实压强,这个过程在图像上就出现了一个峰值。我们认为,从传感器感应薄膜固有物理性质角度分析图2有一定新意,但为什么色度传感器不存在感应膜,实验得图1也会出现类似變化。可见,上述理由可能还不够准确和全面。
从2NO2N2O4动力学角度看,生成N2O4属二级反应,而解离N2O4是一级反应,即此为1~2级可逆反应[6]。 25℃时k正=(9.8±0.9)×106L·mol-1·s-1,k逆=(5.3±0.5)×104s-1。25℃下迅速扩体或缩体,由一个平衡态过渡到新平衡态所需时间可用松弛法近似处理[7],计算将原平衡态99.9%过渡到新平衡态所需时间约5×10-5s,而操作扩体或缩体一般要0.1s,即平衡在体积变化瞬间便已达成,变体时浓度改变的物理过程和平衡移动的化学过程两阶段不可能有效区分!有研究指出[8],迅速变体时体系因得到或损失功而会引起升温或降温。用温度传感器对实验体系回复至室温时间进行粗测,一般不少于15s。注射器管壁散热或吸热回复到室温的过程会不断引起平衡移动,这才是一个能被观察的渐变过程。
3.2 审视思维惯性,理解实验操作
有这样一则小故事: 一聋哑顾客到五金店买铁钉,将左手两指作持钉状放于柜台,右手作锤打状。售货员递来一把锤子,顾客摇头并指指作持钉状的两手指,售货员终于拿对了。此时又来一盲人顾客,请你想象盲人将如何用最简单方法买到一把剪刀?我们绝不能定势于聋哑人的手势,因为盲人能说话。所以,思维陷阱是由单纯经验惯性造成的,经验在指引我们做出决定的同时,也可能固化我们思维,影响思维发散与创新。教师基于长期经验积累而自然形成的实验教学心像,在思考问题时易理解狭隘化、解释片面化。杜甫诗云:“会当凌绝顶,一览众山小。”化学实验教学需要我们多审视和破除思维惯性,通过加强动力学等理论的学习,增强自己从更高层面思考和研究实验问题的能力,做到实验过程知其然并知其所以然,不断提升实验操作水平。
例2 Fe(OH)3胶体制备的操作分析与把握
中学制备Fe(OH)3胶体常用FeCl3水解法。鲁科版《化学1》教材[9]“练习与活动”中操作是: 首先用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色。一般认为用沸水在于促进Fe3+水解。这种理解正确吗?有如下事实与分析为据。
(1) 洁净试管取适量蒸馏水,加热至沸,滴几滴1mol·L-1FeCl3溶液,管口放一张湿润蓝色石蕊试纸,管内液体澄清但逐渐加深为红褐色,检测有丁达尔现象,试纸未显酸性现象。说明Fe(OH)3胶体生成过程中,未检测到HCl逸出,即使有也是极少量的。将以上试管继续冷却至室温,滴1滴稀盐酸补偿可能挥发出的少量HCl,胶体分散系未被显著破坏。
(2) A、 B、 C、 D四试管各加等量FeCl3和NaOH溶液,得四等份Fe(OH)3沉淀。A作对照,B、 C、 D在沸水浴中各加热5min、 15min、 30min,加热时间越久,试管中浑浊越明显,颜色也越深。若继续用等浓度盐酸溶解沉淀至恰好消失时,四试管所用酸的体积依次增多。可见,与未加热相比,Fe(OH)3沉淀受热后更难溶于酸,所以受热形成的Fe(OH)3胶体冷却后也较难溶于酸。Fe(OH)3胶粒实际是一些多核铁配合物或聚合体,组成可简化表示为Fe2O3·nH2O。加热或久置时n会逐步减小,颜色加深,也更趋难溶于酸。事实上这也是很多高价金属氢氧化物的通性。
(3) FeCl3固体和蒸馏水现配1mol·L-1FeCl3溶液,测得pH为0.63,检测无丁达尔现象;放置过夜,溶液光路逐渐明显,pH减小到0.40;长时间(数周以上)放置出现一定程度浑浊,pH进一步下降至0.34。若改变所配FeCl3溶液的浓度,重复实验,刚配好时都没有明显的丁达尔现象,久置后则都有不同程度的丁达尔现象甚至浑浊,pH也逐渐减小。
有同行也证得,通常条件下Fe3+水解平衡是一个较缓慢的建立过程[10]。从动力学机理角度,Fe3+加水分解、聚合、老化直至形成不溶物等是一连串复杂多聚过程,主要可分成两阶段: 第一阶段通过羟桥化作用,使简单水解产物聚集成具有特征大小的高正电荷的多聚配合物;第二阶段是羟桥化多聚物聚集成更大多聚物(电子显微镜观察起始羟桥化多聚物,实际为直径2.0~4.0nm球形阳离子),然后通过氧桥化作用进一步降低电荷,此原则是增长成核的过程。具体参见图3[11]。
到此,可归纳出教材制胶体用沸水的理由。除促进Fe3+水解平衡正向移动外,还在于升温加快速率以缩短水解平衡建立时间,及引起Fe(OH)3胶粒脱水与晶型转化。所以,演示实验时加热操作就成了必备条件。但到底是蒸馏水煮沸后加FeCl3溶液,还是蒸馏水加FeCl3溶液后再加热,只要操作娴熟、把握到位就不影响效果,也没必要死抠。还需指出,若实验中FeCl3溶液与Fe(OH)3胶体要进行丁达尔现象对照,所用FeCl3溶液务必现配。
3.3 探寻关键要素,引领实验创新
化学实验能为学生正确认识物质及其变化规律提供事实依据,促进学生知识体系结构化,培养学生学科思维与科学思想。但受实验仪器、药品、装置、设计思路等影响,平时教学中有些演示实验现象不明显、教学效果差,致使学生对实验结论产生怀疑,影响效果,也失去了实验应有的魅力。诸多同行在实验改进与优化方面已做了大量成功尝试与探索,但受个体不良实验教学心像的束缚,一些研究仍停留于为改进而改进的层次,流于表面偏多而深入分析的较少,装置改进偏多而条件探寻的较少,盲目实践偏多而理论引领的较少。这时刻提醒我们要加强理论研修,从理论视角俯视和认识实验,探寻成功的关键要素,破解疑难的失败迷局,不断实现实验的改进与创新,更好地利用实验激发学生兴趣,启迪学生心智,开拓学生思维。
例3 氯水光解实验的理论分析与操作创新
氯水光解(见图4)是一个传统实验,但课堂演示却面临操作、时限、成功率等方面的弊端,致使现行高中化学教材都很默契地舍弃“传统”未加编排。故有必要从理论角度对其过程原理进行分析,并实现操作優化与创新。
Cl2与水虽能反应生成HCl和HClO,但速率却很慢,新制氯水中Cl2+H2OHCl+HClO需要较长时间才建立平衡。再者,粗算1L水溶解2L Cl2达饱和时,Cl2浓度约8.9×10-2mol·L-1。由25℃下平衡常数K=4.2×10-4算得平衡时c(HClO)仅3.0×10-2mol·L-1[12]。可见,纵使饱和氯水中HClO的浓度也很小。我们还需注意Cl2溶解能力较差,溶于水时需很长时间才能达到饱和,实际所用氯水一般都不会是饱和的,所以其中HClO实际浓度比先前理论值还要低得多!还有,氯水光解潜伏期比较长[13],通常需长时间持续照射才出现少量气泡。从动力学机理看,HClO光解是光作用下分解出自由基的链反应。具体过程为[14]:
链引发HClO光HO·+Cl·
链传递Cl·+HClOHO·+Cl2
HO·+HClOH2O2+Cl·……
链终止Cl·+Cl·Cl2
HO·+HO·H2O2
所以,HClO光解反应可表示为2HClO光H2O2+Cl2,这也印证了文献[15]“卤素单质的水溶液中存在H2O2分子”的表述。H2O2在酸性介质中能稳定存在,某些重金属离子、MnO2、 Co2O3、生物酶等是分解生成O2的优良催化剂,而320~380nm波长光对其也有催化分解作用,但能力不足、过程缓慢、效果不突出。因此,阳光照射饱和氯水直接释放出的O2量一般很少,但若光照前先预加少量MnO2等粉末,则会大大提高O2生成速率与产量。
理论在混沌中建立秩序,从沙砾中找出金子。要优化氯水光解实验以满足教学需求,化学理论犹如拨云见日般地指明了成功的核心与关键所在: 一要提高氯水中c(HClO),二要让HClO光照生成的H2O2快速分解为O2。因此,除装置、光源外操作上要重点把握以下几点: (1)将常规方法制得的新制饱和氯水,盛于棕色试剂瓶,暗处密封放置5~10天再实验;(2)通过加入适量Na2CO3溶液或CaCO3浊液,拉动Cl2+H2OHCl+HClO平衡进一步正向移动;(3)光照前,氯水中要预加少量MnO2、 Co2O3粉末等以催化H2O2快速释放出O2。
4 结束语
经长期化学实验教学的历练,积存在教师头脑中那些大量实验经验的表象,在碰到和处理新实验情境问题时会被充分调动和活跃起来,并通过理性梳理和个人理解的双重作用重新进行组合和化合,从而在教师内心逐渐形成一个愈发明晰、具备个人理解惯性特征的解决问题的实验教学心像。我们必须清醒认识到,经验思维只能把握点滴知识,而理论思维则能够撑起知识大厦。正如傅鹰教授所说,没有理论,实验就可能变成盲动,劳而无功,进步迟缓,或根本不能进步。如果我们在个人实验教学心像的养成过程中,缺少必要的、持续的理论学习与反思,失去化学理论的高端引领与拨正,就可能导致心像曲解,而这种不良实验教学心像本身所具有的失真性与顽固性,很容易将我们引入思维歧途,到时心之所向也就未必真实了。因此,我们只有对化学动力学等理论知识学习、研究、实践与反思,不断调整姿态武装好头脑,有效矫正不当实验教学心像,方能在化学教学与实验创新中表现得游刃有余。
参考文献:
[1][4]李黔蜀. 教师心像的教育意义及完善策略[J]. 教育评论, 2009, (3): 46~48.
[2]吴晗清, 李丹, 赵冬青. “速率”和“平衡”教学亟待澄清的误区[J]. 化学教学, 2017, (3): 21~25.
[3]吴新建, 张贤金. 化学平衡、 化学反应速率概念及其关系的探讨[J]. 化学教与学, 2012, (4): 8~9.
[5]刘言涛. 传感器分析NO2和N2O4平衡常见问题辨析[J]. 化学教与学, 2012, (6): 91.
[6]E.A. Moelwyn-Hughes. Physical Chemistry [M]. London: Oxford University Press, 1961: 1123.
[7]杨志明. 压力对N2O4解离平衡的影响及演示实验[J]. 贵阳师院学报(自然科学版), 1983, (1): 117.
[8]沈鸿福. 二氧化氮气体的体积变化同颜色变化的关系[J]. 化学教育, 1980, (4): 26.
[9]北京师范大学国家基础教育课程标准实验教材总编委会. 普通高中化学课程标准实验教科书·化学1[M]. 济南: 山东科学技术出版社, 2006: 37.
[10]沈彩娣. 对铁离子水解的几个异常现象的探讨[J]. 中学化学教学参考, 2018, (6): 35~37.
[11]马莹, 何静, 马荣骏. 三价铁离子在酸性水溶液中的行为[J]. 湖南有色金属, 2005, (1): 36~39.
[12]陆燕海, 嵇月萍. 氯水光解实验的改进[J]. 化学教学, 2012, (7): 47~48.
[13]刘怀乐. 给“氯水”性质实验加几个注释[J]. 化学教育, 2010, (5): 76~77.
[14]陈云生. 对次氯酸光照分解产物的探析[J]. 宁德师专学报(自然科学版), 1995, (2): 71~74.
[15]北京师范大学无机化学教研室等. 无机化学[M]. 北京: 高等教育出版社, 1981: 473~528.

