人脐带血来源造血干细胞体外扩增的研究进展
董忱 赵龙 张斌 陈虎
造血干细胞(hematopoietic stem cells,HSCs)是一群异质的原始造血细胞,具有自我更新和多谱系分化2个基本特征。通过造血干细胞移植(hematopoietic stem cell transplantation,HSCT)可以实现长期多谱系重建造血系统,多用于治疗退行性疾病和多种血液系统疾病。目前,HSCs的主要来源有骨髓(bone marrow,BM)、动员的外周血(mobilized peripheral blood,mPB)、脐带血(umbilical cord blood,CB)和胎盘(placenta)4个途径,其中 CB HSCs具有人类白细胞抗原配型相合程度要求低,移植物抗宿主病(graft versus-host disease,GVHD)发病率低,采集方便、对供者无伤害且不存在伦理问题等优点,成为未来HSCT治疗的优先来源。
CB临床应用受限于HSCs数量较少,一般仅能满足儿童和体重较轻的成人移植要求,而当移植输注HSCs数量不足时会导致患者中性粒细胞恢复延迟,增加GVHD和移植相关死亡发生率。近年来,双份脐带血移植(cord blood transplantation,CBT)的实践扩展了其应用,但有研究指出,双份CBT没有比单份CBT更具临床优势,其血液学恢复并未得到改善。原因可能有三个方面:一是最终只有一份CB能导致长期造血;二是双份CB联合有较高的总有核细胞数,但每份CB的总有核细胞数不一定都比单份CB多;三是双份CBT的移植物抗移植物效应会诱导GVHD发生,可能导致移植后血液学恢复受损[1]。
为了攻克CB应用的瓶颈,探索最大限度扩增CB HSCs又保证其生理功能不受影响的方法,国内外研究者付出了诸多努力。本文重点回顾以小分子化合物(small-molecule compounds,SMCs)为首的CB HSCs离体扩增的各种策略及其在移植模型和临床试验中的贡献。
一、细胞因子是最基本的扩增工具
细胞因子在调控HSCs自我更新、增殖和分化等生命活动中发挥着重要的作用。实验验证,细胞因子是CB HSCs离体扩增时不可或缺的基本因素[2]。其中,FMS样酪氨酸激酶 3 配体(FMS-like tyrosine kinase 3 ligand,FL),干细胞因子(stem cell factor,SCF),血小板生成素(thrombopoietin,TPO)和白细胞介素(interleukin,IL)-6是CB HSCs体外培养扩增效果最佳的细胞因子组合[3]。其他有效细胞因子的加入可能以个体或协同方式增强扩增作用,如Notch配体Delta-1和Jaggad-1,胰岛素样生长因子2(IGF-2),Sal样蛋白4(SALL4)和复合蛋白TAT-BMI-1[4]等。但是,单纯使用细胞因子或其组合不足以实现HSCs的高效扩增,随着培养时间的延长会导致离体培养的HSCs快速分化。最新研究发现,CHIR-99021,Forskolin和OAC1(CFO)的组合可以替代经典细胞因子组合维持人CD34+细胞在体外有效扩增[5]。若能实现细胞因子的化学替代,将为临床应用提供更多的便利和安全保障。
二、小分子是CB HSCs体外扩增的有效激动剂
SMCs来源易得,结构明了,性质稳定,便于深入探究作用靶点和机制,并已长期应用于基础生物学和医学研究中。在现行体外扩增技术中,SMCs在提高功能性CB HSCs扩增倍数上有重大突破(表1)。
(一) SR1
StemRegenin 1(SR1)是第1个针对体外扩增CD34+CD133+细胞而从100000种化合物文库中筛选发现的小分子激动剂。2010年,Boitano等[6]首次报道嘌呤衍生物SR1可以促进CB CD34+细胞的离体扩增。研究表明,SR1与CD34+细胞的芳烃受体(AhR)直接结合并且是其有效的拮抗剂。研究发现SR1的作用有种属选择性,SR1可以抑制人AhR,轻微抑制小鼠AhR,但对大鼠AhR无抑制作用。HSCs移植于免疫缺陷小鼠是检测功能性HSCs的金标准,这种差异可能表明人和小鼠的一些AhR相关途径是不同的。
(二) UM171
2014年,Fares等[7]在超过5200种化合物的化学库中通过两级筛选,首先发现了一种嘧啶吲哚衍生物UM171,它可以在新开发的分批补料培养系统(fed-batch culture system)的帮助下扩增CB CD34+CD45RA-细胞和表型定义的长期(long term,LT)-HSCs。当与SR1组合使用时,扩增效率会更高。但SR1损害了淋巴髓样LT-HSCs的增殖潜力,优先扩增短期(short term,ST)-HSCs,而UM171优先支持LT-HSCs的扩增。转录组分析表明UM171不下调AhR途径,但抑制了与红细胞和巨核细胞分化相关的基因。根据StemCell CKB计算分析发现[8],UM171可能通过作用于转化生长因子β信号通路促进CB HSCs离体扩增。
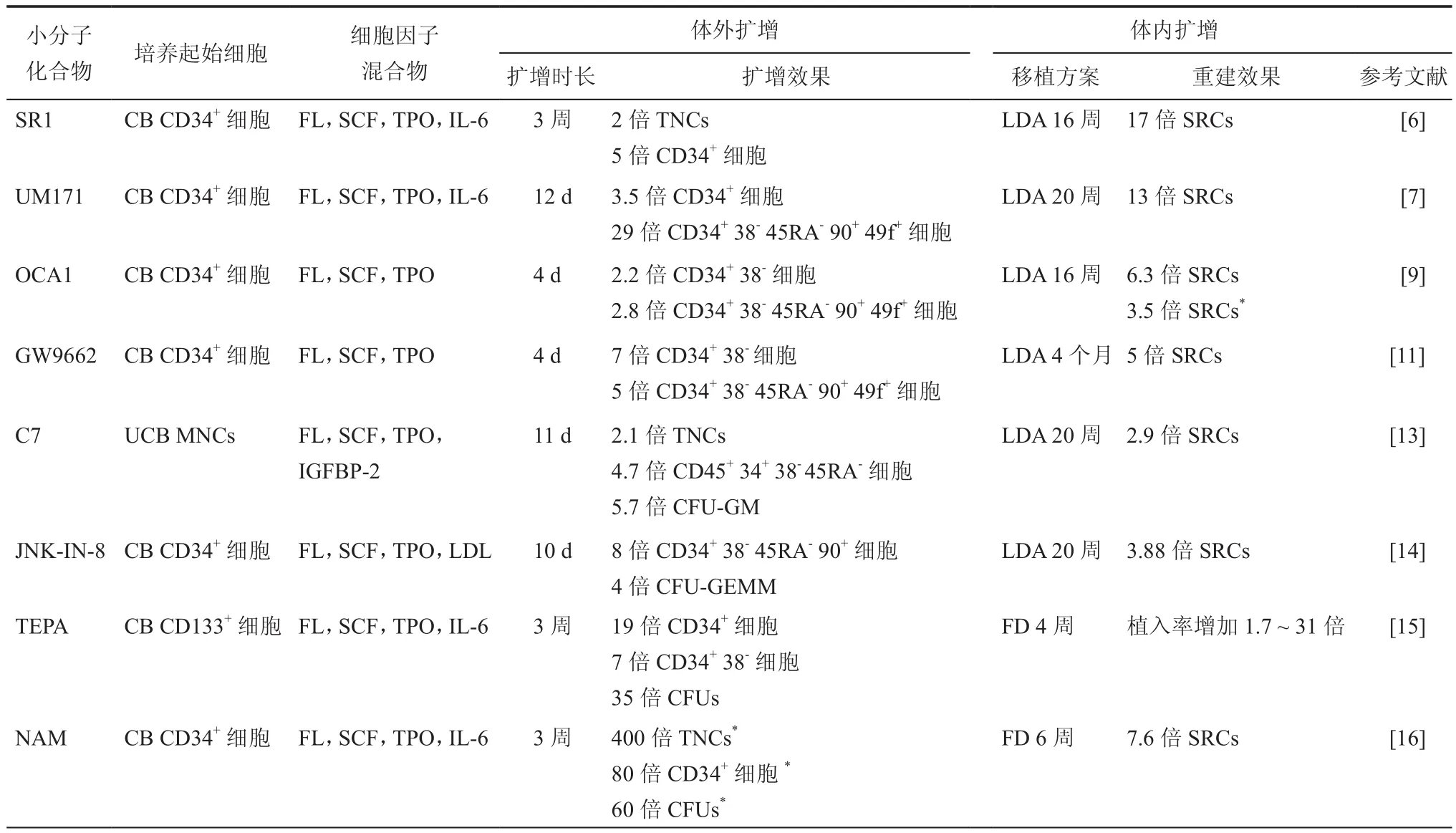
表1 用于脐带血造血干细胞离体扩增的“明星”小分子化合物
(三) Oct4活化化合物1(OAC1)
转录因子Octamer结合蛋白4(OCT4)表达在胚胎干细胞和HSCs等多种成体干细胞中,在维持其全能性和多能性上起重要作用。Li等在小分子文库筛选鉴定了可以促进内源性Oct4表达的OAC1。Huang等[9]发现OAC1诱导的OCT4活化可以增强细胞因子诱导的CB HSCs的自我更新,发现并鉴定了OCT4位于HOXB4上游,OCT4的活化通过上调HOXB4表达来增强HSCs的离体扩增。
(四) PPAR-γ拮抗剂
2017年,Sertorio等[10]利用RNAi筛选发现过氧化物酶体增殖物激活受体(PPAR)-γ信号是人HSCs自我更新的负调节因子。Guo等[11]从74种核激素受体化合物文库中筛选出PPAR-γ拮抗剂GW9662可以通过抑制CB HSCs分化和增强葡萄糖糖酵解促进CB HSCs离体扩增。机制研究还发现,PPAR-γ的拮抗作用可以下调果糖-二磷酸酶1(FBP1,编码糖酵解的负调控因子)表达,而FBP1的过表达也会抑制由PPAR-γ拮抗诱导的CB HSCs扩增。
(五) p38-MAPK抑制剂
p38-丝裂原活化蛋白激酶(p38-MAPK)的激活与各种生理条件下HSCs衰老的发生有关。CB CD133+细胞的离体扩增激活p38,其特异性抑制剂SB203580可以抑制CB HSCs的衰竭[12]。2018年,Bari等[13]通过构效关系研究建立了1个包括50个SB203580类似物化合物文库,通过筛选发现了1个新型唑类小分子C7,它可以直接加入未经富集的脐带血单个核细胞的离体培养体系中,有效扩增表达CD90和 CD49f的 LT-HSCs。
(六) JNK-IN-8
JNK信号通路参与多能干细胞自我更新和白血病发生。2019年,Xiao等[14]通过筛选JNK通路相关小分子,发现其特异性抑制剂JNK-IN-8可以增强CB CD34+细胞的自我更新能力,有效离体扩增LT-HSCs。机制研究发现,JNK- IN- 8的处理下调了JUN基因和c-Jun mRNA的表达,降低了c-Jun蛋白的磷酸化水平。研究提示,JNK信号通路可能是一种调节人类HSCs扩增的新型信号通路。
许多其他分子,如铜离子螯合剂四亚乙基五胺(TEPA)[15]和烟酰胺(nicotinamide,NAM)[16]可以促进人CB CD34+CD38-细胞离体持续扩增,提高体内归巢效率。前列腺素E2(PGE2)及其长效衍生物dmPGE2,组蛋白去乙酰化酶的抑制剂曲古抑菌素A(TSA),组蛋白甲基转移酶抑制剂(5azaD)和糖原合成酶激酶-3β抑制剂BIO等已经被证明在改善临床前模型的HSCs扩增和(或)植入方面是成功的,下一步可能进行临床研究。
从研究成果来看,目前对这些小分子促进HSCs扩增的机制尚不明晰,SMCs基本都是通过海量筛选发现的,这无疑给研究者增添了实验成本和难度。因此,要高效地发现调控HSCs自我更新和增殖的小分子药物,必须进行深入的机制研究。
三、正在进行的小分子扩增临床试验
(一) MGTA-456
Magenta Therapeutics公司将含有 SR1、FL、SCF、TPO和IL-6的培养基与CB CD34+细胞共培养15 d后获得的扩增产品命名为MGTA-456。在先前的Ⅰ(Ⅱ)期安全性研究中(NCT01474681),18例患者接受了 MGTA-456和CD34-部分及1份未操作的CB共同移植,其中11例显示出扩增细胞的优势植入和更快的造血重建,并且获得持续造血[17-18]。在2018年4月11日,MGTA-456获得了美国食品和药物管理局(FDA)授予的孤儿药资格。
(二) ECT-001
蒙特利尔Maisonneuve-Rosemont医院的血液学专家组正在进行UM171的安全性和有效性临床试验研究(NCT02668315),将 CB CD34+细胞经过 UM171共培养7 d的扩增产物称为ECT-001。在2018年第16届国际脐带血论坛上,该专家组汇报ECT-001可以让患者更早获益,比接受外周血或BM移植的患者更早退烧,平均住院时间减少11 d[19]。研究者提出ECT-001导致的中性粒细胞的更早植入为患者提供了的抗感染防御机制;ECT-001含有较高比例的树突状细胞和肥大细胞前体,可以促进免疫调节从而减少肠道细菌移位并降低复发风险;ECT-001对CB大小要求较低,因此更多患者能够接受HLA匹配更好的CB[19]。一项Ⅰ(Ⅱ)期开放性研究(NCT03441958)正在招募20例患者进一步评估ECT-001作为一种新型治疗策略治疗高危多发性骨髓瘤患者的安全性和有效性。
(三) StemEx
Gamida Cell公司开发了 StemEx,即含有 TEPA、FL、SCF、TPO和IL-6的培养基与CB CD133+细胞共培养21 d后得到的移植物。在MD安德森癌症中心进行的Ⅰ(Ⅱ)期临床试验验证了StemEx是安全可行的[20]。接着,Gamida Cell启动了一项多国Ⅱ(Ⅲ)期登记试验(NCT00469729),来自美国、欧洲和以色列的25个干细胞移植中心的101例患有高危白血病和淋巴瘤的受试者参与了该试验。与同期国际血液和骨髓移植研究中心登记的接受双份脐带血移植(DUCBT)的患者(n= 295)相比,提高了100 d存活率,同时促进BM和血小板植入[21]。
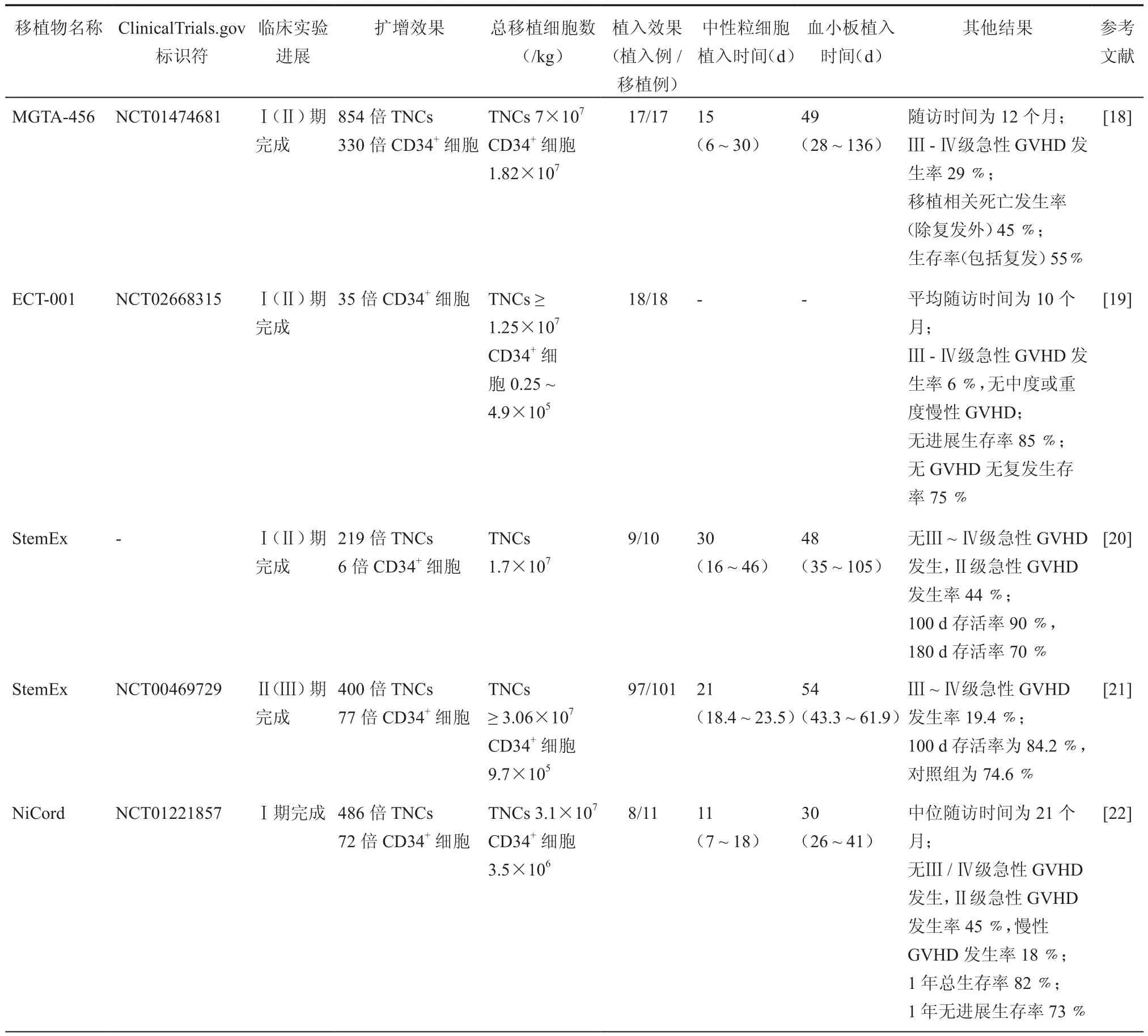
表2 小分子化合物离体扩增脐带血造血干细胞的临床试验
(四) NiCord
Gamida Cell支持的Ⅰ期临床试验(NCT01221857)中,移植物NiCord由NAM共培养CB CD133+细胞21 d的扩增部分和非培养的T细胞部分共同组成,在11例患者中有8例患者观察到NiCord中性粒细胞和T细胞稳定植入[22]。2016年,一项NiCord治疗血液系统恶性疾病的Ⅲ期多中心对照研究(NCT02730299)启动,计划入组120人,若顺利完成,NiCord离临床使用将又前进一大步[23]。NiCord已经获得了美国FDA授予的突破性疗法认定(首次认定的干细胞移植技术)和FDA及欧洲药品管理局(EMA)授予的孤儿药资格。
四、单个表观遗传修饰多路径影响CB HSCs扩增
N6-甲基腺苷(m6A)是真核信使RNA上最丰富的表观遗传标记。许多参与CB HSCs自我更新的转录因子都是通过m6A修饰来标记的,如Gata2,Tal1,Etv6和Stat55等。2018年,Li等[24]发现 m6A修饰被YTH结构域家族蛋白(YTHDF)识别,其中YTHDF2结合m6A修饰的mRNA后促使mRNA降解,而YTHDF2缺陷会导致m6A修饰的mRNA的稳定性延长,上调这些转录因子的表达。实验证明,敲低YTHDF2可以使CB HSCs数量增加,并且在免疫缺陷小鼠体内具有长期植入能力。通过单个表观遗传修饰可以多靶点、多路径地影响CB HSCs自我更新,这比其他专注于单个靶点或途径的研究更为高效。鉴定YTHDF2的特异性小分子抑制剂可能成为改善CB HSCs移植的新热点[25]。
五、共培养系统提供重要的扩增微环境
人胎肝和BM造血龛是支持HSCs存在的特定微环境,由不同类型的细胞及其分泌的多种细胞因子和趋化因子组成,通过与HSCs接触严格调控HSCs的静止、自我更新、增殖和分化等生命活动[2]。1977年,Dexter等[26]使用BM基质细胞作滋养层,发现有助于HSCs离体长期培养,由此促进了共培养系统的发展。目前,HSCs-骨髓间充质干细胞(MSC)共培养系统被定位为支持HSCs离体扩增最有价值的平台[27-28]。近期研究发现,人胎肝CD34loCD133lo细胞能够有效支持HSCs的离体扩增[29]。但共培养系统中滋养层细胞的变异因素是不稳定的,这也是阻碍共培养系统发展的关键技术问题。
六、低氧培养有助于CB HSCs离体扩增
在稳态条件下,HSCs所处的体内微环境是低氧的(1 ~ 6% O2),HSCs自 身 也 表现 为 细 胞 内 缺 氧 状 态(0.1 ~ 1% O2)。HSCs依赖于糖酵解代谢维持静止,HSCs表达的缺氧诱导因子(HIF)-1α在常氧条件下易快速降解,在低氧条件下可以稳定存在并与HIF-1β结合,激活糖酵解,促进HSCs自我更新[30]。在缺(低)氧条件下,CXCR4(CD184)基因表达增加并具有统计学意义,即归巢能力增强[31]。使用抗氧化剂或p38 MAPK抑制剂可以维持低活性氧(ROS)水平,利于保护HSCs免受氧化应激,抑制细胞衰老和分化。因此,如何通过ROS浓度的药理学调节以及ROS信号传导途径来促进离体HSCs扩增,仍有待进一步探索[32]。
随着对HSCs自我更新和增殖机制的理解及探索,对SMCs高通量筛选方法的革新,越来越多的科研成果证明了CB HSCs体外扩增的可行性。在目前的离体扩增方法中,细胞因子被认为是必不可少的,细胞因子联合SMCs进行高效率的扩增显示出HSCs体外扩增的强大潜力。科学家们对细胞因子的化学取代也在进行探索并取得了一些成果,这对将CB HSCs离体扩增产物向临床批量化标准生产有重要意义。此外,SMCs主要影响一些关于HSCs自我更新的信号途径,调节这些关键信号对HSCs离体扩增是非常重要的。目前来看,应用于CB HSCs离体扩增的小分子在许多临床试验中完成了Ⅰ(Ⅱ)期,正在进行Ⅱ(Ⅲ)期多中心临床试验,初步验证了有效性和安全性(表2)。相信在不久的将来,HSCs体外扩增可以建立标准化的平台,有力推进干细胞修饰等更多功能性研究。

