不同坡向凋落物分解对土壤微生物群落的影响
龙 健,赵 畅,张明江,吴劲楠,吴求生,黄博聪,张菊梅
贵州师范大学贵州省山地环境重点实验室, 贵阳 550001
在森林生态系统中,凋落物的养分释放是以微小土壤动物和微生物作用为主的凋落物分解过程,经土壤动物、真菌、细菌、放线菌等分解者及各种酶系统的辅助下将复杂的有机化合物分解转化为简单的盐类分子和能被植物吸收的物质,对土壤质量的提高及森林生态系统的稳定都具有重要作用。土壤微生物是陆地生态系统的主要活性组分,在土壤有机质分解、养分循环和生态系统稳定中起着关键作用[1]。对土壤微生物群落的研究多集中于不同植被类型或土地利用方式的群落结构变化、微生物活性及其多样性等[2-3],例如,在温带草地生态系统中,土壤微生物分解活性、多样性及丰富度随植被多样性呈显著线性增加[4];真菌磷脂脂肪酸(PLFA)含量在松林土壤显著高于其他植被类型(榉木、橡木、云杉)[5]等。土层深度的增加导致土壤有机质含量降低,用于微生物代谢的物质来源减少,导致微生物生物量、活性及群落结构与表层土壤表现不同[6]。地上植被类型、土壤环境等因素对土壤微生物的影响主要是由微生物能量来源的改变引起的,而凋落物分解是实现生态系统物质循环和能量流动的关键过程,因此,研究凋落物分解对土壤微生物群落的影响,更有助于对生态系统结构与功能相统一的分析。
现阶段,大量学者通过盆栽与分解袋相结合的控制实验、植物残体的添加和去除实验以及野外原位观测实验等对土壤微生物群落的响应进行研究[7- 9],主要侧重于土壤微生物群落的变化,而对凋落物分解过程中的质量损失、养分释放等与微生物群落之间关系的研究还较少。喀斯特地貌是我国四大生态环境脆弱区之一[10],土壤浅薄不连续、岩石裸露率高,易渗漏和易临时性干旱等特点[11],严重限制了植被的生长。贵州茂兰国家自然保护区保存着全球同纬度地带面积最大的原生性喀斯特森林[12],对其生态系统中土壤微生物群落特性的研究多与不同植被类型、恢复方式的土壤理化性质相联系[13- 15]。因此,本研究对茂兰喀斯特森林不同坡向凋落物进行为期1年的模拟自然分解研究,提出如下问题:1)不同坡向的凋落物在分解过程中的质量损失和元素释放呈现何种规律?2)不同坡向的凋落物分解过程中微生物群落如何变化?3)坡向及凋落物分解对微生物群落的影响。
1 材料和方法
1.1 研究区和样地概况
研究区域位于贵州省黔南州茂兰国家级自然保护区内(107°52′10″—108°05′40″ E, 25°09′20″—25°20′50″ N),面积约221 km2,海拔范围为430—1078 m,具有典型的喀斯特峰丛漏斗和峰丛洼地地貌,如图1。该区年平均气温为15.3℃,相对湿度为83%,年均降雨量为1389.1 mm,全年日照时为1272.8 h,属于中亚热带湿润季风气候。样地设在该保护区内,土壤以碳酸盐岩发育的黑色或棕色石灰土为主,pH 5.86—7.26,土层浅薄,岩石裸露率高达80%,研究区域以常绿阔叶落叶植被为主,如青冈(Quercusglauca)、中华蚊母树(Distyliumchinense)、圆果化香(Platycaryalongipe)等,林下灌木有南天竹(Nandinadomestica)、小叶柿(Diospyrosdumeforum),草丛有长圆叶楼梯草(Elatostemaoblongifolium)、石蒜(Lycorisradiate)、翠云草(Selaginellauncinata)等蕨类植物。

图1 茂兰喀斯特森林地理地貌示意图Fig.1 The geographical landscape map of Maolan Natural Reserve
1.2 实验设计
选取茂兰喀斯特核心区原生林立地条件基本一致的两种坡向(阳坡和阴坡),各坡向设置3块20 m×20 m的样地,共6块样地。于2016年4月,收集各样地内的混合凋落物共1500 g,带回实验室烘干至恒重,分别称取15 g烘干凋落物装于大小为15 cm×15 cm的分解袋(孔径为1 mm)内,并在5月份分别放置于各样地地表凋落物下层,让其自然分解,每个样地放置12个分解袋,共放置3(重复)×3(样地)×4(采样次数)×2(坡向)=72个分解袋,样地信息如表1所示。

表1 样地基本特征
DBH:胸径,Diameter at breast height
分别于凋落物分解第90天、180天、270天和360天后收集各坡向放置的分解袋,并在分解前期及分解过程中采用“A”字形采样法采集位于分解袋下方0—10 cm的土壤样品,每个样地重复3次,用于测定凋落物分解前后土壤微生物性质变化特征。将带回的分解凋落物清除杂根、泥土等,用去离子水清洗干净,烘至恒重(65℃,24 h),计算剩余质量干重及质量损失率,取部分样品剪碎过2 mm筛,用于养分测定;将采集的土壤除去枯枝落叶、石子等杂物后,分为3份,一份置于阴凉处自然风干,用于测定理化性质,一份过2 mm筛并置于-20℃环境中,用于微生物性质测定,剩余部分置于4℃冰箱内,用于后期备用。所有样品2周内完成分析,土壤基本理化性质如表2。

表2 土壤基本性质
TC:全碳,Total carbon;TN,全氮,Total nitrogen;TP,全磷,Total phosphorus;C/N,碳氮比值,Rate of carbon and nitrogen 小写字母表示不同坡向土壤理化性质差异显著,P<0.05,n=3
1.3 样品测定
凋落物:全碳(TC)、全氮(TN)采用全自动碳氮分析仪(Vario Ⅲ,Elementar,德国)测定,全磷(TP)用硝酸-高氯酸消煮-钼锑抗比色法。
土壤:全碳(TC)、全氮(TN)用全自动碳氮分析仪(Vario Ⅲ,Elementar,德国)测定,全磷(TP)用硫酸-高氯酸消煮-钼锑抗比色法,pH采用土水比为1∶2.5的玻璃电极法测得。
土壤微生物:参考Frostegard等[16]的磷脂脂肪酸(PLFA)分析法,主要过程包括土壤浸提、分离、提纯、萃取磷脂、酯化形成脂肪酸甲酯,正己烷溶解后用气相色谱仪(Agilent 6890 N,美国)结合MIDI微生物识别系统(MIDI,Inc.,Newark,DE)鉴定,i14:0、i15:0、i16:0、i17:0、a15:0、a17:0、16:1ω9c、16:1ω7c、18:1ω7c、18:1ω5c、cy17:0、cy19:0指示细菌群落(Bacteria, B),18: 1ω9c和18: 2ω6,9c指示真菌群落(Fungi, F),10Me- 16: 0、10Me- 17: 0、10Me- 18: 0指示放线菌(actinomycetes, ACT)[17]。
1.4 数据处理
凋落物质量损失率公式:
Dw=(ΔM/M0)×100%
式中,Dw表示一个分解期内凋落物的质量损失率(%),ΔM表示一个分解期内凋落物分解袋内样品的损失质量(g),M0表示放置分解袋时样品质量(g)。
营养元素释放率公式:
E=[(e0-e)/e0]×100%
式中,E表示一个分解期的凋落物元素释放率(%),e表示一个分解期后凋落物的养分量(g),e0表示凋落物的初始养分量(g)。
所有数据处理和统计分析均基于Excel 2003和SPSS 18.0进行。差异显著性检验(P<0.05)采用One-way ANOVA和LSD法,通过Spearman相关分析确定土壤微生物群落组成与凋落物之间的关系。相关图例用Origin 8.5软件进行绘制,数据均为平均值±标准差。
2 结果与分析
2.1 凋落物分解过程中的质量变化

图2 不同坡向凋落物在分解期间的剩余质量 Fig.2 The remaining mass of litter during decomposition in different slopes*, P<0.05
凋落物分解剩余质量变化如图2所示,阳坡和阴坡分解袋内的凋落物剩余质量随分解时间的增加而减少,为期360 d的分解后,凋落物剩余质量分别为4.11 g和4.47 g,约损失了73.3%—70.2%,且阳坡的凋落物质量损失率高于阴坡,分解180 d后差异显著。阳坡和阴坡的凋落物均表现出在分解前90 d的质量损失最大(损失约4.87—5.34 g),分解前180 d的质量损失约占总质量损失的79%,而在180—270 d的质量损失仅占6.38%—9.56%。
2.2 凋落物分解过程中的养分变化
凋落物自然分解过程中,碳、氮、磷含量变化随分解时间表现不同(图3)。凋落物全碳含量整体表现出释放模式,分解1年后的凋落物全碳含量与初始碳含量均表现为:阳坡>阴坡,阴坡凋落物全碳含量在分解过程中逐渐降低,而阳坡在分解270 d最低(33.2%);凋落物全氮含量整体表现为富集,阴坡凋落物全氮含量随分解约增加0.52%,阳坡凋落物在分解前90 d逐渐降低,90—180 d逐渐增加至最大(2.81%),且高于阴坡,分解360 d后的阳坡和阴坡凋落物全氮含量相差最大;C/N比值逐渐降低,分解1年后阴坡凋落物C/N比值降低至12.9,显著低于阳坡;凋落物全磷含量在分解过程中表现为逐渐释放,且阴坡>阳坡,变化趋势较为一致,阳坡和阴坡的凋落物全磷含量在分解360 d后分别为0.59 g/kg和1.09 g/kg。

图3 凋落物碳、氮、磷含量及C/N比值在分解过程中的变化Fig.3 The content changes of litter Carbon, Nitrogen, Phosphorus and C/N rate during decomposition
凋落物在分解过程中的营养元素释放率如表3所示,凋落物氮元素表现为富集,而碳和磷元素表现为释放。阳坡凋落物碳元素在分解第270天时的释放率达到最大(27.7%),随后释放率在分解360 d时降低至9.19%,而阴坡凋落物碳元素释放率在360 d时增加至最大(15.1%),阳坡凋落物氮元素分解在360 d后的氮元素释放率达到最大(22.3%);凋落物磷含量在分解过程中表现为先释放后在分解270—360 d逐渐富集,阳坡在分解90 d时达到最高(57.6%)后逐渐降低,阴坡凋落物的磷元素在分解180 d释放率最大(33.5%),均在分解270 d的释放速率最低(33.1%,16.5%)。

表3 凋落物在分解过程中的养分释放率
EC:碳元素释放率,Carbon element release rate;EN:氮元素释放率,Nitrogen element release rate;EP:磷元素释放率,Phosphorus element release rate
2.3 土壤微生物含量及群落结构变化
不同坡向凋落物分解过程中土壤微生物的总PLFA和各群落PLFA含量如图4、图5所示。分解前各坡向土壤微生物PLFA含量均无显著差异(图4),总PLFA含量范围约为136.9—161.6 nmol/g。随着凋落物的分解,土壤微生物总PLFA含量整体表现为增加,分解180 d和360 d的土壤微生物总磷脂脂肪酸含量表现较高,平均为536.4 nmol/g;分解90 d、180 d和360 d后土壤微生物总PLFA均表现为阳坡约高于阴坡49.6—81.5 nmol/g,而在分解270 d的阴坡土壤微生物PLFA含量显著高于阳坡,约196.4 nmol/g。

图4 土壤微生物PLFA总量Fig.4 The total biomass of soil microbial PLFA

图5 土壤微生物群落PLFA含量Fig.5 The content of soil microbial community PLFAs
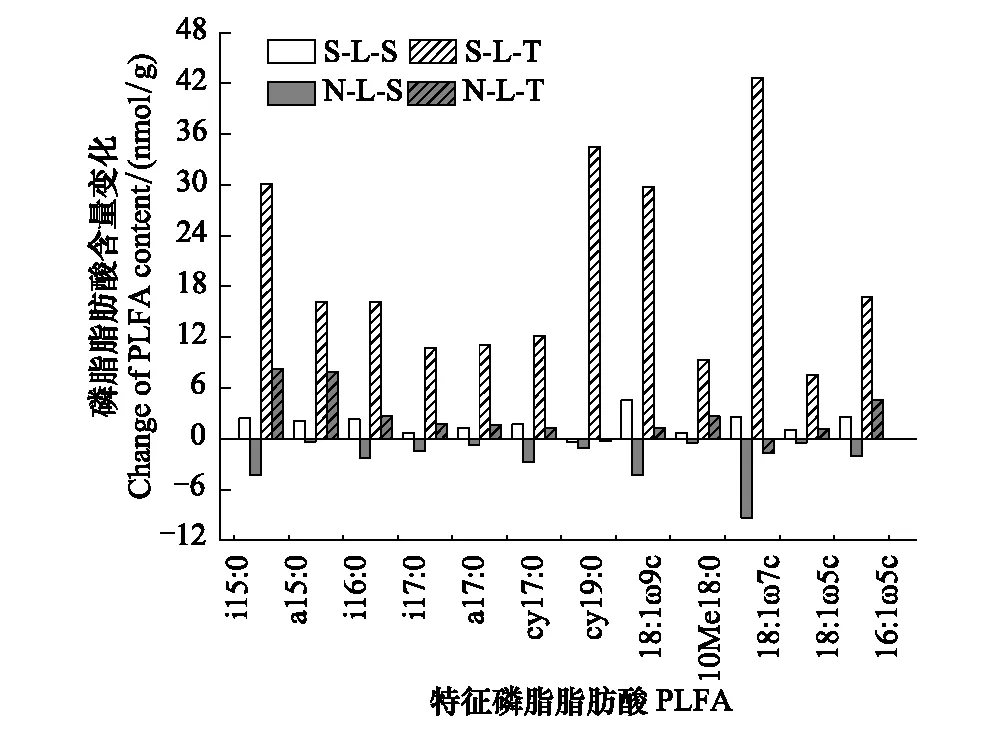
图6 土壤磷脂脂肪酸含量在分解过程中的变化 Fig.6 The change of soil PLFAs during the litter decompositionS-L-S:阳坡土壤磷脂脂肪酸在凋落物分解180 d至360 d的含量变化,The changes of soil PLFAs from 180-day to 360-day during litter decomposition in adret;N-L-S:阴坡土壤磷脂脂肪酸在凋落物分解180 d至360 d的含量变化,The changes of soil PLFAs from 180-day to 360-day during litter decomposition in ubac;S-L-T:阳坡土壤磷脂脂肪酸在凋落物分解270 d至360 d的含量变化, The changes of soil PLFAs from 270-day to 360-day during litter decomposition in adret;N-L-T:阴坡土壤磷脂脂肪酸在凋落物分解270 d至360 d的含量变化,The changes of soil PLFAs from 270-day to 360-day during litter decomposition in ubac
喀斯特区森林不同坡向的土壤微生物群落PLFA含量差异显著(图5),且在凋落物分解过程中差异表现不同。分解前,细菌PLFA含量约为54.1—63.8 nmol/g,真菌含量约为17.9—24.7 nmol/g,放线菌含量约为42.1—46.2 nmol/g。随着凋落物分解时间的增加,土壤微生物PLFA平均含量表现为:细菌(149.8 nmol/g)>放线菌(63.9 nmol/g)>真菌(31.3 nmol/g),凋落物的分解显著增加了微生物含量,其结构特征变化不显著。在凋落物分解前90 d、180 d和360 d的细菌和真菌PLFA含量在阳坡高于阴坡,而在分解270 d均低于阴坡,阳坡放线菌在分解90 d和180 d高于阴坡,在分解360 d低于阴坡。
将分解360 d分别与180 d和270 d的土壤微生物PLFA(相对含量>2%)比较,发现PLFA含量在不同坡向以及不同分解期的变化差异较大。如图6,阳坡凋落物在分解270 d至360 d的PLFA增加量显著高于分解180 d的增加量,其中以阳坡环境下凋落物分解270 d至360 d的细菌特征脂肪酸18:1ω7c含量增加最大,其次是cy19:0和真菌特征脂肪酸18:1ω9c,阳坡环境下凋落物分解180 d至360 d的磷脂脂肪酸含量增加最大的是真菌特征脂肪酸18:1ω9c,约增加5.53 nmol/g;阴坡磷脂脂肪酸含量在分解180 d至360 d表现为减少,其中以细菌特征脂肪酸18:1ω7c减少量最大,约减少9.42 nmol/g,其次是i15:0和真菌特征脂肪酸18:1ω9c,约减少4.29—4.86 nmol/g;丛枝菌根真菌的特征脂肪酸16:1ω5c在阴坡凋落物分解180 d至360 d的含量表现为降低,而阳坡含量变化均为增加,且以分解270 d至360 d的增加量最大。
2.4 凋落物性质对微生物群落结构的影响
凋落物养分释放与微生物群落结构的关系如表4所示,整体来看,阳坡微生物群落结构对凋落物的碳氮磷元素释放率有较强的相关性。凋落物碳元素释放率与阳坡环境下的真菌及F/B比值具有显著正相关关系(P<0.05),与阴坡环境的细菌群落有显著负相关关系(P<0.05);凋落物氮元素释放率与阳坡环境的细菌群落呈极显著负相关关系(P<0.01),与阴坡细菌呈显著正相关关系(P<0.05);凋落物磷元素释放率与阳坡和阴坡环境的F/B均呈显著负相关关系(P<0.01)。

表4 凋落物性质与土壤微生物群落的Spearman相关性分析
B:细菌,Bacterial;F,真菌,Fungal;ACT,放线菌,Actinomyces;F/B,真菌与细菌比值,Rate of fungal and bacterial; *:P<0.05;**:P<0.01;n=3
3 结果与讨论
3.1 凋落物的分解特征
由于纬度地带性决定适于环境的植被类型及凋落物性质不同,茂兰喀斯特原生林不同坡向的凋落物年质量损失率(70.2%—73.3%),显著高于温带兴安落叶松(54.8%)[18],且气候暖湿期相对较长,参与分解的微生物活性相对较强,因此凋落物分解相对较快,质量损失相对较大;与北亚热带及亚热带森林地表凋落物年质量损失率(40%—70%)[19- 20]相似,低于热带雨林和季雨林凋落物的年质量损失率(>70%)[21],表明地带性差异引起的温度对凋落物分解的影响较大。普遍认为在温度为3—25℃的范围内,温度越高,参与凋落物分解的微生物活性越强,凋落物分解越快[22]。本研究中的凋落物在分解90 d及360 d后分解速率相对较快,很可能由于该时期的气温回升快且雨水增多,与凋落物分解相关的几丁质酶、内切纤维素酶等随温度的升高而增加[23],降雨对凋落物具有一定的冲刷、粉碎作用,且增加土壤湿度,从而促进凋落物的分解。
凋落物的分解速率与自身碳、氮、磷元素的含量具有一定关系。在分解过程中,C/N比的变化与碳含量较为相似,均随分解时间的增加而降低,主要与凋落物在分解过程中氮元素的积累有关。茂兰喀斯特区原生林凋落物碳、磷含量随分解逐渐减少,而氮含量逐渐升高,与仲米财等[24]对同纬度低山地貌区的青冈、桤木、木荷、马尾松在分解过程中的元素含量变化较为一致,可能由于地理位置的相近与相似,且气候环境同属于亚热带湿润气候区,对植被的生长及养分的吸收具有一定的趋同性,且凋落物氮含量相对较高,C/N比值相对较小,凋落物分解速度相对加快,更多的有效性养分进入土壤,满足微生物在分解过程中对氮元素的需求,从而提高土壤微生物活性;茂兰喀斯特原生林凋落物营养元素初始含量相对高的在分解过程中易于释放,初始含量相对低的元素在分解过程中更易于富集,表明凋落物营养元素初始含量及分解环境等对分解过程中元素的释放与富集有显著的影响,因此对生态系统脆弱的喀斯特区进行凋落物营养元素分析,可以对该地区环境的变化和养分的循环进行分析与预测。
3.2 凋落物分解对土壤微生物的影响
凋落物的分解是由微生物主导的生物化学过程[25],凋落物营养元素含量、自身理化性质的差异,对微生物数量及群落结构具有选择作用,反之,微生物的组成、代谢及活性的变化也会决定凋落物的分解速率和养分循环,因此,微生物群落对土壤环境、植被类型及气候变化等的响应较单纯的土壤理化性质、凋落物养分更敏感。茂兰喀斯特原生林土壤微生物总PLFA在凋落物分解期间显著高于凋落物分解前,且在分解180 d及360 d的含量(513.2—559.5 nmol/g)显著高于分解前90 d和270 d(264.8—295.6 nmol/g),表明凋落物的加入为土壤微生物提供了丰富的能量来源,提高其活性,使含量增加。王巍巍等[26]对内蒙古科尔沁地区的樟子松人工林进行凋落物移除和加倍处理,发现加倍处理的土壤微生物PLFA总量显著高于凋落物移除,与本研究结果相似,进一步证实凋落物对土壤微生物含量具有一定影响,同时表明茂兰喀斯特原生林凋落物的添加及初始养分含量对土壤微生物活性和含量具有一定的促进作用。在凋落物不同分解时期,微生物PLFA总量、细菌和真菌含量均表现出阳坡高于阴坡,同时研究发现阳坡凋落物分解速率高于阴坡,表明坡向对微生物也具有一定影响,可能主要由于坡向改变了研究区的微气候,决定了土壤对太阳辐射吸收量的大小,从而影响土壤含水量和土壤温度,进而影响土壤微生物含量及群落结构。
土壤微生物群落作为凋落物分解的参与者,同时又受到凋落物分解过程的影响。李亮等[27]对乌兰布和沙区人工林土壤微生物的研究发现,在土壤pH>8.5的环境下土壤3大类微生物群落含量表现与本研究相似,而细菌百分含量(约85%)显著高于本研究(约35%),表明中性和微碱性土壤环境更适宜细菌和放线菌生长,抑制真菌的生长,本研究区的土壤pH在5.3—7.2范围内,偏酸性环境导致细菌含量相对较低。随着凋落物的分解,细菌相对丰度逐渐降低,真菌相对丰度逐渐升高,放线菌相对丰度变化不显著。真菌相对丰度与凋落物碳含量的相关性表明凋落物分解对真菌群落具有一定的影响,其本质主要是凋落物碳物质的分解与和真菌高度相关的纤维素酶和β-葡萄糖苷酶有关决定的[28]。随着凋落物分解,难分解物质如纤维素的比例逐渐增加,微生物能量来源减少,而对底物利用能力的不同,导致真菌相对丰度上升,细菌相对丰度降低[29]。对森林不同坡向及坡位的土壤微生物的研究,发现海拔、坡向和植被类型等对微生物群落变化的影响较为显著,这主要由于土壤微生物群落的组成与土壤深度、温度和水分含量及养分来源等环境因素紧密相关[30]。李珊珊等[31]同样采用分解袋野外原位分解法,发现凋落物分解后的土壤真菌和细菌PLFA含量增加,影响微生物群落变化的主导因子是坡度、坡向和海拔等地形因素,其次是凋落物机制质量。罗媛媛等[32]对常绿阔叶林木荷凋落叶的分解速率的研究发现,土壤动物尤其是弹尾目动物对凋落物木质纤维的破碎和取食有助于微生物对凋落物后期的分解。随着凋落物的分解,微生物各群落的表现不同,在土壤动物和微生物的相互作用下,茂兰喀斯特森林凋落物的年分解速率显著高于其他非喀斯特森林[33]。
综合分析发现凋落物分解对土壤微生物的影响不仅是由于提供的可利用养分的变化导致的,还与分解过程中土壤环境的变化密切相关。凋落物初始养分含量及分解过程中养分的释放对土壤微生物的生长与分布具有一定的选择作用,凋落物碳氮比值低导致更易分解,向土壤输送大量有机碳,加之分解过程中温湿度的改变(增加),植被自身也因生长过程中由根系分泌丰富的有机物质,促进微生物的生长。真菌细菌比常用于反映分解过程中微生物群落结构的变化,也常被用于评价土壤生态系统的稳定性。较高的真菌细菌比值表明真菌生物量及真菌菌丝体增加,能够固定更多土壤养分,使土壤生态系统趋于稳定[34]。本研究中随着分解的进行,真菌细菌比值逐渐减小,主要由于细菌生物量不断增加而真菌量变化不大,这可能与凋落物性质有关,含氮量高、碳氮比低的凋落物更利于细菌生长,表明喀斯特落阔叶混交林中参与凋落物分解的微生物以细菌为主。因此,对土壤微生物和凋落物分解关系的研究,为全面而准确地判断喀斯特区森林生态系统稳定性和可持续性提供可靠的基础理论。
4 结论
(1)凋落物年平均质量损失率约为72%,且阳坡高于阴坡;凋落物分解过程中的磷元素的释放率显著高于碳元素,氮元素表现出富集的趋势;
(2)亚热带茂兰喀斯特区森林土壤微生物含量和群落结构在不同分解时期表现不同,凋落物分解显著改变了土壤微生物含量,细菌群落仍是该区土壤微生物的主要类群,其次是放线菌和真菌;土壤细菌特征磷脂脂肪酸18:1ω7c、cy19:0、i15:0和真菌特征磷脂脂肪酸18:1ω9c对环境变化具有一定的指示作用;
(3)凋落物在分解过程中真菌群落与碳元素释放率呈显著正相关关系,细菌群落与凋落物碳、磷元素的释放呈极显著正相关关系,且在阳坡的相关性高于阴坡;坡向及凋落物分解对喀斯特区土壤微生物群落具有显著的影响。

