一测多评法同时测定熟地黄中4种苯乙醇苷
邹献亮,陈 颋,华 腊,王永丽,侴桂新
(上海中医药大学中药研究所上海中药标准化研究中心,上海 201203)
熟地黄为生地黄的炮制加工品,具有补血滋阴、益精填髓功效[1]。地黄中主要含有环烯醚萜苷类、苯乙醇苷类、紫罗兰酮类、糖类等成分[2],目前有关地黄含有量测定的指标主要有地黄苷类成分[3-4]、梓醇[5-6],熟地黄中主要有还原糖[7]、5-羟甲基糠醛[8-9]以及核苷类成分[10]等。研究表明熟地黄在炮制过程中,主要化学成分会产生的变化,如地黄从鲜品加工成生地黄及熟地黄,梓醇的含有量降低至原来的 1/10[11]。苯乙醇苷类成分是地黄中主要活性成分之一,毛蕊花糖苷为其代表,该类成分具有抗氧化、自由基清除、抗肿瘤、神经元保护、肝脏保护、止痛、抗病毒、抗菌等多种生物活性[12],且在地黄的加工炮制过程中是较为稳定的一类化合物,可更好地体现其质量传递规律,可作为地黄加工炮制生产过程中的质量控制指标。但单一检测毛蕊花糖苷的含有量,受不同炮制方法影响,不同批次熟地黄中的含有量差异较大[13-14],很多批次难以达到0.02%的规定。因此本实验选择以毛蕊花糖苷为内参物,建立同时测定洋地黄叶苷C、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1 的一测多评法(QAMS)。
1 仪器与材料
1.1 仪器 美国Waters 公司e2695 型液相色谱仪(美国 Waters 公司,包括四元泵、自动进样器、柱温箱、检测器、工作站);Agilent 1200 高效液相系统、Agilent 1100 高效液相系统包括工作站(美国Agilent 公司);MG Ⅱ C18柱(4.6 mm × 250 mm,5 μm);Thermo C18柱(4.6 mm×250 mm,5 μm);Diamonsil C18柱(4.6 mm×250 mm,5 μm);分析天平(德国赛多利斯科学仪器有限公司);KQ-250DB 数控超声波清洗仪(昆山市超声仪器有限公司);DHG-9070A 型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.2 材料 对照品毛蕊花糖苷自制(含有量96.6%)、洋地黄叶苷 C 自制(含有量 96.9%)、焦地黄苯乙醇苷A1(含有量96.5%)、焦地黄苯乙醇苷B1(含有量97.8%)。17 批熟地黄和18 批生地黄购自成都、福州、上海等地,见表1~2,经上海中医药大学中药研究所吴立宏研究员鉴定为正品。乙腈、甲酸,均为色谱纯;超纯水自制;其余试剂均为分析纯。

表1 生地黄样品信息Tab.1 Information of Rehmanniae Radix
2 方法与结果
2.1 一测多评方法学考察
2.1.1 色谱条件 色谱柱为MGⅡC18(4.6 mm×250 mm,5 μm);流动相乙腈(A)-0.1% 甲酸溶液(B),梯度洗脱(0~35 min,12%~22% A;35~40 min,22%~32% B;40~45 min,32% B);体积流量 1.0 mL/min;检测波长 334 nm;进样量10 μL;柱温 30 ℃。此条件下,洋地黄叶苷 C、焦地黄叶苷A1、毛蕊花糖苷和焦地黄苯乙醇苷B1 分离良好,各组分的理论塔板数均>8 000。色谱图见图1。

表2 熟地黄样品信息Tab.2 Information of Rehmanniae Radix Praeparae
2.1.2 对照品溶液制备 分别精密称取洋地黄叶苷C、焦地黄苯乙醇苷 A1、毛蕊花糖苷、焦地黄苯乙醇苷B1 适量,加甲醇溶解并定容,制成质量浓度分别为 512、687.5、593.5、188.7 μg/mL 的对照品贮备液,再分别精密吸取4 个对照品贮备液各 1 mL 置于 5 mL、10 mL 量瓶中,加甲醇稀释至刻度,即得混合对照品溶液Ⅰ和Ⅱ,精密吸取对照品溶液Ⅰ1、0.8、0.6、0.4 mL 至 5 mL 量瓶中,加甲醇至刻度,分别制得混合对照品溶液Ⅲ、Ⅳ、Ⅴ、Ⅵ,避光保存。
2.1.3 供试品溶液制备 取本品最粗粉约2 g,精密称定,置圆底烧瓶中,精密加入 60% 甲醇100 mL,称定质量,加热回流 1 h,放冷,再称定质量,用 60% 甲醇 补足减失质量,摇匀,过滤,精密量取续滤液50 mL,减压回收溶剂近干,残渣用流动相溶解,转移至10 mL 量瓶,加流动相至刻度,摇匀,0.45 μm 微孔滤膜过滤,取续滤液,即得。
2.1.4 线性关系考察 分别精密吸取系列质量浓度的混合对照品溶液Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ10 μL,注入液相色谱仪,记录色谱图。以峰面积为纵坐标(Y),进样量为横坐标(X)进行回归,得洋地黄叶苷C、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1 的回归方程及线性范围,结果见表3。表明各成分在各自范围内线性关系良好。

图1 各成分HPLC 色谱图Fig.1 HPLC chromatograms of various constituents
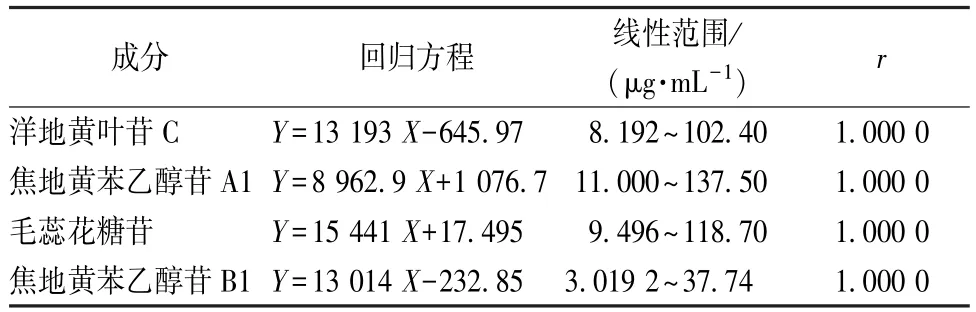
表3 熟地黄中各成分线性关系Tab.3 Linear relationships of various constituents in Rehmanniae Radix Praeparae
2.1.5 精密度试验 精密吸取熟地黄供试品溶液10 μL,在 “2.1.1”项色谱条件下,于同 1 天连续进样6 次,结果显示,洋地黄叶苷C、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1 峰面积积分值 RSD 分别为 0.89%、0.44%、0.34%、0.37%。精密吸取同一供试品溶液10 μL,连续进样 3 d,6 次/d,记录峰面积,以上 4种成分的日间精密度分别为 1.07%、1.23%、0.32%、0.56%。表明仪器精密度良好。
2.1.6 重复性试验 取同一批次样品6 份,每份2 g,精密称定,按 “2.1.3”项下方法制备供试品溶液,测得洋地黄叶苷 C、焦地黄苯乙醇苷 A1、毛蕊花糖苷、焦地黄苯乙醇苷B1 的峰面积。计算质量分数 RSD 分别为 1.30%、1.10%、1.37%、2.01%。表明该方法重复性良好。
2.1.7 稳定性试验 取同一份供试品溶液,分别于制备后 0、2、4、8、16、24、48、72 h 进样,进样体积为10 μL,测定洋地黄叶苷C、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1 峰面积的 RSD 分别为1.08%、1.30%、0.32%、0.73%。表明供试品溶液在72 h 内稳定性良好。
2.1.8 加样回收率试验 精密称取已测定的样品1 g,精密称定,平行 6 份,分别按各成分质量浓度的100%精密加入洋地黄叶苷C、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1 对照品溶液,按 “2.1.3”项下方法制备供试品溶液,在“2.1.1”项色谱条件下进样。测得洋地黄叶苷C、焦地黄苯乙醇苷A1、毛蕊花糖苷、焦地黄苯乙醇苷B1 的平均加样回收率分别为98.30%、99.15%、98.31%、101.88%,RSD 分别为 1.35%、1.33%、1.12%、1.19%。
2.2 QAMS
2.2.1 相对校正因子f多点法计算 以毛蕊花糖苷为内标,分别计算洋地黄叶苷C、焦地黄苯乙醇苷 A1、焦地黄苯乙醇苷 B1 的f,分别为 0.851、0.584、0.841,RSD 分 别 为 0.49%、0.7%、0.93%,见表4。
2.2.2f斜率法计算 根据线性方程,分别计算洋地黄叶苷C、焦地黄苯乙醇苷A1、焦地黄苯乙醇苷 B1 的f,分别为 0.854、0.580、0.843。
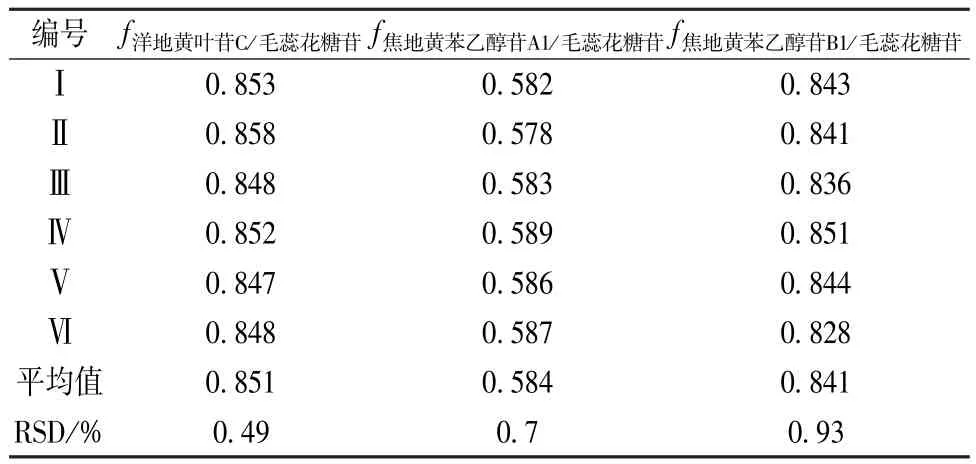
表4 熟地黄中其他3种成分的相对校正因子Tab.4 Relative correction factor of three other components in Rehmanniae Radix Praeparata
2.2.3 待测组分色谱峰定位 利用相对保留时间(rk/s,k为待测组分,s 为对照物)定性,测得洋地黄叶苷C、焦地黄苯乙醇苷A1、焦地黄苯乙醇苷 B1 的rk/s,分别为 0.546、0.746、1.056,RSD分别为 0.07% 、0、0,见表5。
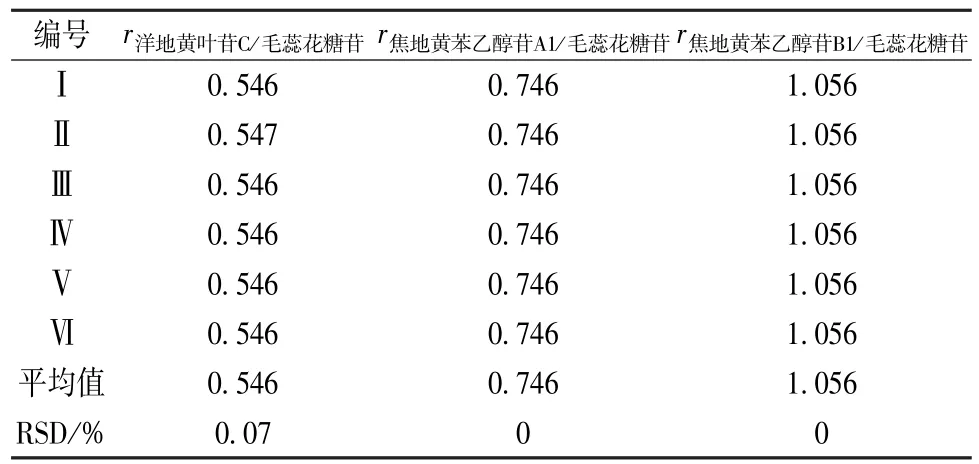
表5 熟地黄中其他3种成分的相对保留时间Tab.5 Relative retention time of three other components in Rehmanniae Radix Praeparata
2.2.4f重现性考察 实验考察了Agilent 1100、Agilent 1200、Waters 型3种高效液相色谱系统和Diamonsil(250 mm × 4.6 mm,5 μm)、Thermo(250 mm × 4.6 mm,5 μm)、MGⅡ(250 mm ×4.6 mm,5 μm)3种色谱柱。结果表明,各种条件下所得 RSD<5.0%,分离效果比较理想,见表6。

表6 相对校正因子重现性考察Tab.6 Reproducibility of relative correction factors
利用rk/s进行色谱峰的定位,结果显示,在不同色谱柱下rk/s波动较小,测定得到rk/sRSD 值均小于3%,表明在不同色谱柱下,rk/s的重现性良好,见表7。

表7 不同仪器和色谱柱测得rk/sTab.7 rk/s value determined by different instruments and columns
2.3 QAMS 和外标法(ESM)比较 按 “2.1.3”项下方法制备17 批熟地黄样品和18 批生地,在“2.1.1”项色谱条件下,分别精密吸取混合对照品溶液Ⅱ、供试品溶液各10 μL,注入高效液相色谱仪,采用外标法和一测多评法计算地黄中洋地黄叶苷C、焦地黄苯乙醇苷 A1、毛蕊花糖苷、焦地黄苯乙醇苷 B1 的含有量,结果见表 8~9。将 2种方法所得含有量经SPSS 软件采用t检验分析二者差异,结果表明,在熟地黄中,2 组数据洋地黄叶苷C、焦地黄苯乙醇苷A1、焦地黄苯乙醇苷B1P值分别为 0.958、0.961、0.997,均大于 0.05;在生地黄中2 组数据洋地黄叶苷C、焦地黄苯乙醇苷A1、焦地黄苯乙醇苷 B1P值分别为 0.998、0.970、0.926,均大于 0.05。故各成分外标法实测值与一测多评法计算值间无显著差异。表明QAMS 法用于地黄药材的多成分质量评价研究是可行的。

表8 QAMS 与ESM 测定熟地黄中4种成分含有量比较Tab.8 Comparison of contents of four components in Rehmanniae Radix Praeparata by QAMS and ESM

表9 QAMS 与 ESM 测定生地黄中4种成分含有量比较Tab.9 Comparison of contents of four components in Rehmanniae Radix by QAMS and ESM
3 讨论
本实验首次运用QAMS 建立了地黄中4 个苯乙醇苷成分同时测定的方法。毛蕊花糖苷易得、化学性质相对稳定,而且在地黄植物中含有量很高,2015版 《中国药典》 中生地黄和熟地黄HPLC 含有量测定都采用毛蕊花糖苷作为指标成分,因而本实验选择毛蕊花糖苷作为内参物。这4 个苯乙醇苷类成分最大紫外吸收都为 334 nm,因此选择334 nm为检测波长。在毛蕊花糖苷与洋地黄叶苷C、焦地黄苯乙醇苷A1、焦地黄苯乙醇苷B1 的相对校正因子的评价中,经查阅文献[15-17],实验考察了不同进样浓度、色谱柱、液相色谱仪、柱温、体积流量、流动相 pH 值的影响。结果表明,在本实验条件下相对校正因子具有很好的重现性。对色谱峰定位中,采用相对保留时间结合紫外吸收光谱,增加准确性。实验选取了不同来源的17 批熟地和18 批生地药材进行比较,结果表明一测多评法与外标法在地黄中4种苯乙醇苷类成分的测定中无显著差异。17 批熟地4种苯乙醇苷物质含有量总和在0.04%~0.2%之间,18 批生地4种苯乙醇苷成份在0.045%~0.25%范围内。其中熟地前3批由前3 批生地黄加工炮制而成,结果表明地黄经炮制后4种苯乙醇苷成分含有量有所下降,与张波泳等[18]所报道的一致。本实验建立的 QAMS 为地黄的质量控制提供了新方法。